深度学习重建算法对肝脏图像质量及肝转移瘤诊断的研究
许艺馨,李辉坚,王国华,王铭君,张振
1.青岛大学附属青岛市市立医院 放射科,山东 青岛 266011;2.青岛市第八人民医院 放射科,山东 青岛 266121;3.GE中国CT影像研究中心,上海 200240
引言
CT是检测肝转移瘤最常用的影像学方法,随着现代技术的不断革新,计算机断层扫描技术不断发展[1-3]。传统的滤波反投影(Filter Back Projection,FBP)算法依赖的是噪声与空间分辨率之间的线性关系,且算法易受统计波动的影响,投影数据不足,图像质量会明显降低[4-5]。与FBP相比,多模型迭代重建(Adaptive Statistical Iterative Reconstruction-Veo,ASiR-V)算法改进了噪声模型、物体模型及物理模型,在降低噪声、提高密度及空间分辨率方面得到极大的改善[6-9],在高对比度诊断任务中表现突出。但是,有报道指出,ASiR-V图像的噪声纹理看起来“平滑”“塑料感”或“不自然”[10-11],这会对低对比度病变的检测产生不利影响。
为了解决上述算法的不足,一种新型的基于深度学习的图像重建(Deep Learning Image Reconstruction,DLIR)算法正在蓬勃发展。这项技术是以深度神经网络(Deep Neural Network,DNN)为基础,以大量高剂量FBP图像和原始数据作为训练集,在低剂量或非理想扫描条件下的CT数据也可以进行高质量图像重建[12]。有研究表明,DLIR能有效改善图像质量,并且对于解剖和细小结构的显示具有明显优势[2,13]。本研究旨在通过与FBP及ASiR-V相比,评价DLIR对肝脏转移瘤患者CT图像质量的影响,以期获得较高的图像质量,并为临床诊断提供更清晰的病灶显示和更高的诊断信心。
1 资料与方法
1.1 一般资料
将2020年5至12月在青岛大学附属青岛市市立医院就诊,符合如下标准的肝脏肿瘤患者纳入研究。纳入标准:① CT图像显示清晰,无较大伪影者;② 已确诊为其他部位原发肿瘤(经病理证实),且经病理或后期增强CT随访证实的肝转移瘤患者;③ 体质指数在18.5~23.9 kg/m2;④ 患者均有腹部CT平扫和动态增强扫描图像。排除标准:① 呼吸无法配合、影响图像测量和评价者;② 严重图像伪影者。最终纳入研究者有32例,其中男18 例,女14 例;年龄40~82 岁,平均(55.8±12.75)岁。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 仪器与方法
患者采用GE 256排Revolution CT机(GE Healthcare,Milwaukee,WI,USA)行腹部常规辐射剂量扫描,仰卧位,头先进。双手上举交叉抱头,扫描前进行呼吸训练,吸气后屏气扫描,并对甲状腺及盆腔进行防护。扫描参数:管电压120 kV,采用智能管电流调控Smart mA模式,管电流范围250~500 mAs,噪声指数8.5 HU,螺距0.992,转速0.8 s/r,层厚及层距均为5 mm。先进行平扫,然后进行增强扫描。增强采用高压注射器注入碘对比剂(320 mgI/mL)70 mL,流速2.2 mL/s。注射对比剂后分别在30、50和120 s行动脉期、门静脉期和平衡期扫描,扫描结束后记录CT容积剂量指数(Computed Tomography Dose Index,CTDIvol)、剂量长度乘积(Dose Length Product,DLP)和有效剂量(Effective Dose,ED)。
1.3 图像重建
将门静脉期扫描原始数据分别采用0 ASiR-V(FBP)、30% ASiR-V、DLIR-L、DLIR-M、DLIR-H进行图像重建,重建层厚1.25 mm,窗宽300 HU,窗位45 HU。将5组重建图像传入AW 4.7后处理工作站用于图像测量和评价。
1.4 图像评价
1.4.1 图像客观评价
5组薄层重建横断位图像上,选取病灶显示最清晰或病灶最大的层面,在层面上下连续3个层面上测量病灶实质部分及相邻正常肝组织的CT值、右侧椎旁肌肉的噪声值(Standard Deviation,SD)值,以肌肉SD值作为图像背景噪声。感兴趣区(Region of Interest,ROI)大小为20~40 mm2,病灶ROI的选取应尽量避开坏死、出血、钙化等区域;肝组织ROI的选取应尽量避开肝内胆管、血管等区域。每个参数测量三次取平均值。计算健康肝脏和病灶处信噪比(Signal to Noise Ratio,SNR)和病灶处对比噪声比(Contrast to Noise Ratio,CNR),SNR肝脏/病灶=CT肝脏/病灶/SD肌肉;CNR=(CT肝脏-CT病灶)/SD肌肉。
1.4.2 图像主观评价
由2名工作5年以上且经验丰富的放射科诊断医师采用5分制对5组重建图像质量进行双盲主观评分。评价内容包括:① 图像质量,采用5分法:5分,图像质量优;4分,图像质量较好;3分,图像质量尚可;2分,图像质量较差,影响诊断;1分,图像质量差,无法用于诊断;② 病灶显示(包括病灶边缘、病灶内小囊变、小血管等),采用5分法:5分,显示清晰;4分,显示较好;3分,显示欠佳;2分,显示模糊;1分,完全不能显示;③ 诊断信心度,5分法:5分,完全有信心诊断为转移瘤;4分,较有信心诊断为转移瘤;3分,提示转移瘤可能;2分,仅提示病变,转移瘤不能除外;1分,完全不能诊断。
1.5 统计学处理
采用SPSS 21.0统计分析软件,计量资料以均值±标准差(±s)表示。客观评分各参数组间差异采用Kruskal-Wallis检验正态性,组间多重比较采用多个独立样本检验。主观评分使用秩和检验。2名放射科医师对图像质量主观评分的一致性采用Kappa检验,以P<0.05为差异有统计学意义。
2 结果
2.1 病人情况和辐射剂量
全部病例中,经病理证实者8例,临床资料证实者24例。其中22例为结直肠癌肝转移,5例为胰腺癌肝转移,3例为胃癌肝转移,1例为乳腺癌肝转移。门静脉期扫描的平均CTDIvol为(16.30±2.79)mGy,DLP为(557.48±104.37)mGy.cm,ED 为(8.51±1.55)mSv。
2.2 5种重建图像评价
在门静脉期5组图像中,DLIR组的SD值均低于FBP、30% ASiR-V,其中DLIR-H的SD最低(6.35±1.27),DLIR-M次之(P<0.001)。DLIR组中肝脏和病灶的SNR及病灶的CNR值均高于FBP、30% ASiR-V(P<0.001),其中DLIR-H的数据最佳,均明显优于其他算法结果(P<0.001)。具体数值如表1所示。
表1 5组重建图像客观测量参数的SD、SNR、CNR值(±s)
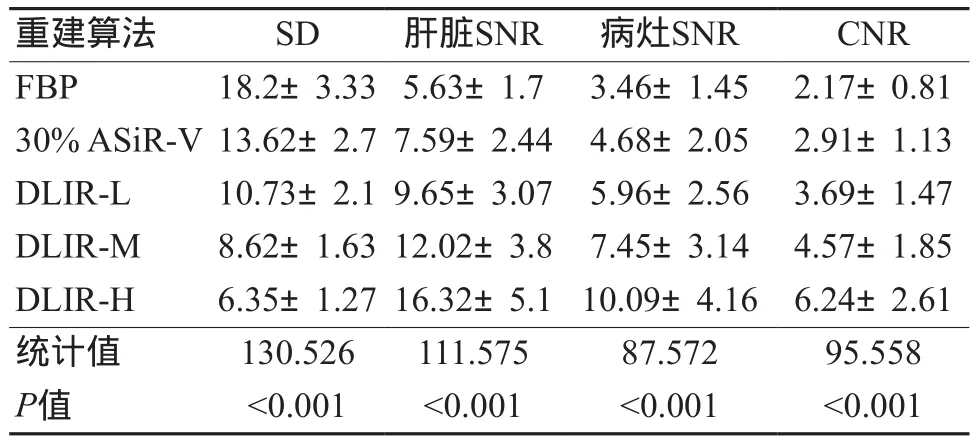
表1 5组重建图像客观测量参数的SD、SNR、CNR值(±s)
重建算法 SD 肝脏SNR 病灶SNR CNR FBP 18.2±3.33 5.63±1.7 3.46±1.45 2.17±0.81 30% ASiR-V 13.62±2.7 7.59±2.44 4.68±2.05 2.91±1.13 DLIR-L 10.73±2.1 9.65±3.07 5.96±2.56 3.69±1.47 DLIR-M 8.62±1.63 12.02±3.8 7.45±3.14 4.57±1.85 DLIR-H 6.35±1.27 16.32±5.1 10.09±4.16 6.24±2.61统计值 130.526 111.575 87.572 95.558 P值 <0.001 <0.001 <0.001 <0.001
2位放射科诊断医师的主观评分在图像质量的Kappa值为0.8,表现出高度的一致性。得分从FBP、30%ASiR-V到DLIR依次递增,DLIR-M(4.98±0.21)最佳,较FBP及30% ASiR-V增加48%、29%(P<0.001)。经多重比较之后发现,各组间差异均有统计学意义。具体数值如表2所示,图像质量如图1所示。
表2 5组重建图像的主观评分(±s)
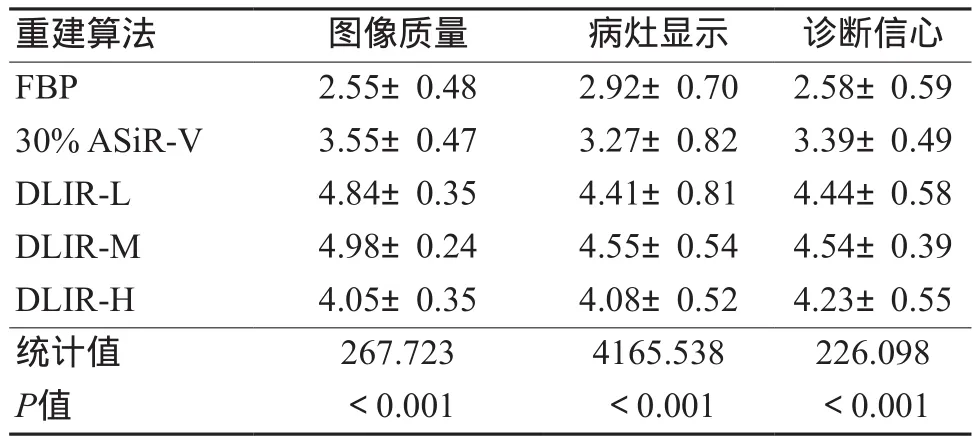
表2 5组重建图像的主观评分(±s)
重建算法 图像质量 病灶显示 诊断信心FBP 2.55±0.48 2.92±0.70 2.58±0.59 30% ASiR-V 3.55±0.47 3.27±0.82 3.39±0.49 DLIR-L 4.84±0.35 4.41±0.81 4.44±0.58 DLIR-M 4.98±0.24 4.55±0.54 4.54±0.39 DLIR-H 4.05±0.35 4.08±0.52 4.23±0.55统计值 267.723 4165.538 226.098 P值 <0.001 <0.001 <0.001
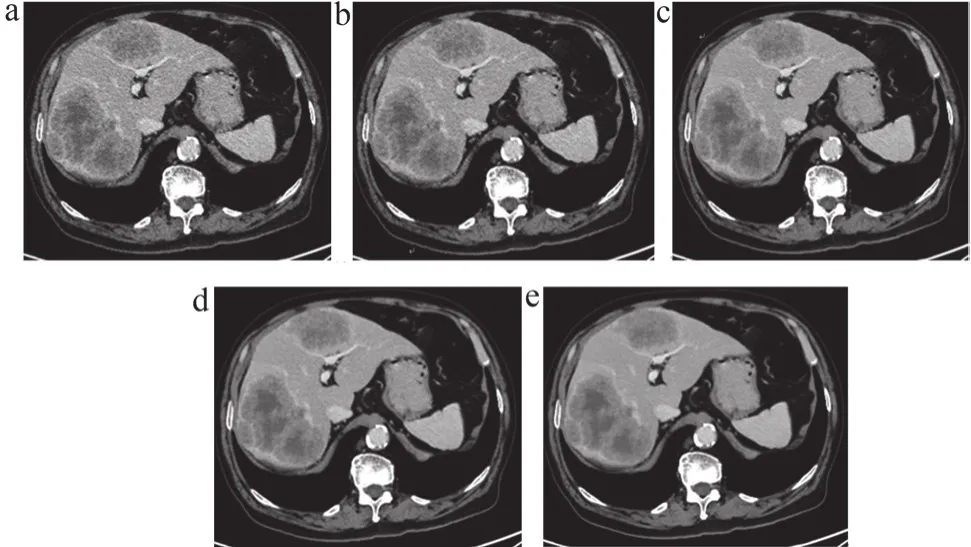
图1 患者直肠癌术后肝脏多发转移影像
2位放射科诊断医师对病灶显示的主观评价Kappa值为0.531,表现出一般的一致性。对病灶显示评分表现为DLIR得分高于30% ASiR-V,FBP算法的得分最低,其中DLIR-M(4.55±0.54)最佳(P<0.001)。经多重比较后发现,各组间差异均有统计学意义,其他组间差异均有统计学意义(表2)。
在诊断信心方面,2位放射科诊断医师的主观评分为0.703,表现出高度一致性。结果显示,DLIR表现明显优于ASiR-V及FBP,其中DLIR-M(4.54±0.39)最优(P<0.001)。经多重比较后发现,DLIR-M与DLIR-L之间差异没有统计学意义,其他组间差异均有统计学意义(表2)。
3 讨论
CT因其扫描速度快、图像分辨率高等优点,在临床上被广泛应用来评估肝脏疾病[14]。CT增强扫描在肝转移瘤诊断方面具有明显优势,但关于辐射剂量能引起恶性肿瘤的问题已经引起了人们的广泛关注[9,15-18]。对于恶性肿瘤患者而言,减少放射剂量可能会增加疾病诊断的难度[19]。因此,研究者一直努力平衡辐射剂量与图像质量之间的关系。这通常依赖于重建算法的技术进步[3,20]。典型的肝转移瘤表现为“牛眼征”,清楚地显示瘤体实性部分与内部坏死组织的对比差异是诊断的关键[21]。之前的研究揭示了ASiR-V的局限性,存在“蜡质”“过度平滑”等缺点,特别是在低对比度检测任务时,为病灶的检出及诊断带来风险[22]。而DLIR是以高剂量高质量的FBP图像作为训练目标,所以即使是低对比度诊断目标,DLIR重建的图像都应具有出色的图像质量和真实的噪声纹理[10,23-24]。本研究旨在对比传统FBP和ASiR-V,研究新型DLIR重建算法对肝脏图像质量和肝脏肿瘤诊断信心的提高。
Greffier等[25]的研究已经表明,对于像肝转移瘤这种对比度偏低的诊断任务,DLIR算法的检测能力高于其他算法。另外的一些研究也评估了DLIR重建技术在其他脏器中的应用。如Njølstad等[26]研究了在0.625 mm及2.5 mm层厚条件下,DLIR算法在肝脏实质、肝内血管结构、图像噪声和纹理方面的成像效果,结果显示相较于ASiR-V及FBP,DLIR提供了最优的图像质量。这些研究对比进一步肯定了DLIR重建算法的进步性及优越性。
本研究显示,在肝转移瘤图像中,相比于FBP和ASiR-V,DLIR表现出较好的降噪能力,并且随着DLIR重建水平的增加,降噪能力依次增加;同时也展示出了较高的CNR及SNR,其中DLIR-H表现最佳。但在2名放射科医师主观评分过程中,发现DLIR-H的图像“过度平滑”,存在不熟悉的塑料图像纹理,病灶内较小的血管及小囊变显示不清,导致图像对比度降低,并且与DLIR-L相比,整体图像质量显示欠佳,导致对疾病的诊断存在不确定性、信心不足。这是因为随着DLIR重建强度的增加,去噪能力增强,但由于去噪算法的局限性,去噪强度过高时,会导致图像纹理发生变化、成像的一些细小结构损失,图像质量变得模糊,进而导致诊断信心降低。因此,尽管在客观数据测量中DLIR-H表现最好,但DLIR-H并没有被评为最佳算法,而DLIR-M在提供了较好的降噪能力及图像纹理的同时也保留了病灶中小的细节,所以DLIR-M被评为最佳的图像重建算法。这与之前的报道一致[13],表明在常规辐射剂量条件下,DLIR-M在减少图像噪声和提高图像质量及诊断信心等方面表现最好。
本研究的局限性:① 样本量小;② 仅研究了门静脉期的图像质量;③ 图像客观参数的测量及主观评价受医师的影响;④ 只应用于常规剂量检查,没有将不同算法应用于低剂量检查中进行评估。在今后的研究中,需要进一步扩大样本量,增加对动脉期及平衡期图像质量的研究,邀请更多不同年资诊断医师参与主观评分,以确保统计的准确性和完整性,同时将低剂量检查应用于不同的重建算法来评估图像质量。
综上,DLIR作为一种先进的重建方法,提高了肝脏图像质量和肝脏肿瘤诊断信心。