miR-10b对三阴性乳腺癌化疗致敏性的作用研究*
郭晨明 李慧芳 欧提库尔·艾尼 罗志文 热艳娜·莫合塔尔 地力木拉提·艾斯木吐拉
新疆医科大学第一附属医院消化血管外科中心乳腺外科,新疆乌鲁木齐市 830054
乳腺癌主要指乳腺上皮组织在癌基因与抑癌基因分泌功能紊乱条件下,在促癌因子的作用下,呈恶性增生成肿瘤。三阴性乳腺癌具有发病年龄小,组织学分级高,细胞增殖比例较高,远处转移发生率高(尤以内脏转移显著)等特点,因此预后较差,生存期较短[1]。miRNA属于非编码RNA,通过与靶mRNA的互补配对,促进靶mRNA的降解或抑制蛋白质降解[2],参与细胞的代谢、增殖、分化和凋亡等生理过程,与恶性肿瘤的发生、发展密切相关,对于诊断恶性肿瘤、评估疗效及预后均具有积极作用[3]。miR-10b作为miRNA家族中的一员,miR-10b由碱基组成的单链小分子RNA,主要位于宿主基因的内含子中,有多项试验证明,miR-10b与宿主基因的mRNA表达一致,大量研究表明,miR-10b在乳腺癌、肝癌、胰腺癌等肿瘤组织中表达异常[4-6]。miR-10b在不同分子亚型的乳腺癌组织中表达水平亦有所差异,在三阴性乳腺癌组织中表达水平最高[7]。化疗在乳腺癌综合治疗中不可或缺,而如何提高乳腺癌化疗致敏性成为当前研究的热点。对此,本研究旨在研究miR-10b对三阴性乳腺癌化疗致敏性的作用。
1 材料与方法
1.1 标本及细胞株 本研究所用组织标本均来自我院2012年8月—2015年8月收治的34例采取化疗的三阴性乳腺癌患者,其中化疗敏感18例、化疗耐受16例,病情完全缓解12例、部分缓解22例,均为女性患者,单侧恶性肿瘤,年龄范围31~57岁,中位年龄46岁;经粗针穿刺活检,病理诊断为三阴性乳腺癌;本研究经医院伦理委员会批准,所有患者均签署知情同意书;另外,三阴性乳腺癌细胞株MDA-MB-231来源于上海研域生物科技有限公司。
1.2 主要试剂和设备 本研究使用胎牛血清由江苏宝莱生物科技有限公司提供,RPMI1640培养基和TRIzol试剂由上海昱都生物科技有限公司提供,LipofectamineTM2000由苏州拜吉氏生物科技有限公司提供,实时荧光定量PCR试剂由北京索莱宝科技有限公司提供;将miR-10b模拟物、miR-10b抑制物分别简称为A、B,并分别设立阴性对照(A-NC)组和(B-NC)组,A-NC、B-NC均由百奥迈科生物技术有限公司提供;紫杉醇由哈药集团生物工程有限公司提供,顺铂由上海恒远生物科技有限公司提供,阿霉素由浙江海正药业有限公司提供;使用ABI7700荧光定量PCR仪和FACS流式细胞仪。
1.3 方法
1.3.1 细胞培养:三阴性乳腺癌细胞株MDA-MB-231系用含有10%胎牛血清的RPMI1640培养基,室温下培养,每隔48~72h更换培养液,使用0.25%胰蛋白酶消化传代,取对数生长期的细胞用于后续实验研究。
1.3.2 应用实时定量RT-PCR检测miR-10b的表达水平:按照TRIzol试剂的说明书,提取三阴性乳腺癌细胞株和冷冻组织标本中的总RNA,使用TaqManmiRNA试剂盒进行反转录和荧光定量PCR,循环条件:在95℃环境下,预变性10min,在95℃、60℃环境下,分别循环15s、60s,40个循环;U6 snRNA作为内参;使用ABI7700荧光定量PCR仪进行RT-PCR;记录荧光信号到达阈值所经历的循环数即Ct值;通过设置复孔取平均值,即目的基因扩增的Ct值;miR-10b相对定量采用2-△△Ct法,△Ct值=目的基因Ct值-参照基因Ct值,△△Ct值=处理组目的基因△Ct值-对照组目的基因△Ct值。
1.3.3 应用脂质体介导miR-10b转染乳腺癌细胞株:检测MDA-MB-231细胞株中miR-10b表达水平后,使用脂质体转染方法,将三阴性乳腺癌细胞株转染miR-10b模拟物(A)和miR-10b抑制物(B),并分别设立阴性对照(A-NC)组和(B-NC)组。转染前24h应用不含抗生素的培养液传代,严格按照LipofectamineTM2000说明书进行脂质体转染,转染6h后,用含血清培养液继续培养并用于后续实验。
1.3.4 应用CCK-8方法检测肿瘤细胞增殖:细胞转染换液后、继续培养24h后消化,将细胞接种于96孔板中,每孔8×103个细胞,每组设3个复孔,在细胞贴壁后加化疗药,分别加入2μmol/L紫杉醇、2μmol/L顺铂及4μmol/L阿霉素;在加完化疗药物后,继续培养48h,应用CCK8法检测;将每孔原培养基弃掉,加入100μl的DMEM培养基,加入10μl的CCK8检测液,将待测板放置在培养箱后,使用酶标仪OD 450nm波长检测吸光度值。
1.3.5 应用流式细胞仪检测乳腺癌细胞的凋亡:收集各组不同化疗药物处理过的细胞,经消化后用1 000r/min离心8min,PBS洗涤2次,用结合缓冲液重悬细胞,并加入5μl Annexin V-FITC和5μl PI染色,避光孵育10min,应用流式细胞仪检测各组细胞中的DNA含量。
1.4 统计学方法 采用SPSS12.0软件处理实验数据,计量资料均采用均数±标准差表示,组间比较使用t检验,计数资料使用χ2检验;多组均数间比较采用单因素方差分析,两两比较用SNK-q检验;生存分析采用Kaplan-Meier法,采用双侧检验;以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-10b在三阴性乳腺癌组织中的表达 病情完全缓解组miR-10b表达水平为1.321±0.421,显著高于部分缓解组的0.863±0.354,差异具有统计学意义(P<0.05);化疗敏感组肿瘤组织miR-10b表达水平为1.187±0.365,显著高于化疗耐受组的0.786±0.349,差异具有统计学意义(P<0.05);肿瘤组织的miR-10b表达水平为0.998±0.276,显著高于癌旁组织的0.312±0.122,差异具有统计学意义(P<0.05);Kaplan-Meier生存曲线显示,三阴性乳腺癌的生存率与miR-10b的表达有关,miR-10b表达阴性的乳腺癌患者的生存率高于miR-10b表达阳性的乳腺癌患者,两者之间的比较有显著性差异(P<0.05),见图1。

图1 miR-10b表达对三阴性乳腺癌患者生存率的影响
2.2 转染后各组miR-10b的表达水平 比较A组与A-NC组、B组与B-NC组细胞株的miR-10b表达水平,其中A组细胞株的miR-10b表达水平较A-NC组明显提高,相对倍数达1.21×104;B组细胞株miR-10b表达水平较B-NC组明显提高,相对倍数达9.79×10-3;可见,转染效果明显。见表1。

表1 各组miR-10b的表达水平比较
2.3 各组无药物干预后的肿瘤细胞增殖率 细胞株培养48h后,A组、A-NC组、B组、B-NC组肿瘤细胞增殖率分别为(1.79±0.07)%、(1.76±0.05)%、(1.89±0.10)%、(1.83±0.14)%;A组与A-NC组、B组与B-NC组间的肿瘤细胞增殖率差异均无统计学意义(P>0.05)。
2.4 各组化疗药物干预后细胞增殖和凋亡的变化 比较A组与A-NC组、B组与B-NC组细胞株分别在紫杉醇、顺铂、阿霉素培养48h后的细胞增殖率、细胞凋亡率;A组细胞株在紫杉醇、顺铂进行培养48h后肿瘤细胞增殖率显著低于A-NC组,肿瘤细胞凋亡率显著高于A-NC组,差异具有统计学意义(P<0.05);B组细胞株在紫杉醇、顺铂进行培养48h后肿瘤细胞增殖率显著高于B-NC组,肿瘤细胞凋亡率显著低于B-NC组,差异具有统计学意义(P<0.05);但A组与A-NC组、B组与B-NC组细胞株在阿霉素进行培养48h后肿瘤细胞增殖率、肿瘤细胞凋亡率差异均无统计学意义(P>0.05);可见,紫杉醇、顺铂对三阴性乳腺癌细胞增殖率、凋亡率影响显著,阿霉素对三阴性乳腺癌细胞增殖率、凋亡率影响较小;见图2、3。

图2 不同化疗药物处理后各组肿瘤细胞的增殖率比较
3 讨论
三阴性乳腺癌由于缺乏相应受体不能进行内分泌治疗及靶向治疗,治疗以化疗为主但效果欠佳,临床表现出高侵袭性、高复发率和高病死率等特征[8]。因此如何提高化疗致敏性是提高三阴性乳腺癌疗效的关键,亦是研究热点。miRNA与癌症密切相关,通过细胞周期调控、基因组完整性、应激反应、凋亡和转移等关键环节发挥作用[9]。miR-10b参与了多种生命过程,负调控基因表达,调节多种生物学行为,与乳腺癌的关系密切,对于诊断三阴性乳腺癌、评估疗效及预后起到重要作用。国内外有研究表明,miR-10b表达水平较低与乳腺癌的治疗耐药性相关,通过上调miR-10b表达水平,可以使化疗药物作用于抵抗的肿瘤细胞,转变为对化疗药物敏感的细胞[10-11]。应用信号网络分析系统(8.5版本)研究指出,miR-10b促进细胞凋亡的作用非常显著,进一步研究证明,miR-10b促进细胞凋亡的生理过程与miR-10b可抑制有丝分裂、影响细胞周期相关蛋白翻译有关。miR-10b通过调控组蛋白的甲基化,达到影响乳腺癌细胞对化疗药物的敏感性[12]。通过本研究可知,miR-10b表达水平较高的三阴性乳腺癌患者对术前化疗方案的敏感度显著高于低表达miR-10b的三阴性乳腺癌,前者的临床疗效亦优于后者。在本研究后续的细胞学研究中,通过三阴性乳腺癌细胞株转染为miR-10b的模拟物和抑制物,分别显著提高和降低miR-10b表达水平。同时,分别加入紫杉醇、顺铂和阿霉素进行培养,在紫杉醇、顺铂进行培养48h后,miR-10b高表达水平组的细胞增殖率低于阴性对照组,肿瘤细胞凋亡率大于阴性对照组,miR-10b低表达水平组的细胞增殖率高于阴性对照组,肿瘤细胞凋亡率小于阴性对照组,而加入阿霉素的miR-10b高表达水平组的细胞增殖率、肿瘤细胞凋亡率与阴性对照组差异无统计学意义;说明提高miR-10b表达水平,有利于提高三阴性乳腺癌细胞株对紫杉醇和顺铂的敏感度,但对阿霉素的敏感度无显著影响,进一步说明miR-10b在调控三阴性乳腺癌化疗致敏性方面是有选择性的,可能与化疗药物的作用机制有关。
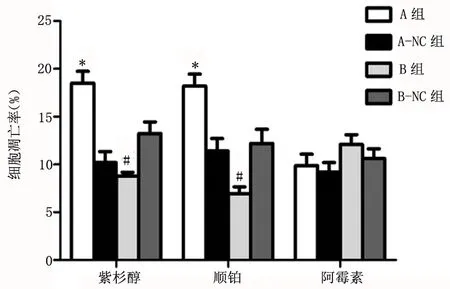
图3 不同化疗药物处理后各组肿瘤细胞的凋亡率比较
三阴性乳腺癌组织学分级较差多伴p53突变,EGFR等表达[8]。紫杉醇可使肿瘤细胞的有丝分裂期受阻,抑制细胞分裂,还可与微管蛋白结合,抑制致癌因素对微管系统的影响,具有良好的抗肿瘤活性[13]。在肿瘤细胞的有丝分裂过程中,Cyclin B1发挥着关键作用,Cyclin B1的含量和活性与细胞分裂期有关,而有研究显示随着紫杉醇化疗时间的延长,Cyclin B1表达水平随之提高,使肿瘤细胞被阻滞在分裂中期[14]。另外,紫杉醇作用后,Cyclin B1表达水平有所反跳,可能是肿瘤细胞的代偿性反应,而miR-10b却具有使肿瘤细胞Cyclin B1表达水平降低的调控作用,使更多的肿瘤细胞有丝分裂过程受阻,无法完成有丝分裂,促使细胞凋亡。众所周知,顺铂作为具有细胞毒性的烷化剂,通过抑制肿瘤细胞DNA复制,达到治疗恶性肿瘤的效果。针对顺铂治疗三阴性乳腺癌的研究发现,三阴性乳腺癌对顺铂的化疗致敏性与p53基因是否突变有关。p53基因突变作为三阴性乳腺癌病情恶化的重要指标,使三阴性乳腺癌对顺铂的化疗致敏性降低。Margaret SE等[15]研究指出,p53基因突变后肿瘤细胞凋亡受阻,作为化疗致敏性降低的重要表现,可能与DNA损伤修复增加有关。此外,三阴性乳腺癌组织的miR-10b表达水平与p53呈负相关,亦进一步提示miR-10b可能影响p53表达,达到影响三阴性乳腺癌对顺铂的化疗致敏性。此外,阿霉素作为一种糖甙抗生素,具有广泛的抗肿瘤活性,可同时抑制DNA、RNA合成,具有强烈的细胞毒性作用,对于细胞周期各阶段均具有抑制作用。药理研究表明,阿霉素还可促进自由基生成,且细胞学研究显示,阿霉素主要定位于细胞浆内,提示三阴性乳腺癌对阿霉素的化疗致敏性与药物进入细胞核的效率有关[16]。由于miR-10b主要调控肿瘤细胞的有丝分裂,影响细胞分裂关键阶段的检查点,促使肿瘤细胞凋亡,而阿霉素杀灭肿瘤细胞的过程与细胞毒性密切相关,杀灭肿瘤细胞的效果与进入细胞核的效率有关;这可能就是上调三阴性乳腺癌组织的miR-10b表达水平,并不能影响细胞株MDA-MB-231对阿霉素敏感性的原因。
众所周知,在不同分子亚型的乳腺癌中,三阴性乳腺癌的预后最差,治疗较为困难,但通过本研究可知,通过化疗治疗三阴性乳腺癌患者,在达到有效或控制病情的情况下,可进一步延长患者的寿命,改善预后。同时,高水平miR-10b的三阴性乳腺癌患者的化疗致敏性更好,可能与miR-10b能提高细胞株MDA-MB-231对紫杉醇、顺铂的敏感性,但不影响对阿霉素的敏感性。对此,miR-10b可能成为三阴性乳腺癌诊治的新靶点,为研究乳腺癌耐药性问题而提供新的方向。

