针状可视肾镜治疗肾盏憩室结石(附36例报告)
秦海生 张文涛
(武警河南省总队医院泌尿外科,郑州 450000)
肾盏憩室为上集合系统一种罕见的囊性病变,可能与先天性因素有关[1]。憩室结石多位于中上盏,肾盏憩室在人群中患病率为 0.2%~0.6%[2],9.5%~50% 的肾盏憩室合并结石[3]。大部分患者合并肾盏憩室结石没有症状,一旦发生腔内感染、憩室颈部梗阻便可出现相应的临床症状。在有症状的患者当中,憩室合并结石发生率高达96%[4]。无症状的肾盏憩室结石多数无需治疗,若出现反复肉眼血尿、感染或者腰部疼痛症状,需外科干预治疗。2018年1~12月我院采用超声引导下针状可视肾镜联合钬激光碎石技术治疗36例直径1.0~2.5 cm肾盏憩室结石,报道如下。
1 临床资料与方法
1.1 一般资料
本组36例,男32例,女4例。年龄18~52 岁,平均20岁。体重 46~103 kg,平均 65 kg。28例体检腹部彩超提示肾结石,8 例因腰背部酸胀或血尿就诊(腰背酸胀6例,血尿2例),无发热、脓尿、恶心、呕吐症状。经肾脏CT或静脉肾盂造影检查诊断为肾盏憩室结石,据结石位置分类,上盏26例,中盏7例,下盏3例;左侧15例,右侧19例,双侧2例;结石直径1.0~2.5 cm,平均1.68 cm。合并糖尿病2例,冠心病1例,原发性高血压3例,其中1例合并冠心病、原发性高血压。
病例选择标准:肾盏憩室结石直径1.0~2.5 cm;无结石远端梗阻;无严重心、脑、肺及出血性倾向疾病;非孤立肾或功能性孤立肾;术前无控制不良的泌尿系感染。
1.2 方法
1.2.1 术前检查 术前完成血常规及血型、尿常规、大便常规、乙肝术前、肝功生化、血凝分析等检验。行心电图、心脏彩超(50岁以上患者或者患有冠心病病史患者)、胸部X线片了解心肺功能情况。行肾脏CT、腹部平片(图1)和静脉肾盂造影(图2)了解结石大小、位置及憩室积水情况。
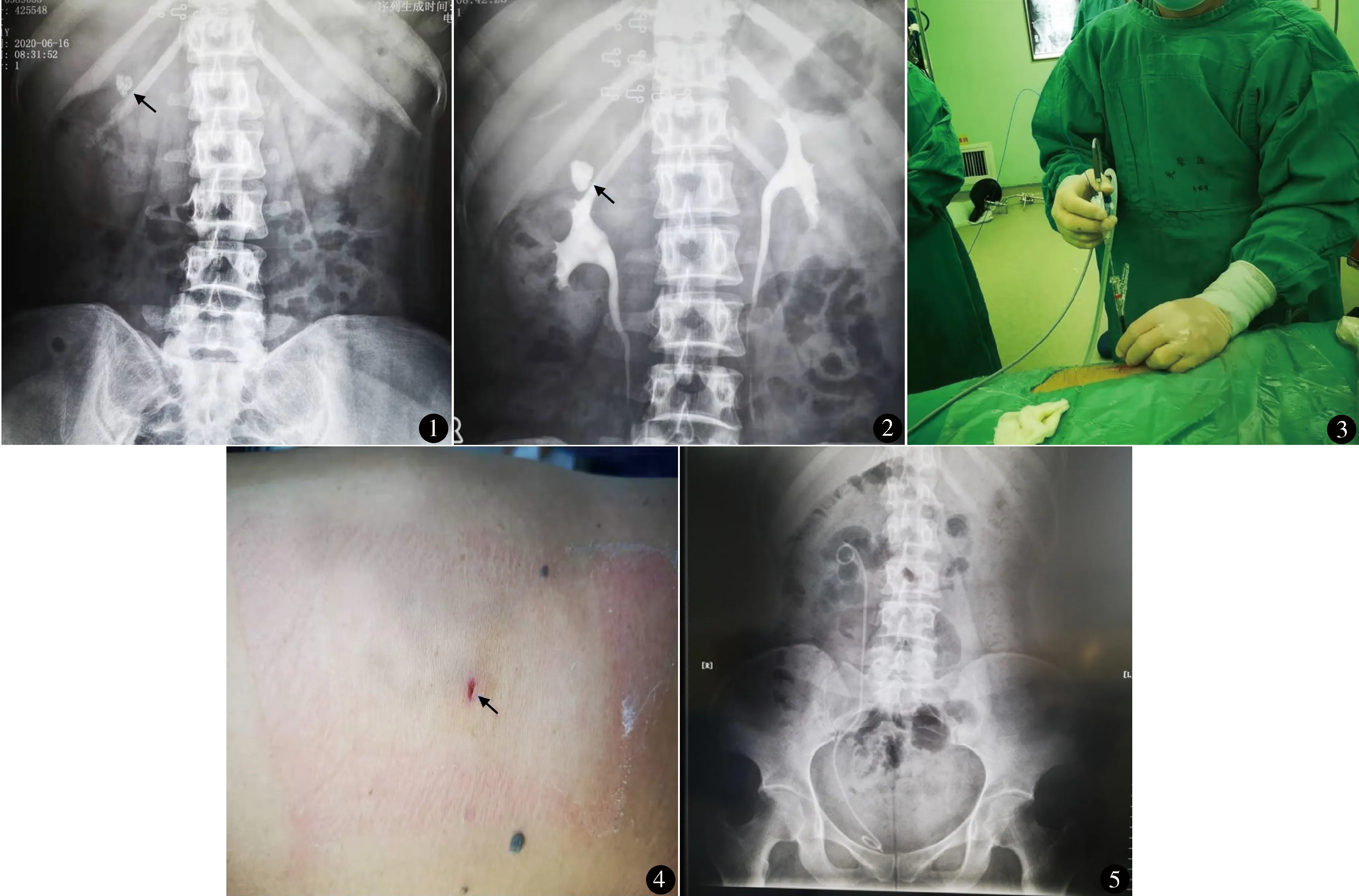
图1 腹部平片示右肾结石直径2.2 cm 图2 静脉肾盂造影示右肾上盏憩室结石 图3 术中针状可视肾镜配合负压装置碎石清石 图4 术后无管化图5 术后腹部平片显示右肾结石已清除
1.2.2 手术方法 全身麻醉。先截石位,F8~10Storz输尿管镜经尿道进入膀胱,于患侧放置 F5输尿管导管及 F18三腔尿管并胶布固定,输尿管导管连接生理盐水逆行灌注肾盂。改俯卧位,腹部垫高,超声定位下在第11肋间或12肋下、肩胛下线和腋后线之间区域选择穿刺点,F4.8针状可视肾镜在超声引导、显示器直视下进行穿刺,穿刺从穹隆处进针,穿刺过程中通过延长管加压注水,能清晰观察到穿刺层次直至进入肾盏憩室内观察到结石,退出穿刺针针芯连接 F8可视肾镜碎石清石系统,连接 550 μm钬激光光纤(美国Trimedyne双脉冲钬激光),功率设置为 3.0 J/10 Hz,应用“爆米花碎石法”将结石粉碎为 3.0~5.0 mm颗粒,利用负压装置,借助灌注泵循环产生的水流将碎石颗粒沿 F14剥皮鞘吸入负压吸引瓶中(图3)。若憩室颈口难以寻及,可经输尿管导管逆行加压推注10%亚甲蓝,仔细观察亚甲蓝喷出点,即为肾盏憩室开口。沿憩室开口顺行置入斑马导丝,钬激光功率设置为 0.8 J/10 Hz,沿斑马导丝长轴方向将憩室口盏颈切开至 6.0 mm以上,进入肾盂,直视下沿输尿管腔顺序置入斑马导丝,退出输尿管导管并沿斑马导丝顺行置入 F6输尿管支架管,支架管近端放置于憩室内,术后无需留置肾造瘘管(图4)。
1.2.3 术后处理 术前1 d预防性抗感染治疗1 次,术后常规使用抗生素 3~4 d,膀胱持续或间断冲洗,以防膀胱血块填塞。术后卧床 1~2 d。术后出现发热、疼痛、血尿情况给予对症处理。术后若无明显出血,术后第 2 天嘱咐患者下床适量活动、流质饮食。术后3~4 d拔除导尿管。术后第1天复查彩超及血常规,观察患者的生命体征、尿液颜色、尿量,评估残石、肾周积液情况,以及出血量。术后第4天复查腹部平片了解支架管位置及结石残留情况。术后 1个月复查腹部平片及彩超,了解支架管位置及结石残留情况,并拔出输尿管支架管。术后6、12个月再次复查CT了解憩室积水及结石复发情况。
2 结果
手术时间33~65 min,平均47.5 min。术后第1天复查血常规,血红蛋白下降 0.6~1.9 g/L,平均 1.35 g/L。1 例手术当天出现发热,考虑术中液体外渗到肾周,术后吸收热或感染所致,给予地塞米松5 mg后体温恢复正常。术后出现左侧腰大肌部位疼痛 2 例,右侧腰大肌部位疼痛 3 例,给予吲哚美辛片口服后均缓解。术后出现肉眼血尿 6 例(持续12~48 h),血尿呈暗红色,考虑穿刺扩张的皮肾通道静脉出血,给予注射用白眉蛇毒血凝酶1.0 kU静脉注射并持续膀胱冲洗、卧床休息后出血逐渐停止,均无输血。术后第1天复查肾脏彩超,肾结石均清除干净(图5),1例存在肾周少量积液。术后第4天复查腹部平片,36 例输尿管支架管均位置良好、无结石残留。术后住院4~6 d,平均5.2 d。术后1个月复查腹部平片和肾脏彩超,36例输尿管支架管位置良好且无结石残留,肾周均无积液,肾盏憩室大小较术前无明显变化。术后6、12个月复查肾脏CT,36例肾脏结石无复发,清石率 100.0%(36/36)。
3 讨论
肾盏憩室发生在上、中、下盏的比例为 12∶3∶2[5]。肾盏憩室的形成分为先天因素和非先天因素。先天因素源于胚胎时期输尿管芽分支为后肾胚基的过程,其中任何一个分支不能刺激产生合适的后肾切面时就会产生憩室。非先天因素可大致分类为:梗阻源性、神经肌肉源性、 创伤性以及纤维化[6]。由于憩室口狭窄梗阻,憩室近端逐渐拉长成为憩室颈部,远端逐渐扩大成为憩室囊腔。肾盏憩室不具备收缩和分泌功能,一旦尿液引流不畅,憩室内发生梗阻、感染,便容易导致憩室结石的形成。部分患者无症状,给予观察及溶石治疗;部分患者因泌尿系感染、血尿,或者腰部不适而需手术干预[7]。随着人们健康要求的提高,以及特殊职业体检的要求(体检要求肾脏结石<3 mm且无肾积水),肾盏憩室结石的治疗有特殊的意义。
肾盏憩室结石的治疗方法有开放手术、腹腔镜手术、体外震波碎石术(extracorporeal shock-wave lithotripsy,ESWL)、经皮肾镜碎石取石术、输尿管软镜碎石术以及微通道经皮肾镜碎石取石术。开放手术包括单纯处理憩室、肾部分切除等, 因创伤大目前仅在微创手术无法处理时方才使用[8]。腹腔镜主要适用于位于腹侧、肾实质表面、囊壁较薄的肾盏憩室, 且对残存憩室颈部缝合要求高, 有漏尿等并发症。Turna等[9]选择 38例肾盏憩室合并结石行ESWL治疗,随访3个月仅8例结石完全排出。Oh等[10]认为ESWL术后出现感染性休克可能与内壁炎症、 憩室颈部出口梗阻致细菌逆行性感染有关。ESWL排石率低,可能于憩室盏颈口狭窄有关,若憩室内合并感染有可能出现相关并发症。由此可见,ESWL对于肾盏憩室结石治疗效果差。
随着腔镜设备和激光设备的不断改进,软镜和经皮肾镜碎石术逐渐成为肾盏憩室合并结石的主要治疗方法。输尿管软镜利用其可弯曲性,能逆行进入肾盂及各肾盏,寻找憩室肾盏并用钬激光将盏颈口切开并碎石。输尿管软镜经自然通道进入,避免经皮肾镜建立皮肾通道产生的肾损伤出血风险,具有创伤小、出血少、恢复快等优点。但是输尿管软镜处理肾盏憩室结石存在一定的局限性[11],原因如下:①若结石位于肾盏下盏可能因为肾盂肾盏夹角较小,导致碎石失败[12]。②软镜对于肾盏憩室结石只能进行粉末化,若结石体积较大,可能需二次甚至多次手术,且排石时间长,增加患者医疗费用;若碎石颗粒位于肾下盏,需倒立体位排石,高龄或者体弱患者难以配合体位排石,术后结石清除率降低。③若输尿管狭窄,手术需分期治疗,增加患者麻醉次数及医疗费用[13]。④若肾盏憩室内合并感染,术中肾内压高,术中、术后可能出血败血症,甚至感染性休克[14]。⑤术中输尿管扩张鞘对输尿管壁的长时间压迫,输尿管血运受影响,术后有可能出现输尿管狭窄。⑥术后斑马导丝放入肾盏憩室内,F7输尿管支架管放置过程为盲置,可能支架管近端脱出肾盏憩室,导致术后肾盏憩室盏颈口再次狭窄。⑦结石所在憩室颈口闭锁,导致软镜无法进入憩室内。另外,输尿管软镜在使用过程中反复弯曲末端,缩短镜子使用寿命。软镜价格昂贵,维修成本高,术中应用高值耗材(输尿管扩张鞘和网石篮中),无形中增加了医院的医疗成本和患者的医疗费用,不利于在基层医院的推广。
Parkhomenko等[15]研究显示经皮肾镜临床治疗肾盏憩室结石是足够安全和有效的, 且不受憩室位置、大小、结石负荷的影响。标准通道或微通道经皮肾镜治疗肾盏憩室结石,手术清石率高,且术中肾内压低,对憩室内合并感染的患者能大大降低术中术后感染性休克的发生率[16]。但是肾盏憩室结石多数无肾积水,憩室口盏颈狭窄导致人工肾积水效果差,肾镜穿刺难度大,且在扩张过程中硬导丝容易滑脱,导致经皮通道建立失败及肾脏大出血风险[17]。肾镜穿刺和扩张对术者要求较高,学习曲线较长,对于无积水的肾盏更是难上加难。
针状可视肾镜具有纤细、轻便、操作简单、双重定位引导、全程可视等优点。可视肾镜在穿刺过程中应用超声和可视摄像系统双重定位,穿刺过程可观察到各解剖层次[18],避免血管及周围脏器损伤,避免穿刺过深导致的损伤。穿刺观察到结石后即停止,直视下调整穿刺针方向,将硬导丝充分放入肾盏憩室,避免扩张过程中硬导丝滑脱的风险,增加扩张成功率,减少肾脏出血风险。F8可视肾镜碎石清石系统镜体轻便、短小,镜鞘比值低,术中肾内压低,减少肾盏出血的同时能更好的降低感染几率。F8可视肾镜碎石清石系统结合550 μm钬激光光纤和负压系统,碎石、清石效率明显增高。可视肾镜碎石系统穿刺精准、全程可视,且碎石效率高,结合本组研究结果,平均手术时间47.5 min,术后血红蛋白下降平均 1.35 g/L,平均住院时间 5.2 d,术后结石清除率100.0%(36/36),术后1、6、12个月随访均无结石复发,切开的肾盏盏颈引流通畅,憩室内积水无增加。本组6 例术后出现肾脏出血,分析原因与盏颈切开、皮肾通道静脉出血有关,由于皮肾通道细,损伤的血管较细、较少,经卧床及对症止血、冲洗治疗后均停止出血,且无继发性出血,也无需输血治疗[19]。
可视肾镜碎石术后不留置肾造瘘管,实现无管化,减少外源性感染几率,术后2~3 d若无明显肾脏出血,可尽早下床活动,大大减轻患者术后的痛苦,大大降低术后长期卧床出现下肢静脉血栓的风险,大大缩短住院时间及医疗费用。可视肾镜套装简单、耐用,有效降低医疗成本,我们有以下几点体会:①穿刺点选择在肾盏穹隆部,此处皮肾距离最短且血管相对较少。②穿刺到肾盏后若发现盏内无空间放置硬导丝,可连接200 μm钬激光光纤粉碎结石创造空间,避免扩张时导丝移位导致扩张失败。③若发现肾盏憩室狭窄,用激光切开时应选择肾盏较薄处,避免术中出血或术后瘢痕狭窄。④碎石过程要颗粒化,边碎石边冲出结石,减少手术时间。⑤术后可以直视下将支架管近端放至憩室内,充分扩张憩室盏颈。⑥术后观察皮肾通道,若有小动脉出血可应用激光止血。⑦肾盏憩室结石多为无积水肾盏,穿刺难度高,对于经皮肾镜初学者有一定难度,术后出血并发症会进一步升高。
本研究表明,针状可视肾镜对于1.0~2.5 cm 肾盏憩室结石安全、有效,结石清除率高。随着激光功能的不断改进,碎石能力及止血功能进一步提高,可大大缩短手术时间,术中彻底止血,进一步降低手术并发症,可视肾镜碎石手术可能发展为日间门诊手术,在确保安全、有效、并发症少的前提下,进一步减轻患者术后疼痛,降低患者的医疗费用。
——可重复性或一次性输尿管软镜孰优孰劣?
——导丝概述及导丝通过病变技巧

