AMS对消化内镜围操作期预防性使用抗菌药物的干预效果
李 卉,张宏亮,王希斌,黄振宁,黄振光,刘滔滔
(广西医科大学第一附属医院 1.药学部; 2.消化内科,广西 南宁 530021)
近年来,随着抗菌药物在全球的广泛使用,不合理用药的现象时有发生,致使各种耐药菌株不断出现[1-2],已经成为各国关注的突出问题[2]。我国也出现了抗菌药物不合理使用的情况,其中,围手术期抗菌药物的使用情况更是不容乐观[3-4]。为此,我国卫生行政部门相继颁发了《抗菌药物临床应用管理办法》《关于进一步加强抗菌药物临床应用管理遏制细菌耐药的通知》,并持续开展了抗菌药物临床使用专项整治活动,将围手术期抗菌药物的合理使用作为重点监测、关注对象,对其用药作了更加严格的规定。2018年5月我国卫健委医政医管局下发《关于持续做好抗菌药物临床应用管理有关工作的通知》,要求进一步对抗菌药物的管理方法与思路进行转变,积极探索抗菌药物科学化管理(antimicrobial stewardship, AMS)策略。针对广西医科大学第一附属医院消化内镜诊疗技术围操作期预防使用抗菌药物存在的不合理现象,医院采用AMS策略,通过一系列干预措施和手段,探索出了一套独具特色的消化内镜AMS模式,对加强医院消化内镜围操作期抗菌药物监管和规范抗菌药物合理应用取得了较好的效果,现报告如下。
1 对象与方法
1.1 研究对象 选取某院2019年1—6月消化内科行消化内镜操作患者作为研究对象,以2017年1—6月的同期患者为对照组。消化内镜操作包括超声内镜引导下细针穿刺术及腹腔器官治疗术、经内镜贲门失驰缓症球囊扩张术、经内镜逆行胰胆管造影术(ERCP)、经内镜胃底/食管静脉曲张组织胶注射/硬化剂/套扎注射治疗术、经内镜消化道黏膜剥离术(ESD)、经内镜消化道黏膜切除术(EMR)、内镜下食管贲门括约肌切开术(POEM))等。内镜操作前7 d 内应用过抗菌药物或内镜操作前已有感染的患者不纳入研究。
1.2 研究方法 收集干预前后患者的一般病历资料,包括年龄、性别、操作类别、抗菌药物用药适应证、抗菌药物种类、联合用药、用药时机、用药时长等;同时对比干预前后围操作期预防性抗菌药物使用率、抗菌药物使用强度(AUD,采用限定日剂量法[5],以平均每日每百张床位所消耗抗菌药物的DDD值表示)、不合理用药情况以及术后感染发生情况。
1.3 评价标准 参照《抗菌药物临床应用指导原则(2015年版)》(以下简称《指导原则》)、《关于抗菌药物临床应用管理有关问题的通知》以及《抗菌药物临床应用管理办法》等制定,部分消化内镜操作(如超声内镜引导下细针穿刺术及腹腔器官治疗术、经内镜贲门失驰缓症球囊扩张术、EMR、POEM等)围操作期抗菌药物的预防性使用尚无统一标准,AMS团队通过查阅指南、循证医学药学证据[6-13]完善并制定医院《消化内镜诊疗技术围操作期抗菌药物使用规范》,对不同消化内镜操作预防使用抗菌药物进行细化,以此为标准对医院消化内镜围操作期抗菌药物的预防性使用进行干预和合理性评价。操作后感染诊断依据国家卫生部2001年颁布的《医院感染诊断标准(试行)》执行[14]。
1.4 干预措施
1.4.1 组织管理 成立AMS核心工作组,即多学科团队(multi-disciplinary team,MDT),分管院领导任组长统筹全局,成员主要包括医务部专员、质量管理办公室专员、院感科及感染科专家、微生物专家、临床药师,对消化内镜围操作期抗菌药物合理应用情况进行定期督导检查和抽查。
1.4.2 完善相关制度 制定《关于印发2017年抗菌药物临床应用管理方案的通知》《关于印发合理降低抗菌药物使用强度方案专项管理的通知》,方案确定了科室AUD目标值,加强了抗菌药物医嘱点评制度,加大了奖惩力度,并把点评结果作为科室评先争优的核心指标进行管控。另外,医院微生物室定期公布微生物培养信息,为临床用药提供参考。
1.4.3 优化信息系统 AMS团队成员积极与医院HIS系统开发公司合作,开发符合医院现状的抗菌药物管理系统软件。该系统可以自动设置医生使用抗菌药物的等级权限,对于围操作期的用药选择和用药时长亦进行相应的限定,用药时长超过48 h时系统将自动报警提示。此外,该系统还可实时查看本病区AUD的动态变化情况,自动提取每个住院患者的病历信息并自动生成标准的消化内镜围操作期抗菌药物点评表,从而提升点评效率。
1.4.4 宣教与培训 宣教和培训采取由易到难、由面到点、由全科到个人的方式。通过邀请国内知名专家、院内相关感染专家和AMS团队成员对抗菌药物相关知识及合理使用等内容进行培训,并对参加培训人员进行考核。
1.4.5 持续干预和监督 病区成立自己的抗菌药物管理小组,成员包括病区医生、护士和临床药师,对该病区抗菌药物相关指标(使用量、平均使用时长、使用率、联合使用率、使用强度等)进行监控。临床药师参与临床药物治疗,为医生提供用药指导,实时监护内镜操作手术患者,将围操作期不规范使用抗菌药物的情况及时与医生沟通;另外,AMS团队成员每月对消化内镜手术患者的出院病历进行抗菌药物专项点评,并将专项点评结果和抗菌药物的使用率、使用强度在院周会、总住院医生会上予以通报,分管领导在会上进行点评,干预结果与医生绩效工资、晋升晋级、医德医风等考核相结合。
1.5 统计方法 应用SPSS 24.0软件进行统计分析,计量资料组间均数比较采用t检验,计数资料比较采用χ2检验,P≤0.05为差异具有统计学意义。
2 结果
2.1 两组患者基本资料 干预前组共收集患者资料822份,干预后组收集患者资料1 006份,两组患者在性别、年龄、手术类别方面比较,差异均无统计学意义(均P>0.05)。见表1。

表1 干预前后两组患者基本情况比较
2.2 预防性抗菌药物使用率和使用强度 干预后组预防性抗菌药物使用率较干预前组有所下降(17.10% VS 24.82%),其中,以ESD、EMR两种手术操作下降较为明显,差异具有统计学意义(P<0.01);干预后组AUD较干预前组显著下降。见表2、3。
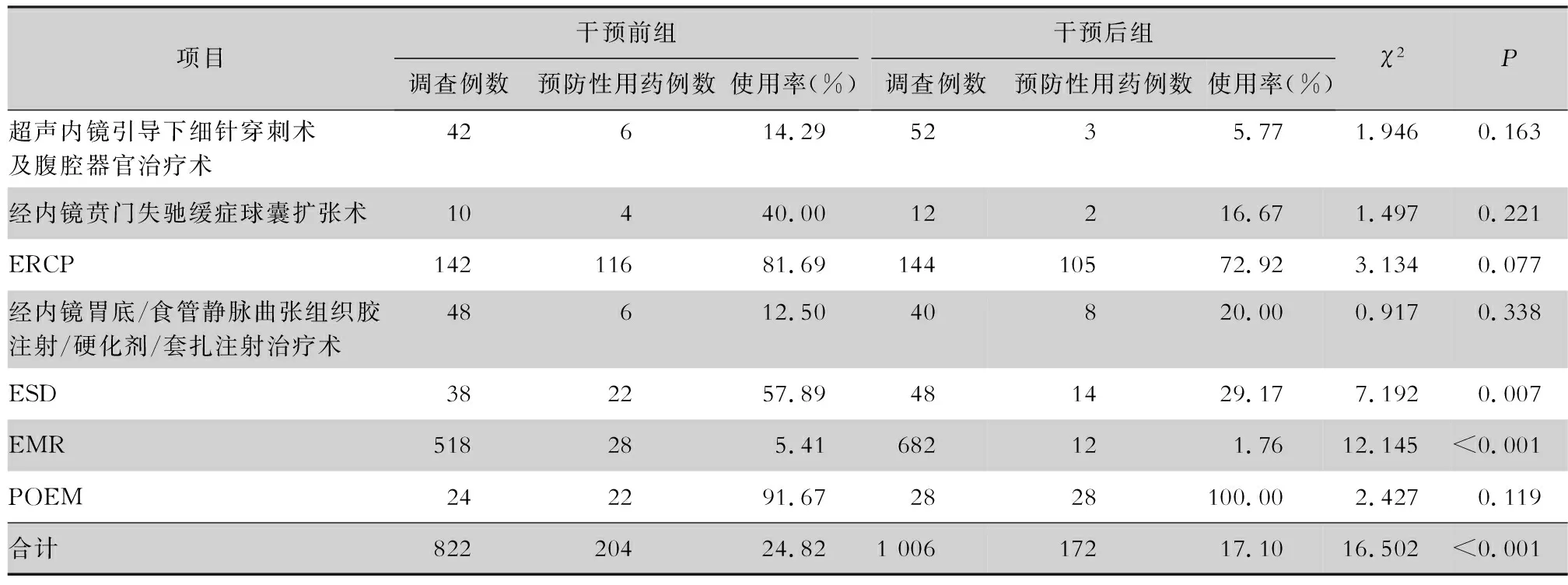
表2 干预前后两组患者预防性抗菌药物使用率比较

表3 干预前后两组患者AUD比较
2.3 预防性抗菌药物品种选择和联合用药情况 干预前,围操作期预防性抗菌药物涉及青霉素类、头孢菌素类、头霉素类、喹诺酮类和硝基咪唑类多个品种,联合用药方面以两联、三联方案为主。干预后,预防用药以头孢呋辛或头孢曲松单药方案为主,哌拉西林钠/舒巴坦钠、头孢地嗪、头孢西丁预防用药例次均降为0;联合用药方面,干预后组联合用药比率低于干预前组,差异有统计学意义(P<0.001)。见表4、5。

表4 干预前后两组患者预防性应用抗菌药物品种比较
2.4 患者预防性应用抗菌药物用药时长 干预后组术前单剂量预防性应用抗菌药物的患者高于干预前组,给药时长48~72 h、>72 h的患者比率均低于干预前组,差异均具有统计学意义(均P<0.001)。见表6。

表5 干预前后两组患者预防性应用抗菌药物联用比较

表6 干预前后两组患者预防性应用抗菌药物用药时长比较
2.5 患者预防性抗菌药物应用不合理情况 干预后组消化内镜围操作期预防性应用抗菌药物在适应证、药物选择、联合用药、用药时机、用药时长方面不合理率均低于干预前组,差异均具有统计学意义(均P<0.001)。见表7。

表7 干预前后两组患者围操作期预防性抗菌药物应用不合理情况
2.6 操作后感染情况比较 干预前组和干预后组患者操作后感染发生率分别为3.16%和3.18%,操作后感染发生均主要涉及呼吸系统感染、腹部和消化系统感染、血液系统感染等,其中以腹部和消化系统感染发生率较高,比较干预前后操作后感染发生情况,差异均无统计学意义(P>0.05)。见表8。

表8 干预前后两组患者操作后感染发生情况
3 讨论
近几年,消化内镜诊疗技术发展突飞猛进,已经由原来单纯的诊断工具发展成为微创治疗的重要手段之一,被广泛应用于临床诊断与治疗。若围操作期抗菌药物预防性应用不恰当,可能会加大操作后感染的风险,导致耐药菌的产生,同时还会增加患者的经济负担和医疗成本[15]。目前我国尚未发布该类诊疗技术围操作期抗菌药物使用规范,医院借助AMS策略,通过多学科团队模式,分工明确,密切配合,结合消化内镜的专科特点,建立科学化管理机制,采取一系列连续的干预措施,实现消化内镜围操作期抗菌药物科学化、标准化、常态化及精细化管理[16],既发挥了管理职能的优势,也发挥技术支撑的作用。
干预前,医院消化内镜围操作期抗菌药物预防性使用率高达24.82%,究其原因,一方面,由于各类消化内镜诊疗技术围操作期是否需要预防性使用抗菌药物尚无规范,临床医生用药无据可依;另一方面,临床医生对围操作期抗菌药物预防性使用的用药指征认识不足,仍存在抗菌药物预防使用的误区。因此,AMS小组首先通过循证医学的方法制定了我院《消化内镜诊疗技术围操作期抗菌药物使用规范》,做到预防用药有据可依,然后通过加强对临床医生围操作期合理用药的培训和宣教,在HIS系统中设置抗菌药物使用权限,临床药师入科对医嘱实施监督,加强不合理医嘱点评和落实奖惩制度等一系列干预措施,干预后消化内镜围操作期预防性抗菌药物使用率较干预前下降明显,其中以ESD和EMR预防性抗菌药物使用率下降较为明显。
AUD是反映抗菌药物使用量的关键性指标,也是用来监测和管控医疗机构抗菌药物使用的最重要指标之一。干预前,医院消化内镜围操作期存在无适应证用药,预防用药品种选择不适宜,联合用药过多,预防用药时长过长等现象,导致AUD较高。针对上述问题,AMS小组逐项突破,利用HIS系统对预防用药品种、用药时长和临床医生抗菌药物处方权限进行限定;通过制定操作前预防用药和操作中追加用药的路径和流程,规范给药时机。干预后,围操作期无指征用药现象较前减少,预防用药以头孢呋辛、头孢曲松单药预防为主,预防用药时长均较前缩短,尤其是预防用药时长在48~72 h和超过72 h的患者比例下降较为明显,抗菌药物不合理预防性使用情况较前改善,AUD由干预前的14.95降至干预后的2.18,成效显著。可见,AMS对于提高抗菌药物合理应用水平起到了积极的作用,与国内外相关报道[17-18]一致。
操作相关感染是内镜操作后最常见的医院感染类型,增加患者经济负担,延长住院日数,甚至危及患者生命[19]。通过对操作后感染发生率进行监控和统计,干预前后两组患者操作后感染发生率分别为3.16%和3.18%,差异无统计学意义(P>0.05),与其他研究[20-21]结果一致,说明围操作期减少抗菌药物的预防性使用并不是导致操作后感染发生的危险因素[15,22]。从操作后感染类别来看,主要涉及呼吸系统感染、腹部和消化系统感染、血液系统感染等,以腹部和消化系统感染发生率较高,考虑主要为内镜操作后出现相关并发症(如穿孔、出血、术后胰腺炎、胆道感染、肺部感染等)所致可能性大。
综上所述,消化内镜围操作期预防性使用抗菌药物存在不合理现象,且围操作期过度的预防性应用抗菌药物并未在降低消化内镜操作术后感染方面起到实际作用。通过AMS策略,多学科、多部门合作,从行政管理到技术支撑,从宣讲教育到驻科监管,对消化内镜围操作期预防用药展开科学有效的干预措施,严格把控围操作期用药指征和用药时机,规范抗菌药物的选择和用药时长等,在改善消化内镜围操作期预防性使用抗菌药物合理性方面取得了较好的成效,既未增加围操作期感染的发生率,又能够降低患者经济负担,防止药物不良反应和细菌耐药的发生。

