逐渐降温对雄性三线仓鼠免疫功能的影响*
沈 今, 徐德立, 王 硕, 王玉雪, 栗智敏, 程秋霞, 朱 梅
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
0 引 言
免疫系统在防御病原体如细菌、病毒和真菌等攻击和感染中起着至关重要的作用,决定着动物的生存.动物的免疫功能受多种因素的影响,例如季节、光周期、食物和温度等[1,2].生活于温带地区的动物,其免疫功能常表现出季节变化,在冬季,一些物种的免疫功能会降低[3-5];而另外一些物种则升高[6-9].季节变化引起的免疫能力的变化是温度和其他因素如食物、光周期等共同影响的结果,温度是影响动物免疫能力的重要生态因子之一[10].
大多数研究发现低温会抑制动物的免疫功能,例如低温会抑制小鼠[11]、拉布拉多白足鼠(Peromyscusmaniculatus)[12]和棕背鼠平 (Clethrionomysrufocanus)[13]的体液免疫,低温同样降低布氏田鼠(Lasiopodomysbrandtii)的天然免疫能力[14];也有些研究发现不同的结果,例如低温增加大鼠和小鼠的细胞免疫能力[14,15],但不影响拉布拉多白足鼠的细胞免疫能力[15].可见,低温对动物免疫能力的影响与所用动物、所检测的免疫学指标等因素有关.
免疫器官如胸腺和脾可反映动物的免疫能力,胸腺是T淋巴细胞成熟的场所;通常情况下脾脏越大免疫能力越强[16-18].植物血球凝集素(Phytohaemagglutinin,PHA)反应是将PHA注射至啮齿动物的足垫处,以诱导T细胞的增殖,根据足垫的肿胀程度反映细胞免疫功能[19,20].本文以三线仓鼠(Phodopussungoris)为研究对象,探讨逐渐降低温度对其免疫能力有何影响,我们预测低温会抑制该物种的免疫能力.
1 材料和方法
1.1 实验设计
本实验中所使用的成年三线仓鼠购自于宠物店.室内光周期为12L∶12D,单笼(30 cm×15 cm×20 cm)饲养,使用锯末为垫料,食物为标准饲料块(济宁医学院动物饲养中心),自由取食和饮水,饲养大约2周,体重稳定后,将18只成年雄性三线仓鼠随机分为常温组 (Warm,n=10)和低温组(Cold,n=8).低温组采用逐渐降温的方式,每6天降低4度,降温至4 ℃后,在4 ℃低温下维持1周,每天上午9点左右称量动物的体重.
1.2 细胞免疫的测定
PHA反应的测定方法参考Xu 和Wang (2010)[20].具体来说,在处死动物前5天,用数显电子测微尺(Mitutoyo Absolute cod.547-301,日本)测定每只动物左后足足垫的厚度(精确至±0.01 mm),用75%酒精对足垫消毒,然后在足垫中心处注射0.03 mL含0.1 mg PHA (PHA-P,Sigma L-8754)的无菌PBS缓冲液(pH 值7.4),6 h、12 h、24 h、48 h、72 h后分别测量左后足足垫的厚度,PHA反应的计算公式为:(注射后足垫厚度-注射前足垫厚度)/注射前足垫厚度,每只动物每次测定6次,最后取6次测定的平均值[20].
1.3 身体成分和器官
器官的解剖参考Xu和Wang的方法[20].动物处死后快速分离肩胛间的褐色脂肪组织(IBAT)称重,随后分别取出动物的心脏、肺脏、胸腺、肝脏、肾脏、肾上腺、脾脏、睾丸、附睾、贮精囊,剔除器官表面附着的结缔组织和脂肪,在滤纸上吸干器官表面的液体后称重(精确到0.001 g),为器官鲜重.取出动物的消化道,分别分离出胃、小肠、盲肠、结肠,小心剔除器官肠系膜及结缔组织和脂肪.分别称量胃及其内容物、小肠及其内容物、盲肠及其内容物、结肠及其内容物重.之后,将其纵向剖开,用生理盐水洗去内容物,置滤纸上吸干表面水分后,称重,作为器官鲜重.去除所有内脏器官后剩余的重量为胴体鲜重.此外,小心地分离皮下脂肪、性周脂肪、肠系膜脂肪和腹膜后脂肪,这4部分脂肪的总重被认为是总体脂重,皮下脂肪含量、性周脂肪含量、肠系膜脂肪含量、腹膜后脂肪含量以及总脂肪含量的计算方法是分别用以上各部分脂肪重量除以终体重[21].
1.4 白细胞数的测定
用剪刀将动物颈部动脉剪开,取血,迅速将20 μL血液,溶于0.38 mL白细胞稀释液[含1.5%的冰醋酸,1%龙胆紫(Sigma)]中,用手指轻弹混匀,放于冰中,大约2 h后,取20 μL上述溶液小心地滴在已放有盖玻片的血球计数板上,在低倍显微镜下(10×)观察,并用血球计数器计算4个角4个大格中所有的白细胞总数,然后乘以5×107,即为血液中所含白细胞总数(109cells/L)[20].
1.5 统计方法
数据统计采用SPSS 18软件进行分析.统计分析之前,用One-sample Kolmogorove-Simirnov test检验数据是否呈正态分布.比值包括PHA反应和脂含量用反正弦转换后进行分析.采用多因变量线性模型(General Linear Model multivariate analysis,GLM)中重复测量(Repeated Measures)的方差分析方法分析体重以及PHA反应随时间的变化情况,每个时间点上低温组和常温组间的差异采用独立样本t-检验(Independent Samples T-test) 进行分析.常温组和低温组身体成分、白细胞总数用独立样本t-检验进行分析.以体重为协变量采用GLM方法分析器官鲜重的组间差异.结果数据均以平均值±标准误(Mean ± SE)表示,P<0.05为统计学上差异显著.
2 结 果
2.1 体重
重复测量的方差分析显示,三线仓鼠体重随时间而发生变化(F30,480=75.172,P<0.001),同时受时间与分组之间交互作用的影响(F30,480=12.660,P=0.015).具体来说,常温组体重随处理时间而逐渐增加(F30,270=90.286,P<0.001) ,而低温组体重随时间同样逐渐增加(F30,210=11.882,P<0.001).独立样本t-检验分析显示,常温组和低温组的体重从实验处理第1天(t=-0.733,df=16,P=0.474) 至第29天(t=1.928,df=16,P=0.072) 均无显著差异,第30天(t=2.758,df=16,P=0.043)和第31天(t=2.198,df=16,P=0.014)低温组体重显著低于常温组(图1).
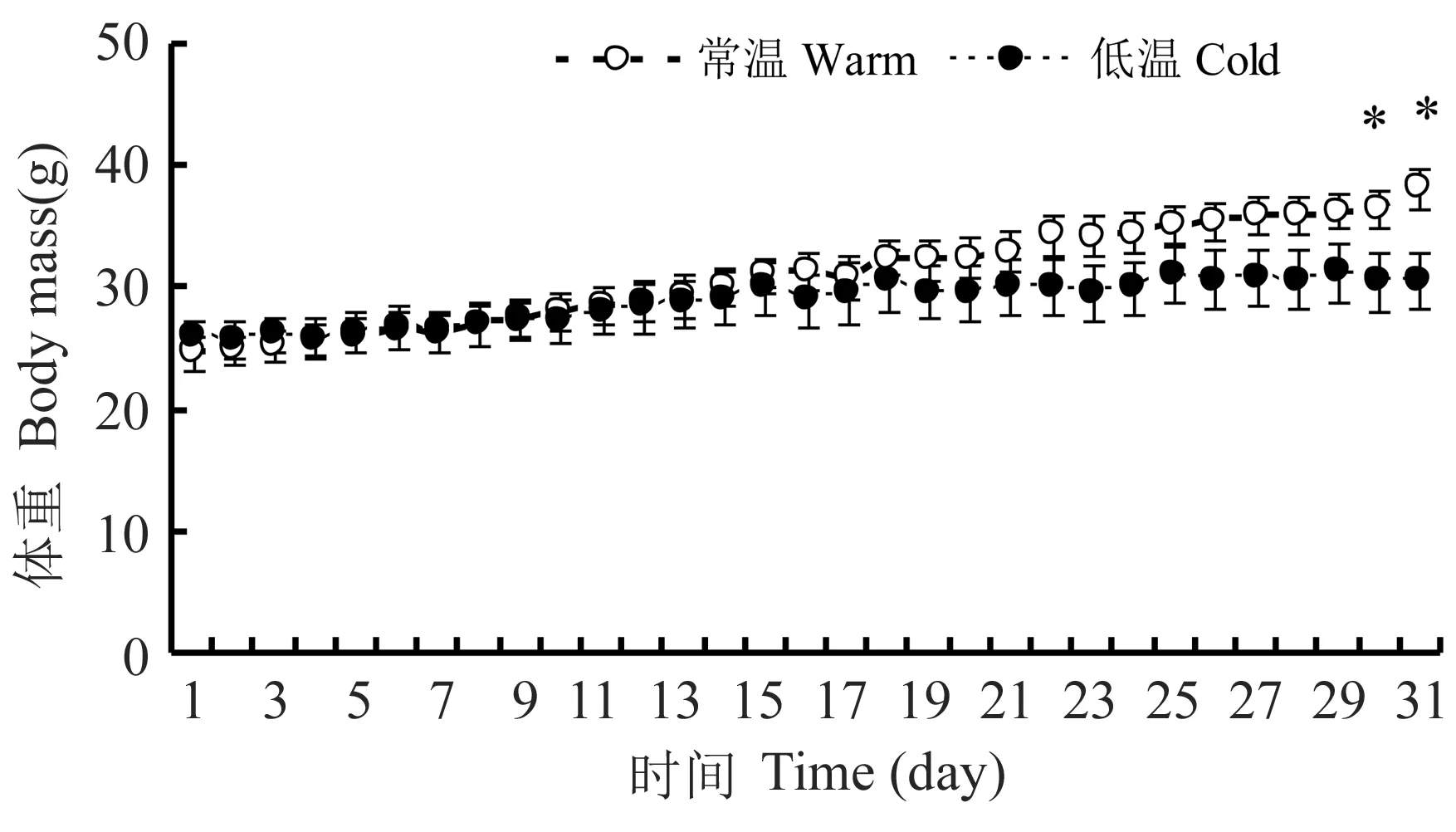
图1 低温对雄性三线仓鼠体重的影响.星号(*) 表示低温和常温组之间差异显著(P<0.05)
2.2 身体成分
常温组动物的胴体鲜重、性周脂肪含量、腹膜后脂肪含量、总体脂重及其含量均显著高于低温对照组,而皮下脂肪及其含量、性周脂肪、肠系膜脂肪及其含量、腹膜后脂肪在两组间则没有显著差异(表1).
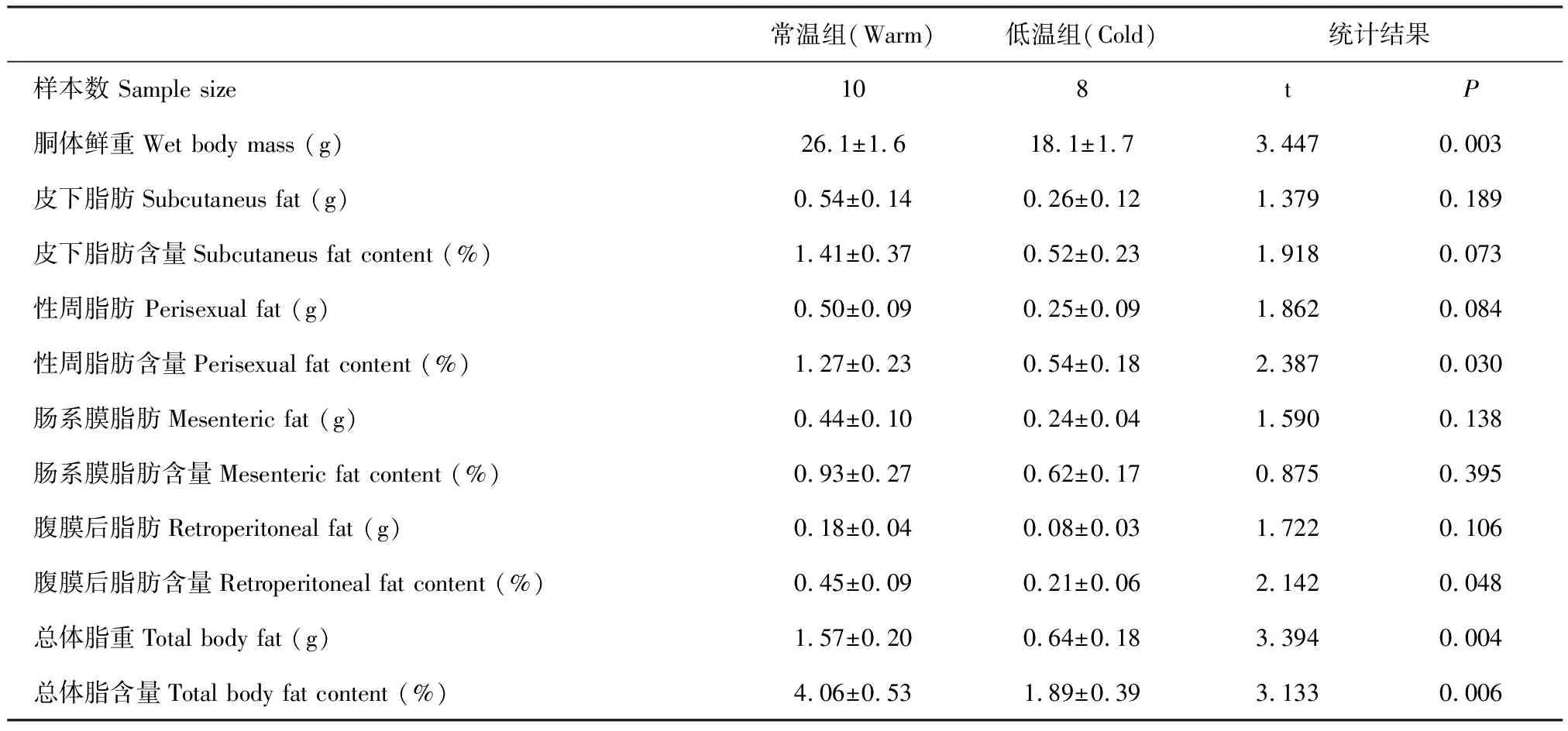
表1 低温对三线仓鼠身体成分的影响
2.3 器官鲜重
低温组肾脏鲜重、盲肠及其内容物、结肠及其内容物重量均显著高于常温组,免疫器官胸腺和脾脏鲜重以及其他器官鲜重在低温和常温组之间没有显著差异(表2).
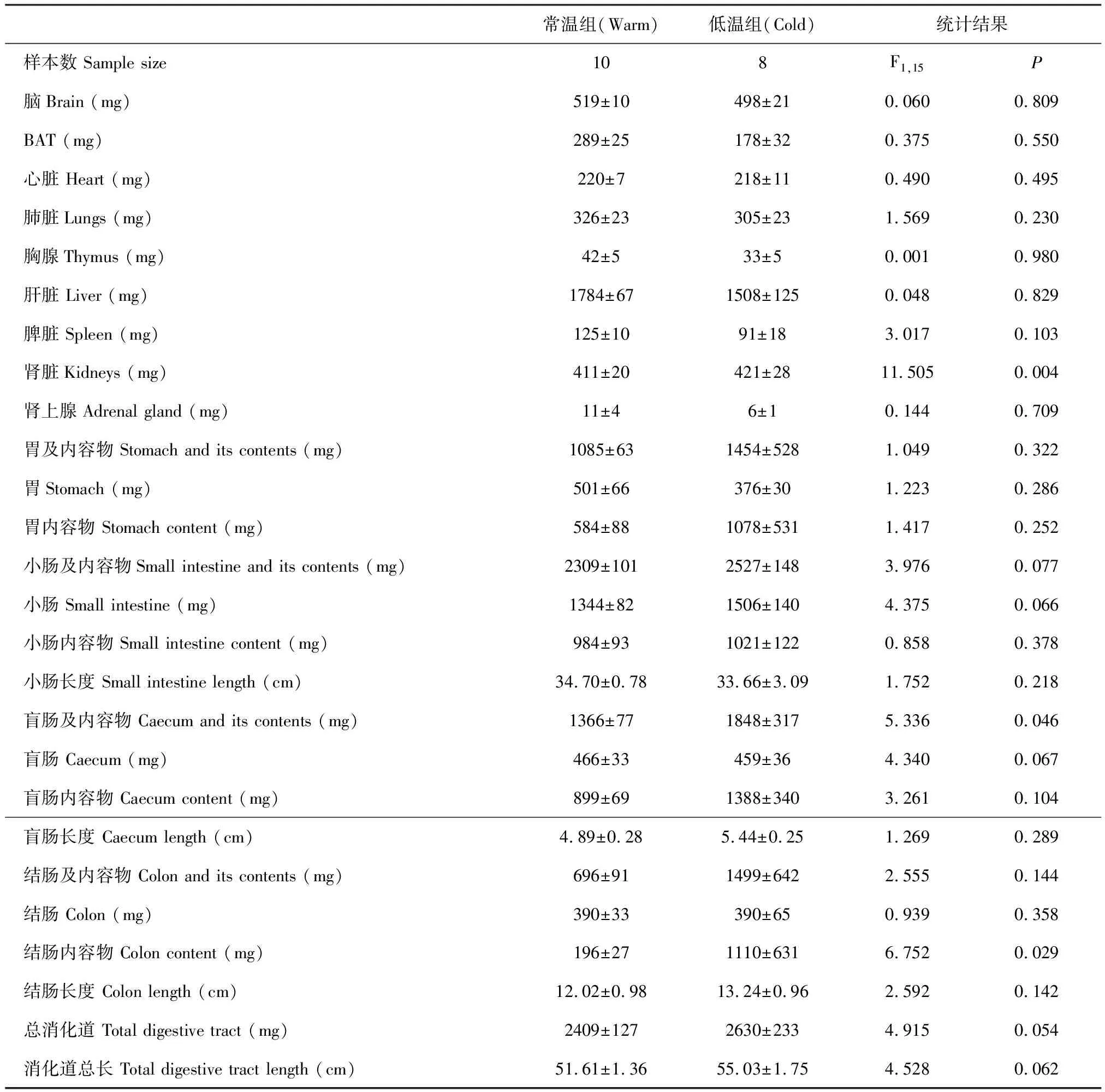
表2 低温对三线仓鼠器官鲜重的影响
2.4 白细胞数
白细胞总数在低温与常温组之间没有显著差异(t=-1.718,df=16,P=0.105) (图2).
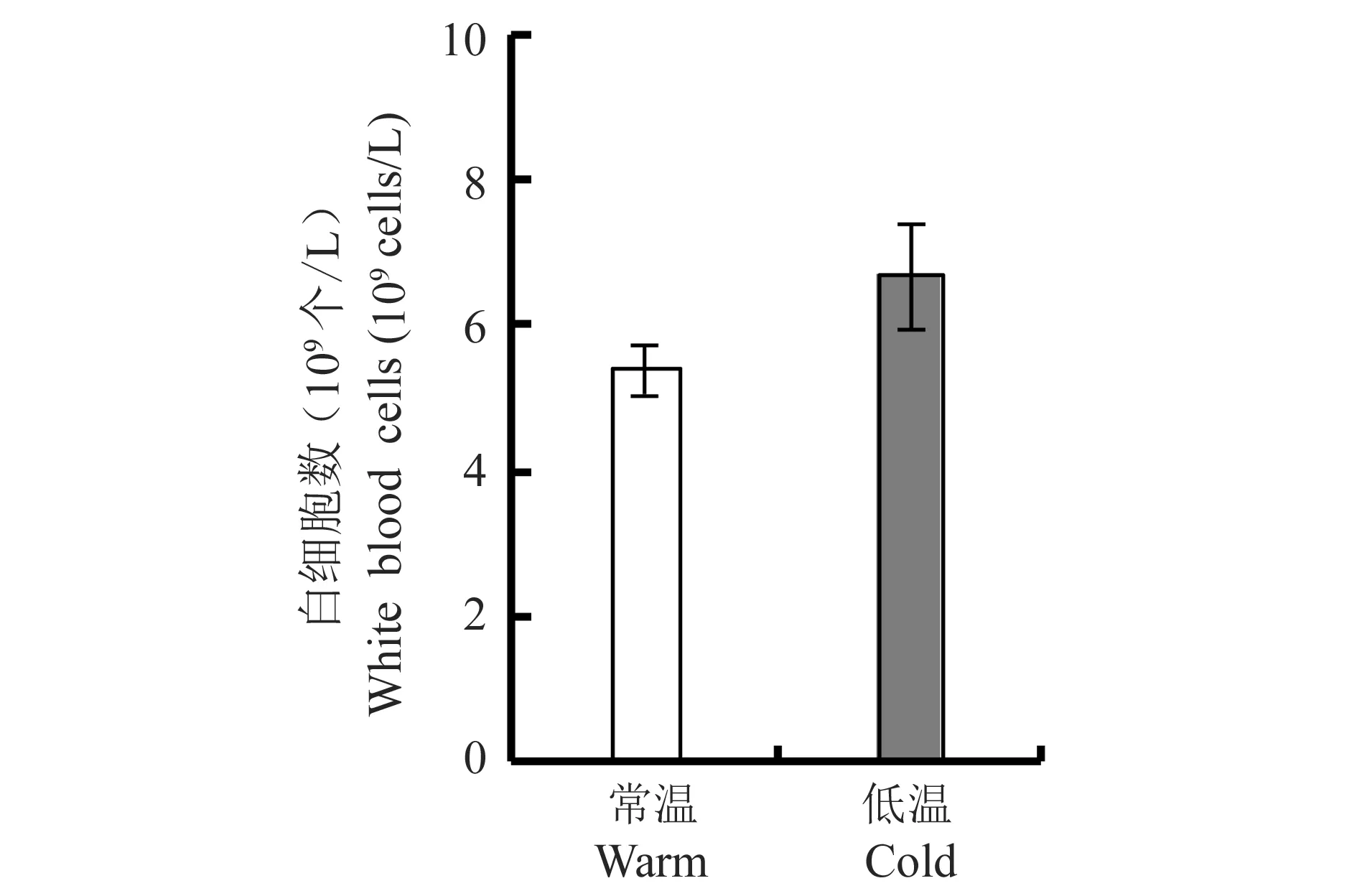
图2 低温对雄性三线仓鼠白细胞数的影响
2.5 细胞免疫
重复测量的方差分析显示,PHA反应随PHA注射后时间的延长而发生变化(F4,64=27.609,P<0.001),同时受时间与分组之间交互作用的影响(F4,64=3.342,P=0.015) (图3).具体来说,常温组PHA反应在注射PHA后24 h达到最大值(F4,36=35.794,P<0.001),而低温组PHA反应在注射PHA后逐渐降低(F4,28=5.371,P=0.002).独立样本T检测分析表明,低温组PHA反应24 h显著低于常温组(t=2.247,df=16,P=0.039) ,而注射PHA后6 h (t=1.330,df=16,P=0.202)、12 h (t=1.714 ,df=16,P=0.106)、48 h (t= 0.814,df=16,P=0.428)、72 h (t= 1.463,df=16,P=0.163)的PHA反应两组间则没有显著差异 (图3).总体脂重与PHA反应6 h (r=0.037,P=0.885)、12 h (r=0.004,P=0.989)、24 h (r=0.179,P=0.477)、48 h (r=-0.120,P=0.634)、72 h (r=-0.044,P=0.863)均不存在相关性.
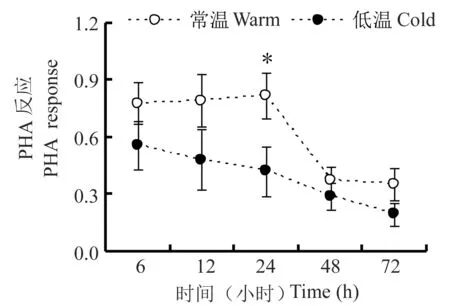
图3 低温对雄性三线仓鼠PHA反应的影响.星号(*)表示组间差异显著(P<0.05)
3 讨 论
低温降低了三线仓鼠的体重、体脂重和细胞免疫水平,而脾脏鲜重、胸腺鲜重、白细胞数没有显著性变化.
3.1 低温对体重和身体成分的影响
低温显著降低了三线仓鼠在实验处理第30天和第31天的体重,这与布氏田鼠[22]、黑线仓鼠(Cricetulusbarabensis)[21]和长爪沙鼠(MerionesUnguiculatus)[23]的体重不受低温影响的结果不同.这可能与低温处理的方式以及物种差异有关,本实验是采取逐渐降低温度至4 ℃,而在布氏田鼠、黑线仓鼠和长爪沙鼠的研究中直接将动物放于4 ℃低温环境中.低温显著降低了三线仓鼠的胴体鲜重,这与黑线仓鼠[21]的研究结果一致,但与布氏田鼠[22]和长爪沙鼠[23]中胴体鲜重不受低温影响的结果不同.低温降低了三线仓鼠的脂肪总重,说明低温下三线仓鼠动用了体内的能量贮存,这一结果与布氏田鼠[22]和长爪沙鼠[23]低温下脂肪含量没有显著变化不同.
3.2 低温对免疫的影响
我们发现三线仓鼠胸腺和脾脏鲜重、白细胞总数均不受低温的影响,这与低温下长爪沙鼠免疫器官不发生变化的结果一致[27].常温组PHA反应随PHA注射时间延长先升高,到24 h达最大值,随后降低,而低温组PHA反应随着PHA注射时间延长逐渐降低,并且低温组注射PHA后24 h的PHA反应显著低于常温组,表明低温抑制了三线仓鼠的细胞免疫能力,暗示其防御病毒等胞内病原体的能力可能下降.该结果与黑线仓鼠细胞免疫不受低温影响的结果不同[24],原因可能是与物种差异、低温处理的方式不同等有关.此外,我们发现,常温组三线仓鼠PHA反应最大值出现在注射PHA后24 h,而在长爪沙鼠、黑线仓鼠中PHA反应最大值出现在注射PHA后6 h[20,24],这可能与它们的分布及其生活环境中病原体种类和数量有关.通常情况下,如果病原体的种类及数量较少,能进行快速的免疫反应对动物来说是有利的;反之,如果动物经常受到许多种类的病原体攻击,那么免疫反应发生较慢是有利的[19],长爪沙鼠主要分布于内蒙古荒漠半荒漠区,黑线仓鼠是主要分布于华北地区,其生境中病原体种类和数量可能较少.尽管三线仓鼠是宠物鼠,其祖先原始生活于蒙古高原西部和南部草原,生活环境中的病原体种类和数量可能较多.
脂肪不仅是动物的能量储存场所,而且还能分泌许多脂肪因子如瘦素等,通常情况下机体的能量贮存降低会损害动物的免疫功能[25,26],我们发现PHA反应与总体脂重不存在相关性,尽管低温条件下三线仓鼠总体脂重显著下降,但降低的体脂可能不是其细胞免疫受抑制的原因.低温等应激环境通常会导致应激激素如皮质酮水平的升高,而应激激素通常能抑制动物的免疫功能[27],三线仓鼠细胞免疫受抑制是否由应激激素引起的,还需要进一步研究.

