二维斑点追踪成像评估左心房功能对糖尿病合并急性冠脉综合征患者预后的预测价值
周翠翠 左铁牛 王中群 樊廷攀 徐良洁
糖尿病患者中急性冠脉综合征(acute coronary syndrome,ACS)的患病率高且容易复发,主要不良心血管事件(major adverse cardiovascular events,MACEs)发生率高[1]。作为冠心病中最严重的类型,ACS是威胁人类生命健康的“第一杀手”,我国每年ACS的发病率较高[2]。再灌注治疗是否及时,将直接影响ACS患者术后心功能的恢复和MACEs的发生率、全因死亡率。因此,寻找临床评估ACS再灌注治疗预后的有效指标意义重大[3]。
近年来,左心房功能在MACEs的风险性、死亡率及预后方面的预测作用受到重视。左心房容量已成为心力衰竭、脑卒中、房颤、心肌梗死及心源性死亡等事件的独立预测因子[4-5],因此,深入了解左心房的结构和功能对MACEs的风险及预后的评估有重要意义。
二维斑点追踪成像(two-dimensional speckle tracking imaging,2D-STI)技术通过追踪心肌斑点信号,计算出心肌的形变程度,即应变,能够更为细致地划分心肌节段,从而更加准确地反映心肌局部的细微病变[6]。有研究提示,使用2D-STI技术可以敏感地发现糖尿病患者左心房功能的改变[7]。本研究对糖尿病合并ACS患者使用2D-STI技术检测左心房的具体功能,并判断左心房功能相关指标对糖尿病合并ACS患者的预后是否有预测价值。
1 对象与方法
1.1 一般资料
入选确诊为糖尿病合并ACS的患者142例,另选取未合并ACS的糖尿病患者67例为对照组。本研究经我院伦理委员会审查通过。所有入选的ACS患者均行冠状动脉支架植入术,于术后1 d以及3、6、9、12、18个月进行定期随访。两组患者年龄、性别等一般资料比较,差异无统计学意义,具有可比性。见表1。

表1 各组患者一般资料和超声心动图参数比较Tab.1 Comparison of baseline data and echocardiographic parameters among three groups
纳入标准:ACS患者包括ST段抬高型心肌梗死及非ST段抬高型ACS患者;所有患者均符合《急性冠脉综合征急诊快速诊治指南(2019)》诊断标准[8],且通过我院门急诊或区域协同救治模式纳入我院。未合并ACS的糖尿病患者均经过冠状动脉造影检查且冠脉狭窄程度<70%。
排除标准:心脏瓣膜病、先天性心脏病、大量心包积液、原发性心肌病、恶性肿瘤、原发性心房疾病、失访或图像质量差者。
患者分组:糖尿病合并ACS患者随访终点18个月时的左心室射血分数(left ventricular ejection fraction,LVEF)较术后1 d降低为恢复欠佳,根据这个标准将患者分为2组,即好转组(LVEF值较术后1 d不降低,n=77)和恶化组(LVEF值较术后1 d时降低,n=65)。
1.2 仪器与方法
选择GE Vivid E9彩色多普勒超声诊断仪,M5S探头,频率2~4 MHz。受试者取左侧卧位,同时触发心电图。常规超声心动图获取左心房内径(left atrial diameter,LAD)、左心室舒张末内径(left ventricular end diastolic diameter,LVEDd)、舒张期末室间隔厚度(interventricular septum diameter,IVSD)、舒张期末左心室后壁厚度(left ventricular posterior wall thickness,LVPWT),使用双平面Simpson法测量LVEF。再分别获取心尖四腔以及心尖两腔至少3个心动周期的二维超声图像。采用EchoPAC工作站,进入2D Strain分析界面,勾画左心房心内膜,获取左心房整体和左心房前壁、下壁,房间隔,侧壁的基底段、中间段及房顶部6个节段的应变及应变率参数。
1.3 评价指标
随访术后1 d以及3、6、9、12、18个月死亡率、MACEs(心力衰竭、心源性休克、恶性心律失常、复流后再梗死)发生率及LVEF、LVEDd等超声指标。
1.4 统计学处理

2 结果
2.1 各组患者基线资料比较
比较各组LAD、IVSD、LVPWT、二尖瓣口A波峰值,显示恶化组均明显高于好转组和对照组,好转组亦显著高于对照组(P均<0.05);恶化组E/A值明显低于好转组与对照组,好转组亦显著低于对照组(P均<0.05)。见表1。
2.2 各组左心房常规参数比较
在左心房最大、最小容积指数,左心房主动排空分数以及左心房收缩前容积指数方面,恶化组>好转组>对照组,3组之间比较差异有统计学意义(P均<0.05);左心房被动排空分数比较,恶化组<好转组<对照组,3组之间差异有统计学意义(P均<0.05)。见表2。

表2 各组患者左心房常规超声参数比较Tab.2 Comparison of routine left atrial echocardiographic parameters among three groups
2.3 各组患者左心房应变及应变率指标比较
在左心室收缩期左心房应变和应变率、舒张早期左心房应变和应变率方面,恶化组<好转组<对照组,3组之间的差异有统计学意义(P均<0.05);舒张晚期左心房应变及应变率比较,糖尿病合并ACS患者较对照组明显升高(P<0.05),但好转组与恶化组之间比较差异无统计学意义(P均>0.05)。见图1及表3。
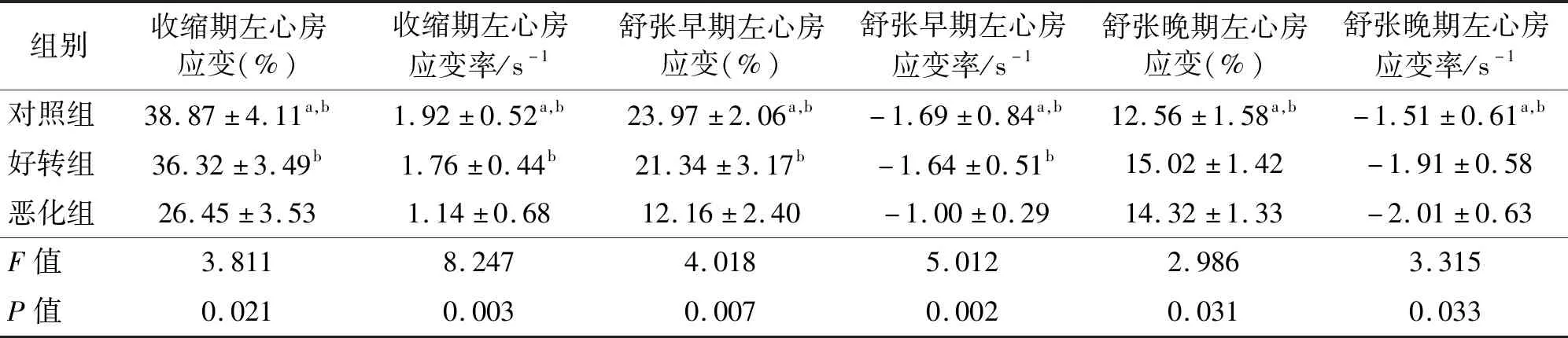
表3 各组患者左心房应变及应变率参数比较Tab.3 Comparison of left atrial strain and strain rate among three groups

A:对照组;B:好转组;C:恶化组。图1 各组患者左心房应变以及应变率图Fig.1 Two-dimensional speckle tracking images of left atrial strain and strain rate among three groups
2.4 收缩期左心房应变参数与左室射血分数的相关性
以LVEF是否好转为标准,对收缩期左心房应变(left atrial systolic strain,LAs-s)和舒张早期LAs-s进行受试者工作曲线分析,结果显示LAs-s预测LVEF恢复的曲线下面积(AUC)最大(达0.850),cut-off值为20.15%(图2)。

图2 收缩期左心房应变和舒张早期左心房应变预测左室射血分数转归的ROC曲线 Fig.2 Receiver operating characteristic curves of systolic left atrial strain and early diastolic left atrial strain for predicting recovery of left ventricular ejection fraction
2.5 收缩期左心房应变值高的患者主要不良心血管事件发生率低
根据收缩期LAs-s cut-off值,进一步将入选糖尿病合并ACS患者分为低LAs-s组(<20.15%,n=62)和高LAs-s组(≥20.15%,n=80)。将心力衰竭、恶性心律失常、心源性休克等MACEs及死亡的发生定义为终点事件,并绘制生存曲线。结果显示高LAs-s组终点事件发生率低于低LAs-s组。见图3。

图3 收缩期左心房应变高低两组患者的生存曲线Fig.3 Survival curves of high-and low-LAs-s groups
3 讨论
在1个心动周期中,左心房行使3项功能,即贮存功能、通道功能以及助力泵功能。当左心房接受肺静脉的血液回流时,左心房行使贮存功能,此作用发生在左心室收缩期和等容舒张期;血液通过左心房通道功能进入左心室,此功能发生在左心室舒张早期;左心室进一步充盈,是在左心房主动收缩发挥助力泵功能时产生的,发生在左心室舒张晚期[9-10]。其中,贮存功能和通道功能为左心室提供75%的充盈量,助力泵功能为左心室提供25%的充盈量。ACS发生后,心肌缺血造成左心室收缩和舒张功能的损失,此时左心房的代偿功能尤为重要[11]。左心房在整个心血管循环系统中发挥着举足轻重的作用,左心房功能的改变与MACEs的发生息息相关,因此,通过左心房功能的改变预测MACEs具有广阔的应用前景[12]。
ACS患者常伴发应激和炎症反应,在恢复期时因心肌功能的损失、心肌氧供供求的不平衡可进一步造成心肌损害,导致心肌纤维化,影响心功能的恢复[13]。一些用于评价左心室功能的指标(如LAD、IVSD、LVPWT值、A波峰值、E/A值)容易受心房以及房室间压差、负荷状态等不同情况的影响。评价左心房的指标(如左心房容积、左心房射血分数)也容易受操作者经验、图像质量等因素的影响,可重复性欠佳。2D-STI技术通过追踪心肌斑点信号,将心肌进一步分层细化,为心脏整体运动与局部运动应变提供了一种更为精密的定量分析手段。
本研究首先测量了评价心功能的传统超声指标,同时应用2D-STI技术将左心房每个切面分为6个节段,得出相应的应变及应变率。舒张早期左心房应变及应变率反映心房的通道功能,舒张晚期应变及应变率反映左心房的助力泵功能,收缩期左心房应变及应变率反映左心房的贮存功能[7]。本研究发现,根据患者心功能的恢复情况分组,在左心室收缩期、舒张早期,左心房应变和应变率与LVEF呈正比,表明糖尿病合并ACS患者左心房的贮存功能、通道功能受损;舒张晚期左心房应变及应变率比较,糖尿病合并ACS患者较糖尿病非ACS患者升高,表明左心房助力泵功能受损。
糖尿病患者发生ACS后,由于发生心肌缺血,首先出现心室收缩功能减弱,左心室射血功能减弱,心室容量负荷增加,进一步影响左心房功能。在左心室收缩期,由于左心房残余血量增加,左心房最小容积增大,左心房贮存功能减弱,造成LAs-s及应变率降低。在舒张早期,由于左心室抽吸作用减弱,左心房-左心室压差降低,左心房通道功能减弱,造成舒张早期左心房应变及应变率降低。在舒张晚期,由于左心房残余血量的增加,左心房收缩前负荷增加,左心房收缩力代偿性增加,左心房助力泵功能增强,造成舒张晚期左心房应变及应变率升高。糖尿病合并ACS患者在心肌缺血发生时,左心室收缩和舒张功能受损,进而使左心房功能发生变化,左心房通过助力泵功能、通道功能和贮存功能的代偿,最大限度地保障左心室充盈量。
左心房功能受损在初期是可逆的,发生不可逆损伤的根本原因是心房肌纤维化导致的左心房重构。对于糖尿病合并ACS患者,如果心肌再灌注治疗及时,心肌缺血情况得到改善,则左心室功能可在一定程度上恢复,LVEF恢复正常,左心房体积也会相应缩小,左心房功能得以恢复。如果心肌再灌注治疗效果不理想,心室肌缺血改善不明显,缺血心室肌发生纤维化,则左心室功能障碍会加重,LVEF进一步降低,左心房的代偿状态转为失代偿,左心房体积增大,左心房发生不可逆损害,心房肌纤维化,故左心房应变及应变率较LVEF恢复者进一步恶化。
本研究也存在一些不足之处:样本量较小,随访时间较短,且为单中心研究。今后我们将扩大样本量、延长随访时间,并进行多中心的联合研究。
本研究将左心房应变及应变率与左心室功能的恢复情况相联系,结果显示,左心房的应变及应变率与LVEF相关,并与死亡率、MACEs等不良预后相关,表明左心房应变及应变率对糖尿病合并ACS患者心肌缺血后的预后评估具有临床价值。糖尿病合并ACS患者左心房应变指标可为患者的规范化治疗提供更完整的临床依据,有助于对心功能预后不佳的高危患者进行早诊断、早预防、早干预,最终提高对糖尿病合并ACS患者的救治能力。

