葡萄桑葚复合果醋工艺优化和不同发酵时期的风味成分检测
石晨晖,沈晓溪,张一鸣,赵梓伊,李思怡,杨晋一,汪婷婷,尚宏丽
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
葡萄属浆果类,皮薄且多汁,具有多种保健功能[1]。葡萄中酚类等活性成分含量较多,经研究表明,由非金属元素砷引起的小鼠生殖毒性能从葡萄果皮提取物中的酚类物质得到缓解[2];此外多酚类物质还有清除自由基、预防慢性疾病等功效[3]。桑葚属聚合果类,呈深紫色,含有芦丁、花色苷、白黎芦醇等活性成分[4]以及水溶性维生素,是可作为中药食用的果品之一[5]。桑葚不仅起到抗氧化[6]、降低胆固醇、延缓衰老等功能,还具有滋养及黑发明目等功效[7]。研究表明,桑葚提取物对非酒精性脂肪性肝病有良好的防治作用[8],对青年人群的注意力、直觉、运动能力有增强作用[9]。
果醋是一种新型饮品和调味品,氨基酸和有机酸含量丰富,有抗氧化、抗菌、消除机体疲劳[10]及促进血液循环等[11]生物功能。其中葡萄果醋是常见的功能性饮品,含有大量有机酸且能增强人体的免疫功能,深受消费者喜爱。然而目前市场上果醋的原料太过单一,所以许多学者开始研究复合型果醋,例如,陈智理等[12]研究以香蕉、西番莲及龙眼为原料的复合果醋,研究其固定化生产材料和生产工艺,最后确定玉米芯为固定化生产材料,并经优化得出复合果醋醋体的总酸度达到最大值5.05%。如今对于复合果醋的研究更注重于工艺的优化、成分的优化选择以及风味的改良等方面[13−14]。对于不同食品的风味成分检测,包括电子鼻、气相色谱-质谱(GC-MS)、气相色谱-吸闻(GC-O)等技术。其中电子鼻技术操作简便、灵敏度高且检测速度快,并对所检测样品的不同加工阶段有效区分[15],据曹有芳等[16]的研究表明,采用单因素实验和电子鼻技术结合主成分分析,获得电子舌的最佳检测参数为样品稀释30倍,应用优化的参数进行电子鼻分析可有效区分陕长富、甘长富、鲁长富三种苹果酒,区分效果较好;蓬桂华等[17]比较了电子鼻和电子舌对市售不同品牌桑果汁气味、滋味分析的差异,其主成分分析累计方差贡献率达99.905%,各样品判别指数在0.977~1.000之间,结果表明电子鼻能够对不同样品进行准确区分。
本研究摒弃传统单一型原料果醋,以葡萄和桑葚为原料,以果醋产酸量为检测指标,考察初始乙醇浓度、pH、醋酸菌接种量、发酵温度指标对葡萄和桑葚复合型果醋品质的影响,旨在开发一款营养物质搭配平衡且全面的复合型果醋最佳工艺,丰富果醋原料种类,为复合型果醋发酵提供理论基础。
1 材料与方法
1.1 材料与仪器
葡萄(巨峰)、桑葚(桑甜1号) 锦州市水果超市;酿酒酵母菌 安琪酵母股份有限公司;醋酸菌锦州医科大学实验室保存;白糖 锦州市大商集团;果胶酶(50000 U/g)、葡萄糖(分析纯)、氢氧化钠(分析纯)、碳酸钙(CaCO3) 天津市致远化学试剂有限公司;固体培养基(g/L):酵母膏1%,葡萄糖1%,CaCO32%,无水乙醇3%,琼脂2%,121 ℃灭菌21 min(CaCO3经165 ℃,30 min干热灭菌);液体培养基(g/L):葡萄糖1%,酵母膏1%,120 ℃灭菌21 min,用前加3%无水乙醇(pH自然)。
HZQ-X500型恒温立式振荡培养箱 上海一恒有限公司;HH-S28型双列八孔水浴锅 常州梅香仪器有限公司;PEN3型电子鼻 北京盈盛恒泰科技有限公司;HN-25S型恒温培养箱 山东博科生物产业有限公司;SW-CJ-2D型超净工作台 广州凯雷智能科技有限公司;PHS-3C型酸度计 上海雷磁仪器有限公司;KEM/DA-100型酒精计 日本京都有限公司。
1.2 实验方法
葡萄桑葚复合果醋工艺流程:原料清洗→搅拌、榨汁→酶解(果胶酶)[18]→过滤→调配(加白糖、柠檬酸)→酒精发酵→加入活化后的醋酸菌→醋酸发酵→过滤→杀菌(巴氏杀菌,68~70 ℃加热30 min)→装罐→成品果醋
1.2.1 原料处理 挑选成熟且无损伤的葡萄和桑葚,进行清洗,按照1:1的原料比称量后放入搅拌机中进行搅拌、榨汁,向葡萄桑葚果汁液中加入质量分数0.15%的果胶酶,搅拌均匀并放入30 ℃加热2 h,以分解原料中的果胶物质。酶解后的葡萄桑葚果汁液使用脱脂棉纱布挤压过滤并装瓶备用,然后根据1.7 g/L的糖能产生1%酒精加入适量白糖[19],调节适宜发酵糖度,再加入柠檬酸将果汁pH调配至5.0。调配完成后,装入已灭菌发酵罐中。
1.2.2 酒精发酵 称取5 g的酿酒酵母置装有100 mL葡萄糖溶液的烧杯中,放入37 ℃的恒温水浴锅中加热10 min活化,不断搅拌至溶液产生小气泡为止。按7%的接种量将活化后的酿酒酵母接种于1 L发酵容器中并用4层脱脂纱布进行密封,放置于实验室阴暗处,在28~30 ℃条件下进行酒精发酵。发酵5~6 d后取出,调整初始乙醇浓度。
1.2.3 醋酸菌活化 按照上文所述配制,灭菌后冷却至室温,并向固体、液体培养基中分别加入质量分数为3%的无水乙醇。取出斜面保藏的自筛醋酸菌,取一环用划线分离法接种于冷却后的固体培养基中30 ℃培养2d,再接种至装有液体培养基的锥形瓶中,将接种后的液体培养基放置于立式摇床中在30 ℃,150 r/min条件下振荡培养24 h,至浓度为2.4×109CFU/mL备用。
1.2.4 醋酸发酵 葡萄糖直接转化为醋酸的含量低,因此需醋酸菌氧化经酒精发酵后产生的乙醇而生成足量醋酸。接种一定量的活化醋酸菌至发酵液中,并在一定温度,150 r/min条件下振荡发酵7 d。发酵期间每24 h测量一次产酸量[20]。
1.2.5 单因素实验 根据上述发酵工艺,将初始乙醇浓度设置为5%、6%、7%、8%、9%,其余条件固定为:醋酸菌接种量8%,发酵温度32 ℃,pH5.0,测定果醋发酵后的产酸量;发酵pH调节为4.0、4.5、5.0、5.5、6.0,其余条件固定为:初始乙醇浓度7%,接种量8%,温度32 ℃,测定发果醋产酸量;将醋酸菌接种量设置为4%、6%、8%、10%、12%,其余条件固定为:乙醇浓度为7%,温度32 ℃,pH5.0,测定果醋产酸量;将温度分别设置为28、30、32、34、36 ℃,其余条件固定为:初始乙醇浓度7%,接种量8%,pH5.0,进行果醋产酸量测定。
1.2.6 响应面试验 本文采用响应面试验设计[21]分析和预测葡萄桑葚复合果醋最佳工艺条件。经1.2.5所述单因素实验并结合多重比较,初步选取响应面试验的主要因素条件:初始乙醇浓度(6%、7%、8%)、pH(4.5、5.0、5.5)、醋酸菌接种量(8%、10%、12%)、发酵温度(30、32、34 ℃),产酸量为响应值。使用Design Expert 10软件对已知实验数据进行分析,试验设计见表1 。

表1 响应面试验设计水平与编码Table 1 Response surface test design level and coding table
1.3 电子鼻检测
本文采用PEN3型电子鼻对葡萄桑葚复合果醋不同发酵时期进行风味成分检测[22]。PEN3型电子鼻设备,主要利用其具有的10个气体传感器[23]来进行样品的风味成分测定,传感器名称和性能见表2。将不同发酵时期果醋准确量取相同质量20 mL装入50 mL烧杯中,用封口膜密封,室内环境为23~28 ℃,3组样品各3个平行。测定参数设为5 s样品预备时间,1 s样品分隔时间,10 s调零时间,100 s冲洗时间,60 s测定时间。

表2 PEN3型电子鼻的传感器及性能Table 2 Sensor and performance of PEN3 electronic nose
1.4 数据处理
使用WPS Office Excel软件进行实验中的数据分析和图表制作。使用PEN3型电子鼻配套的Win-Muster软件对49~58 s的果醋挥发性成分测定数据进行分析。
2 结果与分析
2.1 初始乙醇浓度对果醋发酵的影响
如图1所示,固定其他发酵因素的情况下,随着初始乙醇浓度的增加,产酸量呈先增加后减少的趋势,初始乙醇浓度对果醋发酵影响显著(P<0.05)。在初始乙醇浓度小于7%时,产酸量随浓度升高而增加;超过7%产酸量开始下降但仍高于乙醇浓度为5%和6%,可能是在乙醇浓度低时,没有构成满足醋酸菌生长的条件,而乙醇浓度增高时,醋酸菌活性又被抑制[24],从而产酸量呈先上升后下降的趋势。并且经多重比较分析,初始乙醇浓度为7%时产酸能力较强,对果醋发酵的影响相比其它浓度最为明显。因此,初始酒精浓度为7%是最优条件,并将其作为响应值,6%、7%、8%三个初始乙醇浓度为响应面试验中的三个水平。

图1 初始乙醇浓度对醋酸发酵的影响Fig.1 Effect of initial ethanol concentration on acetic acid fermentation
2.2 发酵pH对果醋发酵的影响
如图2所示,不同发酵pH对果醋发酵影响显著(P<0.05),产酸量在pH为5.0时达到峰值,小于5.0时随pH增加而增加,大于5.0时逐渐减少。原因可能是pH为4.0、4.5和5.5、6.0没有为醋酸发酵创造良好的条件,抑制了醋酸菌体中的酶活性,阻碍了醋酸菌的生长繁殖和代谢,导致醋酸转化酒精的能力降低[25],产酸量过低。经多重比较分析,pH5.0时产酸量高于其它pH。因此,发酵pH5.0最佳,最终选择pH为4.5、5.0、5.5作为响应面试验的三个水平。
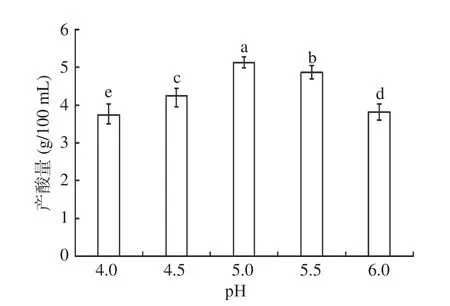
图2 pH对醋酸发酵的影响Fig.2 Effect of pH on acetic acid fermentation
2.3 醋酸接种量对果醋发酵的影响
如图3所示,不同醋酸菌接种量对果醋发酵影响显著(P<0.05)。接种量10%时果醋产酸量最大,低于10%产酸量随接种量增加而增大,高于10%产酸量开始呈现下降趋势。可能是醋酸菌接种量过少时,发酵液中菌体不足,不能彻底发酵;而接种量过高时,发酵液中菌种增加,从而耗费大量的营养物质,而醋酸菌繁殖过快使得发酵后期发酵液中无微生物存在,进而产酸量降低[26]。经多重比较得到接种量10%对醋酸发酵的影响更显著(P<0.05)。因此确定接种量10%为最佳,选择8%、10%、12%三个接种量进行响应面试验分析。

图3 接种量对醋酸发酵的影响Fig.3 Effect of inoculation amount on acetic acid fermentation
2.4 发酵温度对果醋发酵的影响
如图4所示,发酵温度对果醋发酵影响显著(P<0.05)。28~32 ℃范围内果醋产酸量随温度升高而逐渐增大,温度超过32 ℃,产酸量开始下降,温度越高产酸量越低。可能是温度过低时,醋酸菌中酶活性不够,不足以充分发酵;而温度过高会使醋酸菌中的酶活性失活,加速醋酸菌生长,提前老化,从而导致果醋产酸量降低,影响发酵效率[27]。经多重比较得到发酵温度为32 ℃对醋酸发酵影响最为显著(P<0.05),最终选择32 ℃为响应值,30、32、34 ℃为三个水平进行响应面试验分析。

图4 温度对醋酸发酵的影响Fig.4 Effect of temperature on acetic acid fermentation
2.5 响应面优化试验结果
根据单因素实验,以产酸量(R)为响应值,每个影响因素择出三个水平即:A 初始乙醇浓度(6%、7%、8%)、B pH(4.5、5.0、5.5)、C 醋酸菌接种量(8%、10%、12%)、D 发酵温度(30、32、34 ℃),设计响应面试验,经Box-Benhnken[28]分析得出结果见表3。
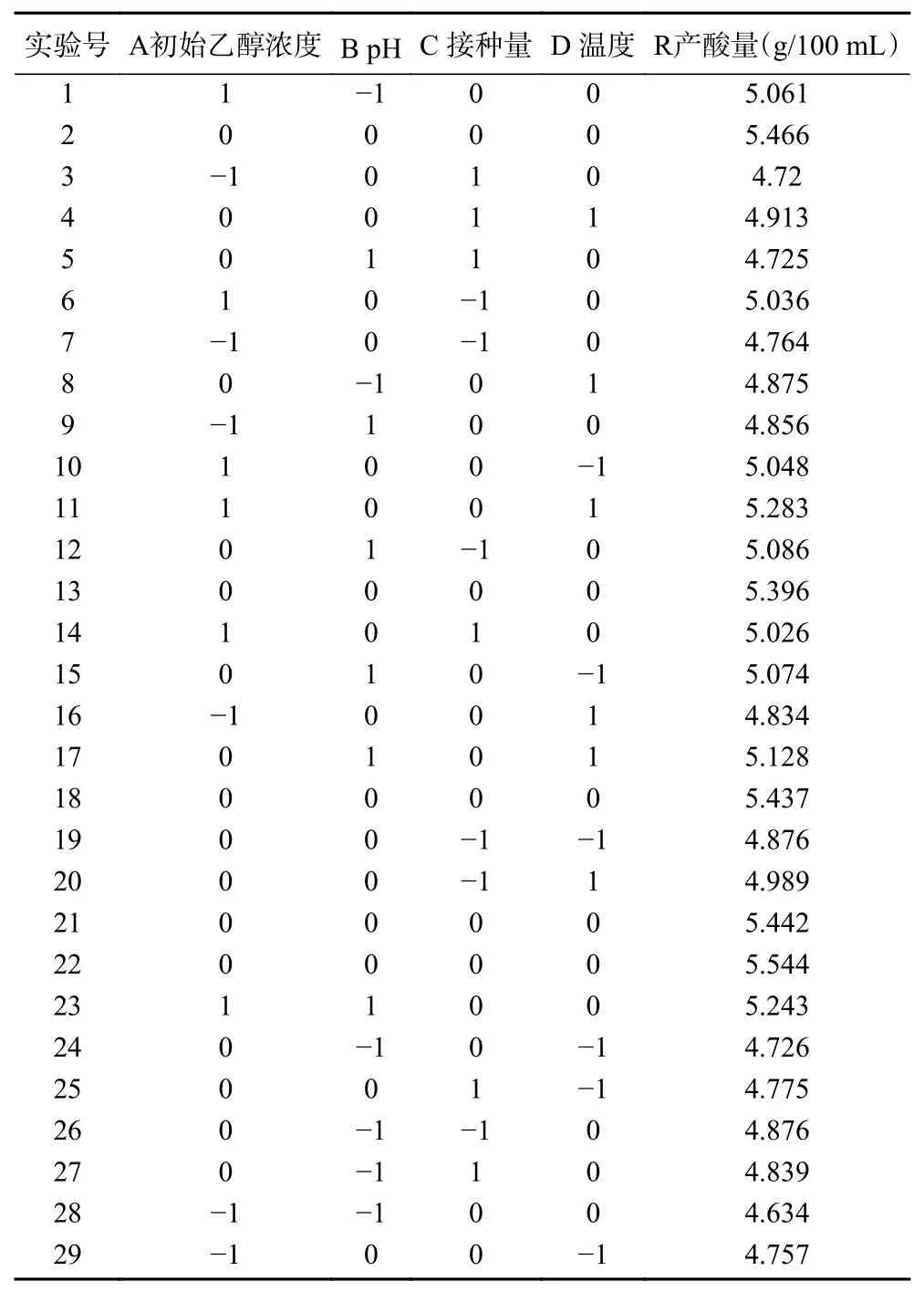
表3 响应面试验设计分析与结果Table 3 Response surface test design analysis and results
应用Design Expert 10软件对表3中的数据进行回归分析[29],最后得到果醋产酸量的回归方程:R=+5.46+0.18A+0.092B−0.052C+0.064D−0.01AB+0.0085AC+0.04AD−0.081BC−0.024BD+0.00625CD−0.24A2−0.26B2−0.32C2−0.24D2,对其进行方差分析,结果见表4。
结果见表4,可看出模型组的P<0.0001,说明试验回归方程模型极显著;失拟项P=0.2795>0.05,不显著,证明模型选择正确;决定系数R2=0.9633>0.9,校正决定系数RAdj2=0.9265>0.9,证明该预测模型结果与实验结果的拟合性好[30],且试验具有极小误差。综上所述该回归模型可以应用于果醋的产酸量分析与预测。

表4 果醋产酸量回归方程分析Table 4 Regression equation analysis of acid yield of fruit vinegar
各因素一次项的P值均<0.05,对果醋的产酸量影响显著,且影响的大小顺序为:A初始乙醇浓度>B pH>D温度>C接种量。各因素的二次项P值均<0.01,影响极显著,说明果醋产酸量的变化复杂,各因素对产酸量的影响交错复杂。果醋产酸量受各因素的影响结果见图5。
由图5各因素交互影响图所呈曲线,可看出此结果与单因素实验结果大致相同,产酸量随着各因素水平的递增而呈现先增大后减小的趋势。因交互曲线越陡峭,等高线越接近椭圆状,则可说明这两个因素的影响越显著[31],由此可知pH值与接种量的交互作用较显著,与方差分析结果一致。经过响应面试验优化,最终得到葡萄桑葚复合果醋的最佳工艺条件:初始乙醇浓度7.372%,pH5.089,接种量9.807%,温度32.306 ℃,预测理论最大产酸量为5.506 g/100 mL。因实验存在一定误差,所以对试验结果进行验证。将工艺条件进行调整:初始乙醇浓度7.4%,pH5.0,接种量9.8%,温度32 ℃,最终测得产酸量结果为5.38 g/100 mL,与响应面试验预测的理论最大值之间存在2.3%的误差率,说明此模型能较好地模拟和预测葡萄桑葚复合果醋的发酵工艺条件,模型可靠且具有实用性。
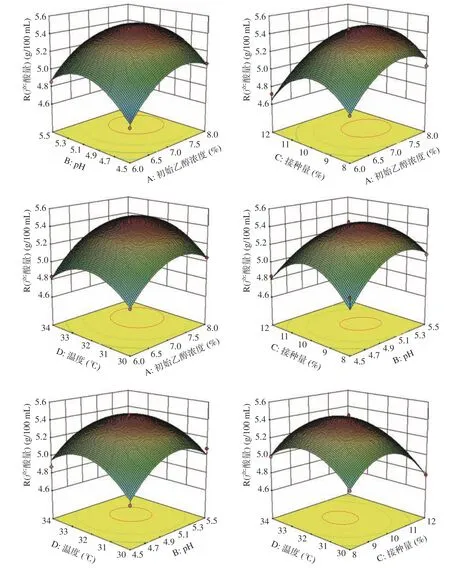
图5 初始乙醇浓度、pH、接种量及温度对果醋产酸量的交互影响图Fig.5 Interaction of initial ethanol concentration, pH value, inoculation amount and temperature on acid production of fruit vinegar
2.6 电子鼻检测数据分析
2.6.1 果醋不同发酵时期的响应雷达图分析 电子鼻的10个传感器对不同浓度气味的敏感度不同,当传感器接触到样品气味时,相对电导率的比值(G/G0)随气体浓度增加而变化:G/G0>1,样品响应气体浓度大;G/G0≤1,样品气体浓度低或没有。据前人研究发现,经雷达图分析W5S、W1S、W1W及W2S传感器对不同苹果酒的香气响应最明显,初步判定酒中的氮氧化物、萜烯类物质、醇类物质及部分芳香族化合物是影响不同苹果酒风味的主要差异[32]。而本文对于不同发酵时期果醋的响应雷达图如图6所示,可知10个传感器对果醋不同发酵时期均有响应且不同,雷达图形状与面积随果醋的发酵而发生变化,而发酵中期与成品果醋的雷达图整体形状相似,说明从发酵中期开始到发酵完成果醋气味相同且浓度不断增加。果汁中6号、8号传感器的响应强度变化最大,发酵中期2号、7号传感器响应强度变化最大,成品果醋2号、5号及7号传感器响应强度变化最大且与发酵中期相比均有显著增加;从而可知醋酸发酵对果醋的硫化物、氮氧化物及短链烷烃芳香类等风味成分的提升有显著影响,且不同发酵时期的风味成分存在明显差异。
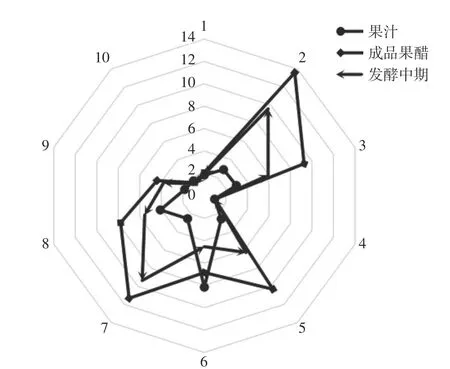
图6 果醋不同发酵时期的电子鼻响应雷达图Fig.6 Radar diagram of electronic nose response in different fermentation stages of fruit vinegar
2.6.2 果醋不同发酵时期的PCA分析 PCA即主成分分析,是一种在原始维度上转换为一种新的维度同时保留原始的数据信息的数据降维算法。一般第一主成分(PC1)的贡献率远大于第二主成分(PC2)的贡献率[33],且两者总贡献率超过85%就可以反映原始数据的信息[34]。果醋的不同发酵时期的PCA分析如图7所示,每个椭圆代表不同发酵时期果醋风味成分的数据采集点,点之间距离表示每个样品之间的差异性大小。图中PC1贡献率为94.70%,PC2贡献率为5.25%,总贡献率为99.95%。其中成品果醋的PC1和PC2的浓度均为最大,发酵中期两种主成分均为最小,且果汁与成品果醋的PC2的气味最为相似。发酵中期果醋的风味成分与果汁和成品果醋差别很大。

图7 不同发酵时期果醋的PCA分析图Fig.7 PCA analysis diagram of fruit vinegar at different fermentation stages
2.6.3 果醋的Loading分析 Loading分析是针对电子鼻传感器分析,薛友林等[35]对货架期蓝莓的挥发性成分进行载荷分析,发现W5S传感器贡献率最大,得出氮氧化合物为蓝莓中含量最高的挥发性成分。本研究结果如图8所示,其中W3S、W1C、W6S三个传感器的PC1和PC2贡献率近似为0,说明其无法识别果醋中的风味成分。其中W5S传感器PC1贡献率最高,W1W传感器PC1贡献率仅低于W5S;W1S传感器PC2贡献率最高,W5C、W3C、W2S三个传感器PC2贡献率低于W1S且近似。参照各传感器的性能特征可知,W5S(氮氧化物)、W1W(硫化物)两种风味成分对葡萄桑葚复合果醋不同发酵时期的差异有主要贡献。
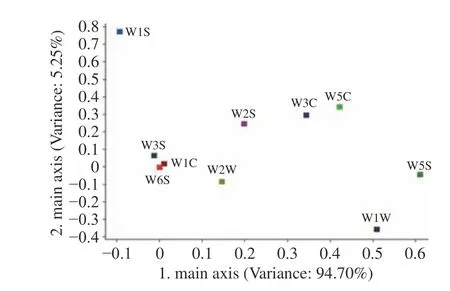
图8 果醋的Loading分析图Fig.8 Loading analysis diagram of fruit vinegar at different fermentation stages
2.6.4 果醋不同发酵时期的LDA分析 LDA分析亦线性判别分析,是通过缩小组内间距,扩大组间间距进行判别。就LDA分析来说,PC1和PC2的总贡献率在70%~85%之间或以上,则方法可以使用[36]。每组样品之间的差距表示样品风味成分变化速率大小。如图9所示,PC1贡献率为99.01%,PC2贡献率为0.99%,总贡献率99.998%,离散度大,说明果汁到发酵中期过程果醋的风味速率变化大,且果醋的三个不同发酵时期的风味成分可以很好地区分开。

图9 不同发酵时期果醋的LDA分析图Fig.9 LDA analysis diagram of fruit vinegar in different fermentation stages
3 结论
本研究通过单因素实验和响应面试验,得到葡萄桑葚复合果醋的最优工艺条件为:初始乙醇浓度7.4%,pH5.0,接种量9.8%,温度32 ℃,在此发酵条件下,测得果醋产酸量为5.38 g/100 mL。经电子鼻技术并结合PCA和LDA分析,最终确定氮氧化物和硫化物等主要风味成分对葡萄桑葚复合果醋不同发酵时期差异的贡献率最高,且不同发酵时期的风味成分有显著差异并能有效区分,其中成品果醋的气味浓度最大。该研究主要以葡萄和桑葚为原料,采用自筛醋酸菌进行发酵,其中在成品葡萄桑葚复合果醋的具体风味成分、感官评定及品质分析等后续研究中有待进行系统性深入研究,以期为复合果醋的研究和开发进行深入推广。

