下调EGFR表达对胃癌AGS细胞活力和基因表达谱的影响
缪鹏飚,徐 倩,贾西云,王梦丹,傅聿铭,巴 楠,张自森
1)郑州大学第五附属医院普通外科 郑州 450052 2)郑州大学第五附属医院肿瘤内科 郑州 450052
胃癌居我国恶性肿瘤发病率第2位并呈上升趋势[1],其治疗方法主要包括手术治疗、化疗及靶向治疗,但由于胃癌早期诊断率低,多数患者诊断时已属中晚期[2],其整体预后较差。化疗是中晚期胃癌患者的重要治疗方法之一,然而近年来由于肿瘤异质性的发生及耐药性的形成,化疗效果难再提高,亟须探索新的治疗方法;siRNA抗肿瘤研究的应用为胃癌患者带来了希望[3]。表皮生长因子受体( epithelial growth factor receptor,EGFR)在调控肿瘤细胞生长中具有重要作用[4]。作者前期研究结果表明,EGFR与胃癌关系密切[5],干扰EGFR表达可抑制胃癌细胞生长并增加化疗药物敏感性[6]。本研究在已构建的EGFR低表达胃癌细胞株的基础上,观察细胞活力和化疗药物敏感性的变化,并运用基因芯片分析胃癌细胞基因表达谱的变化,为靶向EGFR的胃癌治疗提供分子理论基础。
1 材料与方法
1.1 细胞与主要试剂人胃腺癌AGS细胞购自中国科学院典型培养物保藏委员会细胞库,EGFR低表达的AGS细胞委托汉恒生物科技(上海)有限公司构建完成。F-12K培养基购自Millipore公司;Trizol试剂购自Invitrogen公司;ReverTra Ace®qRT-PCR试剂盒、SYBR Green Real-time PCR Master Mix购自TOYOBO公司;CCK-8细胞增殖检测试剂盒购自浙江奥默生物医药有限公司;紫杉醇(PTX)购自哈尔滨三联药业有限公司;奥沙利铂(L-OHP)购自江苏恒瑞医药股份有限公司;5-氟尿嘧啶(5-FU)购自上海旭东海普药业有限公司;顺铂(DDP)购自齐鲁制药有限公司;多柔比星(ADM)购自浙江海正药业股份有限公司。Agilent Human lncRNA基因芯片由上海欧易生物医学科技有限公司提供。
1.2 细胞的分组及培养将胃腺癌AGS细胞(对照组)和低表达EGFR的AGS细胞(EGFR干扰组)置于体积分数5%CO2、37 ℃恒温培养箱中静置培养,根据细胞状态,每24~48 h以PBS洗涤细胞碎片及残渣,并更换新鲜培养基继续培养。
1.3 两组细胞活力的CCK-8方法检测待细胞部分融合或铺满细胞瓶70%~80%时,弃去原培养基,以预冷PBS洗涤3遍,经2.5 g/L胰蛋白酶消化后,室温1 000 r/min离心5 min,弃去上清,以完全培养基重悬沉淀并调整细胞密度至5×106个/mL,将细胞悬液接种于96孔板中(每孔加入100 μL),分别培养24、48、72和96 h后,每孔加入10 μL CCK-8,孵育2 h后检测450 nm处的光密度(OD)值。每个时间点设6个复孔,实验重复3次。
1.4 两组细胞集落形成能力的检测取处于对数生长期的两组细胞,与预冷PBS溶液洗涤3次,分别收集陈旧的细胞培养基及PBS洗脱液,用2.5 g/L胰蛋白酶消化分离细胞,并加入2倍体积新鲜培养基终止消化;混合上述溶液并转移至15 mL离心管中,室温下500 r/min离心5 min后重悬细胞至密度200个/mL,每孔1 mL加入24孔板中,于体积分数5%CO2、37 ℃培养箱中静置培养7 d后,用甲醇溶液固定,体积分数0.1%结晶紫染色进行观察。每组设置3个复孔,实验重复3次。
1.5 两组细胞化疗药物敏感性取处于对数生长期的两组细胞,消化、离心,按相同倍数稀释,分别取200 μL细胞悬液(25 000个/mL)接种于96孔板中,观察细胞形态及长势,待细胞长至孔底面积约70%时,弃去原培养基,以PBS轻微洗涤2次,加入预先配制的不同浓度含药物培养基200 μL,轻轻摇匀使药物充分接触细胞,置于恒温培养箱中继续培养48 h,CCK-8法检测细胞活力变化并分别计算不同药物的IC50值。每组设置3个复孔,实验重复3次。
1.6 芯片扫描与数据分析样品总RNA利用NanoDrop ND-2000(Thermo Scientific)定量并经Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性。RNA样本质检合格后,将其反转录成双链cDNA并进行标记。标记好的cDNA与基因芯片杂交,用Feature Extraction软件处理原始图像,提取原始数据。利用Genespring软件进行汇总、标准化处理。利用两组基因表达差异t检验的P值和差异倍数(FC)值筛选差异基因,标准为log2FC≥2.0且P≤0.05,根据基因芯片数据进行聚类分析。
1.7 差异表达基因的功能富集分析应用功能富集分析(https://david.ncifcrf.gov/)对差异表达基因进行功能描述。通过GO分析和KEGG信号通路分析预测差异表达基因可能涉及的重要生物学功能和信号通路。
1.8 统计学处理采用SPSS 19.0进行数据分析,应用两独立样本t检验比较两组间集落数量、OD值与细胞活力的差异,检验水准α=0.05。应用GraphPad Prism 8.0 作图。
2 结果
2.1 两组AGS细胞活力和集落形成能力的比较与对照组相比,EGFR干扰组细胞活力下降(P<0.05,图1A),集落形成能力降低(P<0.05;图1B)。
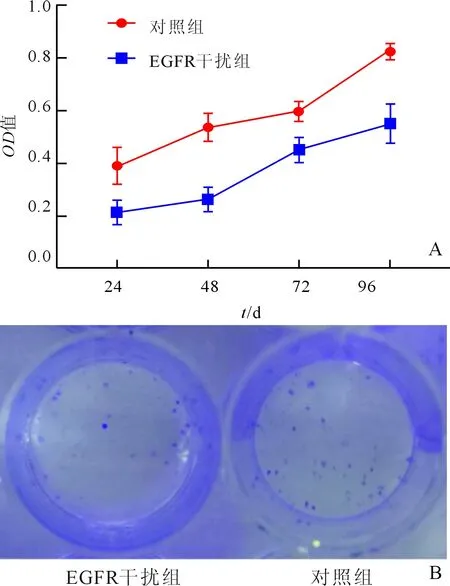
图1 两组AGS细胞活力(A)和集落形成能力(B)变化的比较
2.2 两组AGS细胞化疗药物敏感性的比较随着化疗药物浓度的增加,两组细胞生长活力下降, 且EGFR干扰组AGS细胞对化疗药物更敏感;各类化疗药物IC50值均低于对照组(图2A~E)。
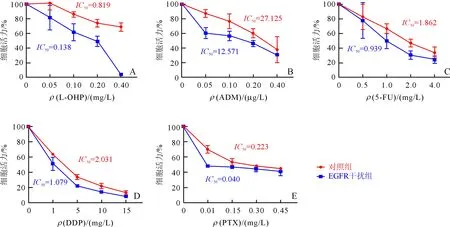
A~E分别为L-OHP,ADM,5-FU,DDP,PTX
2.3 两组AGS细胞差异表达基因分析结果共筛选出差异表达基因1 204个。差异表达的mRNA有865个,其中表达上调242个,表达下调623个(图3A);差异表达的lncRNA有203个,其中表达上调83个,表达下调120个(图3B);差异表达的circRNA有136个,其中表达上调75个,表达下调61个(图3C)。差异表达大的前10位mRNA、lncRNA、circRNA分别见表1~3。

A:差异表达的mRNA;B:差异表达的lncRNA;C:差异表达的circRNA。红色表示上调,绿色表示下调

表1 前10位差异表达的mRNA

表2 前10位差异表达的lncRNA
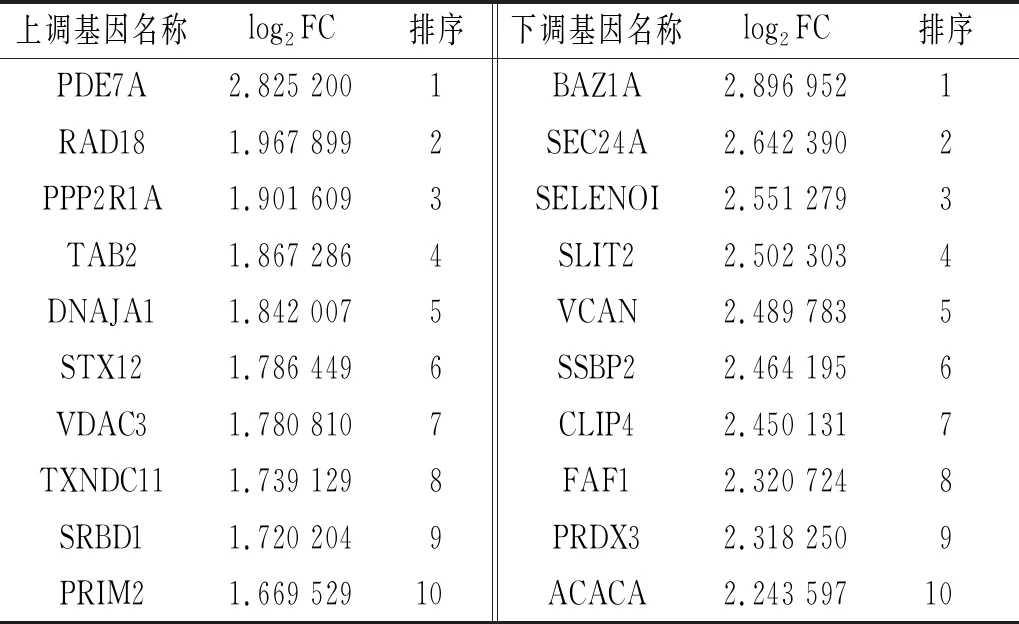
表3 前10位差异表达的circRNA
2.4 差异表达基因的GO注释分析结果显示,差异表达基因主要富集在炎性反应、胶原分解代谢过程、心房心肌细胞膜去极化调节等生物学过程(图4A)。在细胞组分中,差异表达基因主要与胞膜的构成组分、胞膜、细胞外基质等相关(图4B)。分子功能分析显示,差异表达基因主要参与钙离子结合、趋化因子活性、β淀粉样蛋白结合等调控(图4C)。

A:生物学过程;B:细胞组分;C:分子功能
2.5 差异表达基因的KEGG信号通路预测分析结果显示自身免疫性甲状腺疾病、1型糖尿病、NF-κB信号通路等信号通路富集程度显著(图5A)。表达上调基因主要富集在移植排斥反应、移植物抗宿主病、1型糖尿病等信号通路(图5B)。表达下调基因主要与NF-κB信号通路、金葡菌感染和萜类化合物生物合成重要组分等信号通路相关(图5C)。
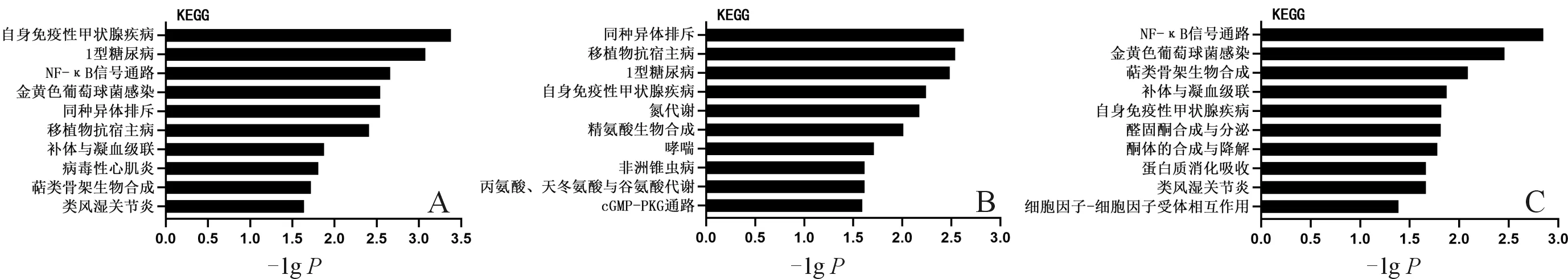
A:总体差异表达基因;B:表达上调基因;C:表达下调基因
3 讨论
近年来,针对EGFR突变的靶向治疗因在临床应用中取得显著成效而备受关注。然而,中国人群胃癌中EGFR罕见突变致其应用受阻,需要重新思考和探索EGFR的生物学功能及应用价值[7]。EGFR基因在胃癌中呈过度表达且与预后相关,体现了其潜在应用价值[8]。研究[9]表明,靶向抑制EGFR表达,而非其激酶活性,可诱导肿瘤细胞死亡,为EGFR阳性表达肿瘤的个体化治疗提供了新的途径。而且,在卵巢癌小鼠模型中,通过纳米水凝胶递送系统靶向EGFR siRNA治疗与EGFR水平升高相关的卵巢癌被证实是一种有效策略[10]。近年来siRNA药物陆续被批准上市,这为实现EGFR siRNA靶向治疗胃癌提供了可能。作者委托汉恒生物科技(上海)有限公司构建了低表达EGFR的AGS细胞株,通过集落形成实验测定集落形成能力,通过CCK-8法检测化疗敏感性的变化。并运用基因芯片分析比较了EGFR表达抑制前后胃癌细胞中基因表达谱的变化,发现了1 204个存在差异表达的基因(包括mRNA、lncRNA和circRNA),这表明EGFR基因在胃癌细胞生长调控中具有重要作用,机制可能较为复杂。
差异表达mRNA分析结果显示,EGFR表达抑制后IFI27、FAM129C、CLU、TRABD2B均出现不同程度的上调,PLXNA2、RALGPS1、SHROOM2、HKDC1均出现不同程度的下调。干扰素α诱导蛋白27(interferon alpha inducible protein 27,IFI27)是一种α干扰素诱导蛋白,又名干扰素-刺激基因12a蛋白(interferon-stimulated gene 12a protein,ISG12A),其在1型干扰素诱导的细胞凋亡中起着重要作用[11],其高表达可降低乳腺癌细胞增殖、迁移能力[12]。FAM129C基因,又名BCNP1,是一种B细胞特异性的浆膜蛋白,其功能尚不清楚。有研究表明,与野生型脾B细胞相比,BCNP1缺陷型脾B细胞表现出更强的存活、增殖能力[13];在WEHI231未成熟B细胞中BCNP1过度表达增强了α-IgM诱导的凋亡,而在BCNP1缺陷的WEHI231细胞出现凋亡减少[14]。簇集蛋白(Clusterin,CLU)是一种广泛表达的糖蛋白,它具有促凋亡和抗凋亡的双重功能,可能与其不同亚型有关。研究表明,CLU转染可促进结肠癌细胞本身和化疗诱导的凋亡,反义CLU则抑制细胞凋亡[15];在神经母细胞瘤小鼠模型中研究表明CLU是一个肿瘤和转移抑制基因[16]。含2B的TraB结构域(TraB domain containing 2B,TRABD2B)基因,又名TIKI2,也被报道在骨肉瘤组织和细胞中呈低表达,具有抑制骨肉瘤生长作用[17 ]。
在EGFR表达抑制后下调的基因中,PLXNA2是丛蛋白家族成员,是信号素配体的跨膜受体,在前列腺癌中呈高表达,PLXNA2上调促进前列腺癌细胞迁移和侵袭能力[18-19]。RALGPS1是一种鸟嘌呤核苷酸交换因子,又名RalGEF2,在体内和体外均能激活Ral(一种广泛表达的Ras),可能与Ras信号通路激活有关[20]。SHROOM2是RhoA-ROCK通路中调节细胞运动和肌动蛋白骨架组织的关键介质,有研究[21]报道SHROOM2在鼻咽癌中表达下调,具有抑制细胞EMT和转移的作用。本研究显示的EGFR表达抑制下调SHROOM2基因表达,其作用和意义还不清楚。己糖激酶结构域成分1(Hexokinase domain component 1,HKDC1) 基因在多种肿瘤中表现为癌基因特性,可促进肺腺癌细胞的增殖、迁移和侵袭[22]。
在对差异表达基因进行信号通路预测分析中发现NF-κB信号通路相关基因存在显著性富集,尤其是在表达下调的差异基因中,这说明EGFR表达抑制可能通过NF-κB信号通路发挥抑制胃癌细胞增殖的生物学效应。研究表明,EGFR和NF-κB是癌症发生中的分子伴侣,共同为癌细胞提供致癌信号,维持细胞增殖、存活和侵袭性[23];两者也共同参与了胃癌细胞增殖、转移[24]。CLU过度表达可抑制肿瘤细胞中NF-κB信号的激活,相反,CLU抑制促进NF-κB信号的激活[25-26]。本研究发现,EGFR抑制促进了CLU表达,抑制了NF-κB信号机制,降低了胃癌细胞增殖能力,这与上述文献报道相一致。
综上所述,抑制EGFR表达可有效抑制胃癌细胞活力,增加胃癌细胞对化疗药物的敏感性,并可影响细胞内基因组表达,其差异表达基因的变化与文献报道相一致。这表明干扰EGFR表达用于抗胃癌细胞生长具有分子理论基础,可能是一种有效的个体化抗胃癌治疗的新途径,值得进一步深入开展应用研究。

