BiOCl/NH2-UiO-66(Zr)异质结的构建 及其对罗丹明B的光催化降解
孙垒垒,缪圣超,郑小妮,查振兴,杨 静,崔世海
(1.南京师范大学化学与材料科学学院,江苏省生物医用功能材料协同创新中心, 江苏省生物医用材料重点实验室,江苏 南京 210023) (2.江苏无锡中天固废处置有限公司,江苏 无锡 214000) (3.南大环境规划设计研究院(江苏)有限公司,江苏 南京 210003)
环境污染是人类社会发展过程中面临的重要问题,其中生活污水、农业废水和工业废水中所含有的有机污染物,例如农药、染料和抗生素等对人类的健康构成了极大威胁[1-2]. 目前,光催化降解技术可通过相应的催化材料在光照条件下实现污染物的降解,该方法具有高效、无污染且可再生的特点,且因其能源充足、价格低廉等优点而备受关注. 作为一种常见的光催化剂,BiOCl由[Bi2O2]2+与双层的Cl-相互交错而成[3-4],其较高密度的[001]晶面使其光催化活性甚至优于TiO2等材料. 然而,BiOCl的禁带宽度约为 3.60 eV,难以在可见光辐射条件下激发. 本文选取罗丹明B(RhB)染料为目标污染物,采用溶剂热法将金属-有机框架化合物(Metal-organic Frameworks,MOFs)NH2-UiO-66(Zr)与BiOCl复合,利用MOFs材料表面积、孔隙率、光化学稳定性及光响应范围等结构性质优势,制备BiOCl/NH2-UiO-66(Zr)复合光催化材料以提高其光催化性能,并通过电化学性能测试及自由基捕获实验等揭示光催化反应体系的作用机理.
1 实验方法
1.1 主要试剂及仪器
氯化钾(KCl),国药集团化学试剂有限公司;N-N二甲基甲酰胺(DMF),国药集团化学试剂有限公司;聚乙烯吡络烷酮(PVP,K30),国药集团化学试剂有限公司;乙二醇,国药集团化学试剂有限公司;五水合硝酸铋(Bi(NO3)3·5H2O),国药集团化学试剂有限公司;二氨基对苯二甲酸(2-NH2-BDC),麦克林试剂有限公司;氯化锆(ZrCl4),阿拉丁试剂有限公司. 以上药品均为分析纯.
XPA-6型光催化仪,南京胥江仪器厂;Varian Cary 50紫外可见光谱仪,美国瓦里安公司;XRD-6000型X射线粉末衍射仪,日本岛津公司;Hitachi-S4800扫描电子显微镜,日本株式会社日立制作所;JEOL-2010型透射电子显微镜,日本JEOL公司;Varian Cary 5000紫外漫反射光谱仪,美国瓦里安公司;CHI-660E电化学工作站,上海辰华仪器有限公司;ESR电子自旋共振仪,EMX-10/12光谱仪,德国布鲁克公司.
1.2 实验步骤
1.2.1 UiO-66(Zr)-NH2材料的合成
UiO-66(Zr)-NH2材料的合成基于文献[5-6]报道并略作改进. 在高压釜中依次加入45 mL DMF、1 mmol 氯化锆及0.181 g 2-NH2-BDC,搅拌均匀后在413 K下反应24 h后自然冷却至室温,用甲醇清洗并经离心分离、真空干燥即可制备淡黄色UiO-66(Zr)-NH2粉末.
1.2.2 复合材料BiOCl/UiO-66(Zr)-NH2的合成
在高压反应釜中依次加入0.026 g UiO-66(Zr)-NH2、45 mL乙二醇、0.486 g Bi(NO3)3·5H2O和0.1 g PVP-K30、5 mL 0.2 mol/L KCl溶液,于433 K下反应12 h后冷却至室温,所得产物用蒸馏水和无水乙醇交替洗涤3次以制备BiOCl/UiO-66(Zr)-NH2复合材料,简写为BUN-1. 通过调节BiOCl与UiO-66(Zr)-NH2的质量比分别为1∶0.05,1∶0.1,1∶0.2,1∶0.3,1∶0.4,可制得系列质量比的复合材料,并依次记为BUN-0.5,BUN-1,BUN-2,BUN-3,BUN-4.
1.3 光催化降解实验
在玻璃石英管中分别加入20 mg/L RhB溶液40 mL及一定量的复合光催化剂材料,避光条件下达到吸附-解吸动态平衡后,加入适量的过硫酸钾(PS)并在可见光照射下进行光催化降解实验. 其中,光催化降解实验在XPA-7型光化学反应仪中进行,实验光源采用功率为350 W的氙气灯,并用滤光片控制发射光的波长λ≥415 nm. RhB浓度通过紫外-可见光谱法测定并按式(1)计算目标物的降解率:
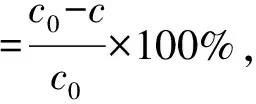
(1)
式中,c0为RhB溶液的初始浓度(mg/L);c为某一时刻RhB溶液的瞬时浓度(mg/L).
1.4 电化学性能测试
电化学测试在CHI-660E电化学工作站中进行,辅助电极为Pt电极,参比电极是Ag/AgCl,工作电极由以下方法制得,将30 mg材料分散在乙醇中并滴入3滴萘酚(0.5 wt%),超声60 min后,将其均匀涂抹在FTO导电玻璃上,自然干燥后备用. 光电流响应、莫特-肖特基曲线和电化学阻抗测试均在350 W氙灯辐照下进行.
2 结果与讨论
2.1 XRD分析
图1为所制备系列材料的XRD图,其中图1g显示所合成的UiO-66(Zr)-NH2图谱与文献报道的一致[7];图1f表明BiOCl在11.8°、25.8°、33.4°、41.0°、46.6°、49.8°、54.1°和58.6°处的特征衍射峰分别对应于(001)、(101)、(100)、(112)、(200)、(113)、(211)和(212)晶面[8],特征吸收峰的形状尖锐,说明实验室制备的BiOCl具有良好的结晶度;另外,不同质量比的系列BUN纳米复合材料的XRD图(图1a~e)均出现上述两种材料的特征衍射峰. 由于UiO-66(Zr)-NH2在复合材料BUN中的质量分数相对较小,其衍射峰强度亦相对较弱.
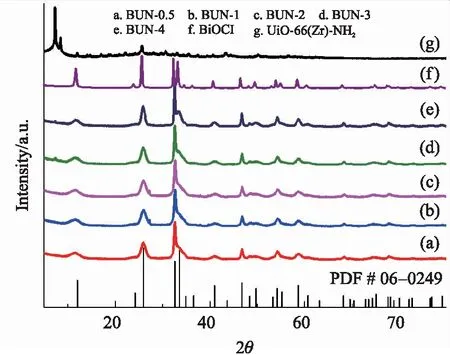
图1 BUN-(0.5,1,2,3,4)(a~e),BiOCl(f)和 UiO-66(Zr)-NH2(g)的X射线衍射图Fig.1 XRD patterns of BUN-(0.5,1,2,3,4)(a~e), BiOCl(f)and UiO-66(Zr)-NH2(g)
2.2 形貌分析
图2A和图2D显示,BiOCl为典型的纳米片状结构,其片层长度大约在50 nm~150 nm之间,厚度约为8 nm. 从图2B和图E中可以看出,UiO-66(Zr)-NH2具有八面体形态,平均粒径小于200 nm,这与UiO-66(Zr)的结构大致相同. 图2C和图2F显示BUN-1呈类花状结构,当两种材料复合后,复合材料仍保留了MOFs的基本结构,且其尺寸增加到2.5 μm. 同时可清楚地观察到层状结构的BiOCl较为密集地分布在UiO-66(Zr)-NH2表面,表明了BiOCl与MOFs材料的成功复合.

图2 BiOCl、UiO-66(Zr)-NH2、BUN-1的TEM图(A-C)和SEM图(D-F)Fig.2 TEM images(A-C)of BiOCl,UiO-66(Zr)-NH2 and BUN-1. SEM images(D-F)of BiOCl,UiO-66(Zr)-NH2 and BUN-1
2.3 UV-vis DRS分析
由图3A可知BiOCl的吸光边缘在384 nm左右,表明其在可见光范围内难以被激发;UiO-66(Zr)-NH2的吸光范围则在467 nm左右;复合材料吸收边缘位于600~660 nm,相较于单一材料,BUN-1对可见光有较好的吸收,表明复合材料中BiOCl与UiO-66(Zr)-NH2形成的异质结结构增强了其光学性能. 根据图3B与式(2)得到BiOCl与UiO-66(Zr)-NH2的带隙能量分别为2.68 eV和3.28 eV.
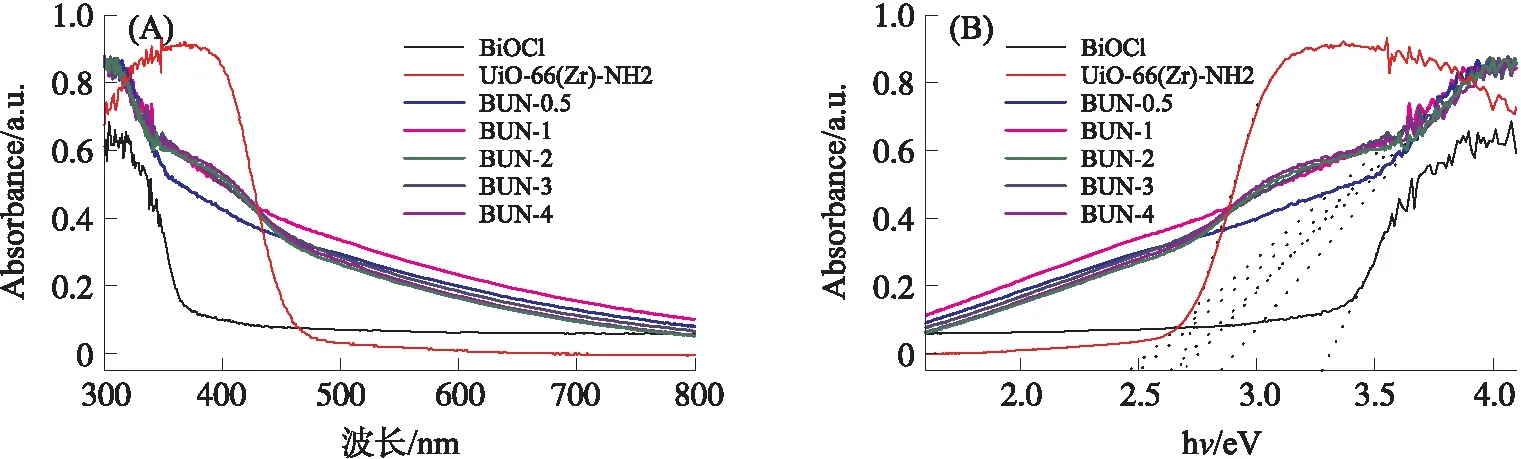
图3 制备材料的紫外-可见漫反射光谱(A)及其带隙能谱图(B)Fig.3 UV-vis DRS spectra(A)and optical bandgap energy(B)of materials
αhν=A(hυ-Eg)n/2,
(2)
式中,α、h、ν、Eg和A分别代表吸光系数、普朗克常数、光的频率、带隙能量和常数.n为材料的光学跃迁系数(n=1为直接跃迁,n=4为间接跃迁).
2.4 光催化活性及电化学性能测试
2.4.1 光催化活性测试
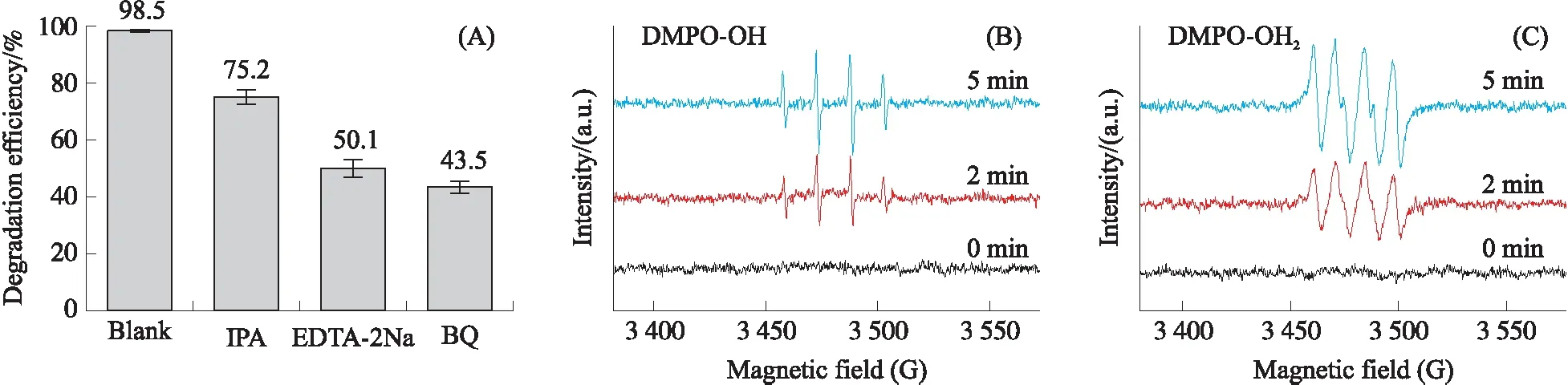
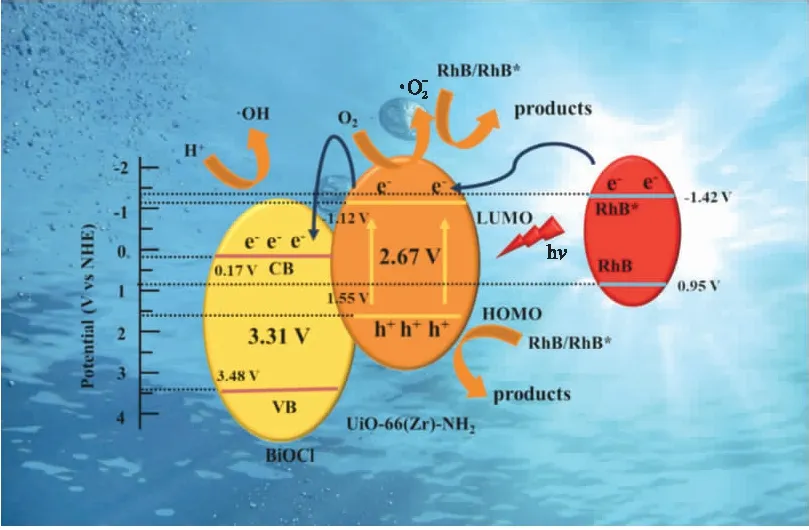
从图4A中可以看出在氙灯模拟可见光照射下,20 min内UiO-66(Zr)-NH2对RhB降解率仅为 26.7%,BiOCl纳米片具有较高的催化活性,其对RhB的降解率达到73.3%. 当UiO-66(Zr)-NH2与BiOCl进行复合后,对RhB的降解效果有了显著提高. 所制备的复合材料降解效率均大于两种单一材料,在不同质量比的样品中,BUN-1光催化活性最佳,对RhB的降解率高达98.5%. 表明合成的复合材料相较于单一的材料具有一定的优越性,这可能是由于UiO-66(Zr)-NH2的引入降低了材料中电子与空穴的分离率,提升了电子传输效率. 由图4B可知,各样品对RhB的降解反应速率遵循一阶反应动力学方程,其中不同比例复合样品的一阶反应速率常数k值大小变化为BUN-4 2.4.2 电化学性能测试 如图5A所示为三种材料的光电流响应图,其中复合材料BUN-1相较于BiOCl和UiO-66(Zr)-NH2具有更强的光电流,表明其具有优良的电荷传输能力. 图5B显示的是复合材料与单一材料的奈奎斯特阻抗图. 材料的奈奎斯特半径越大,表明其所受的阻抗也就越大,从图中可以看出,BUN-1具有最小的奈奎斯特半径,表明其电荷转移电阻最低,这也意味着该样品具有最佳的电子传导性能及载流子传输效率. 图5 材料的光电流响应(A)及电化学阻抗测试(B)Fig.5 Cyclical on/off photocurrent response(A)and the electrochemical impedance spectra(B)BiOCl,UiO-66(Zr)-NH2 and BUN-1 图6A显示了4次光催化循环后材料对RhB的降解情况. 随着循环次数的增加,BUN-1对RhB的降解率从98.5%下降到83.2%. 其可能的原因是,在光催化过程中,由于材料对RhB的降解不完全,有少部分的RhB以及其降解过程中产生的中间体产物附着在材料的表面及孔道上,从而导致降解效率的下降. 由图6B所示,材料循环4次后,其XRD中各衍射峰相较于未反应的材料而言没有发生明显的变化,表明BUN-1材料的晶体结构在反应中并没有遭到破坏,进一步证实了BUN-1结构稳定且循环使用性能良好. 图6 BUN-1材料四次循环的降解图(A)和循环前后X射线衍射图对比图(B)Fig.6 Reusability of BUN-1 for the photocatalytic degradation of RhB(A)and XRD pattern of BUN-1 before and after photodegradation(B) 2.6.1 自由基捕获实验 活性自由基的存在是光催化材料能够光降解一系列污染物的主要条件. 为了探究活性物质对BUN-1去除RhB的光催化机理,进行了掩蔽剂实验以及电子自旋共振(ESR)测试. 图7 不同掩蔽剂的添加对光催化降解罗丹明B的影响(A)、一定时间内可见光照射下的羟基自由基信号(B)和超氧自由基信号(C)Fig.7 The effects of different scavengers on RhB degradation(A),ESR signals during photocatalysis for 2.6.2 机理探讨 半导体材料的光催化性能与电子-空穴对的传输机制密切相关. 根据BUN-1的能带结构进一步讨论了可能的光催化机理. BiOCl的VB和CB电位通过式(3)和(4)计算. EVB=X-Ec+0.5Eg, (3) ECB=EVB-Eg, (4) 式中,X是材料的绝对电负性,Ec是氢标度上的自由电子能量(约4.50 V vs. NHE). BiOCl的X值为6.33[9]. 根据以上公式,计算得到BiOCl的VB和CB位置分别为3.48 V和0.17 V vs. NHE. 决定MOFs带隙的主要因素是最高占据分子轨道(HUMO)和连接分子的最低未占分子轨道(LUMO). UiO-66(Zr)-NH2的平带电位由三条曲线所做切线的交点得到,其电位约为-1.22 V vs. Ag/AgCl(图8). 计算得到UiO-66(Zr)-NH2的LUMO电位为-1.12 V vs. NHE. 通过图3B的DRS分析得到UiO-66(Zr)-NH2的禁带宽度为2.67 V vs. NHE. 由式(4)可得出其HUMO能量为1.55 V vs. NHE. 图8 0.5 mol/L硫酸钠溶液中UiO-66(Zr)-NH2 的莫特-肖特基电势图Fig.8 Mott-Schottky plots of UiO-66(Zr)-NH2 in 0.5 mol/L Na2SO4 aqueous solution 图9 BUN-1复合材料光降解RhB的机理图Fig.9 The mechanism illustration for the photocatalytic process by BUN-1 BUN-1+hv→BUN-1(h++e-), ·HO2+H+→H2O2, H2O2+e-→·OH+OH+,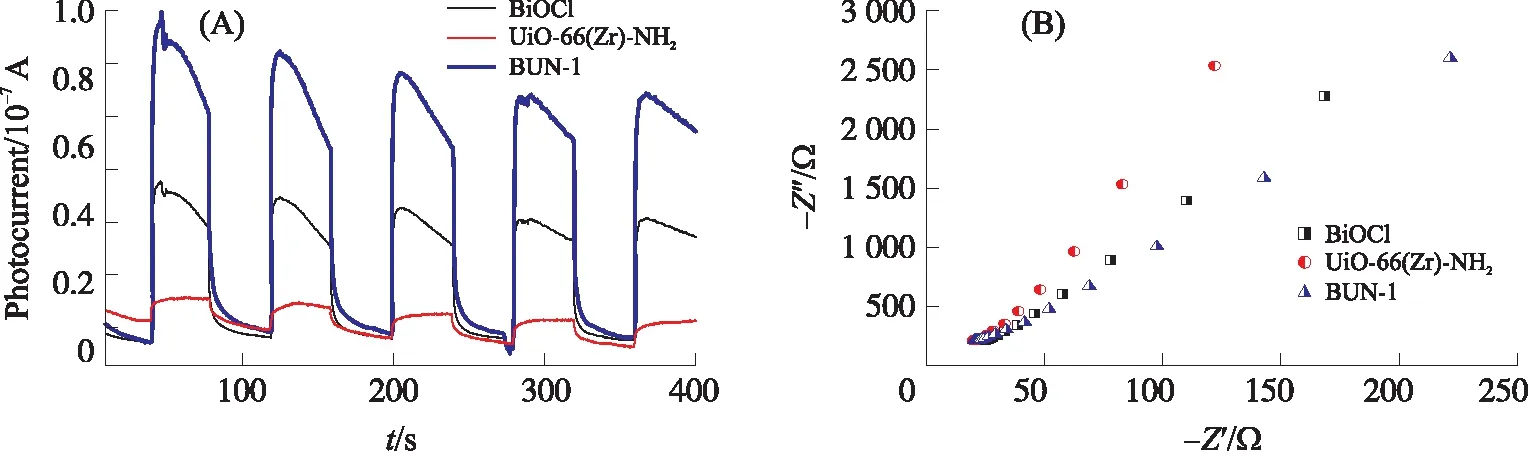
2.5 材料重复使用性

2.6 机理的初步探讨
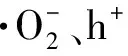
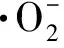

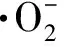
3 结论