外周血Treg 细胞、Th17细胞在成人原发性免疫性血小板减少症中的变化及意义
汪嘉佳,李哲,江继发,程玮,金凤祥
铜陵市人民医院血液内科,安徽铜陵 244000
原发性免疫血小板减少症(ITP)是临床中常见的获得性自身免疫系统综合征,患者主要表现为皮肤黏膜出血症状,部分可表现为消化道的出血和损伤,严重者可发生颅内出血,对患者的身心健康造成严重的危害[1-2]。目前认为ITP的发病机制是机体抗血小板抗体产生后,血小板在单核吞噬细胞系统破坏中形成介导作用,从而导致患者体液免疫出现异常,最终导致血小板逐渐减少[3-4]。Treg 细胞与Th17细胞同属于T 细胞亚群,具有低反应性与免疫抑制性的特殊免疫调节功能,对自身反应性T 细胞的免疫反应和T 细胞的活化可产生抑制作用,同时还可促进某些抑制性细胞因子的分泌,在外周免疫耐受的维持中发挥重要作用[5-7]。研究发现,Treg/Th17失衡与多种免疫性疾病的发生、发展密切相关[8-9]。为此,本研究以成人原发性ITP 患者为研究对象,探讨外周血Treg 细胞、Th17 细胞百分比及Treg/Th17变化的临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选取2018年1月—2021年1月我院收治的80例成人原发性ITP 患者为研究对象(病例组),其中男37例,女43例;年龄18~65(44. 27 ±11. 35)岁。入组标准:符合中华医学会血液学分会血栓与止血学组制定的《成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)》[10]中成人原发性ITP 诊断标准;年龄18~65 岁,性别不限;首次发病,入组前未接受相关治疗;临床资料完整。排除标准:合并其他免疫疾病;合并恶性肿瘤;重要脏器功能不全;合并糖尿病、结核病、急性细菌性或病毒性感染;存在糖皮质激素治疗方案禁忌证;哺乳期、妊娠期妇女。另选取同期入院体检的80例健康者作为对照组,其中男35例,女45例;年龄18~63(45. 08 ± 12. 39)岁,血小板计数(120~280)×109/L,排除标准同病例组。两组性别、年龄比较差异均无统计学意义。本研究经医院伦理委员会批准,患者自愿参加试验并签署知情同意书。
1.2 治疗及疗效评估 病例组接受一线的糖皮质激素治疗方案,口服醋酸泼尼松片(国药准字H33021217,浙江仙琚制药股份有有限公司)治疗,服用剂量1 mg/(kg·d),连续服用4周后评估治疗效果。按照《成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)》[8]标准:完全反应,患者经过4周治疗,血小板计数≥100×109/L,且出血症状完全消失;有效,患者经过4周治疗,血小板计数≥30×109/L,且与治疗前相比增加2倍及以上,出血症状消失;无效,患者经过4 周治疗,血小板计数<30×109/L,或与治疗前相比增加不足2倍,或仍存在出血情况。血小板计数采用五分类全自动血细胞分析仪(型号URIT-5200,厦门海菲生物技术股份有限公司)测定。
1.3 外周血Treg、Th17 细胞检测 于清晨空腹状态下,分别取对照组外周血、病例组治疗前及治疗4周后外周血2 mL。Treg 细胞检测方法:取1mL 外周血置于流式试管内,加入肝素钠抗凝处理,避光条件下孵育20 min;加入溶血素1 mL 溶血,避光静置5 min,采用2 mL PBS 洗涤细胞2次,置于流式细胞仪(型号ZE5,美国伯乐)上测定Treg 细胞百分比。Th17 细胞检测方法:取上述培养后的细胞悬液600 μL,采用离心机于2 000 r/min转速下离心2 min(离心半径为10 cm),弃上清,向沉淀细胞内加入10 μL CD4-FITC 单抗(美国Abcam),避光条件下常温孵育15 min;采用PBS洗涤进行洗涤,加入100 μL固定液,避光条件下常温孵育15 min后,采用PBS二次洗涤、离心,弃上清,向沉淀细胞内加入100 μL 破膜剂,轻柔混匀后避光条件下孵育5 min,加入10 μL Alexa Fluor647IL-17 抗体(美国Abcam),充分混匀后于避光条件下孵育15 min;采用PBS 第三次洗涤细胞,离心,弃上清,将沉淀细胞置于流式细胞仪(型号ZE5,美国伯乐)上测定Th17 细胞百分比,计算Treg/Th17。
1.4 统计学方法 采用SPSS23. 0 统计软件。计量资料符合正态分布以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,同组治疗前后比较采用配对样本t检验。采用受试者工作特征(ROC)曲线分析外周血Treg、Th17 细胞百分比及Treg/Th17 对成人ITP 的诊断效能。P<0. 05 为差异有统计学意义。
2 结果
2.1 病例组与对照组外周血Treg、Th17 细胞百分比及Treg/Th17 比较 与对照组相比,病例组外周血Treg 细胞百分比降低,Th17 细胞百分比升高,Treg/Th17降低(P均<0. 05),见表1。
表1 病例组与对照组外周血Treg、Th17细胞百分比及Treg/Th17比较(± s)
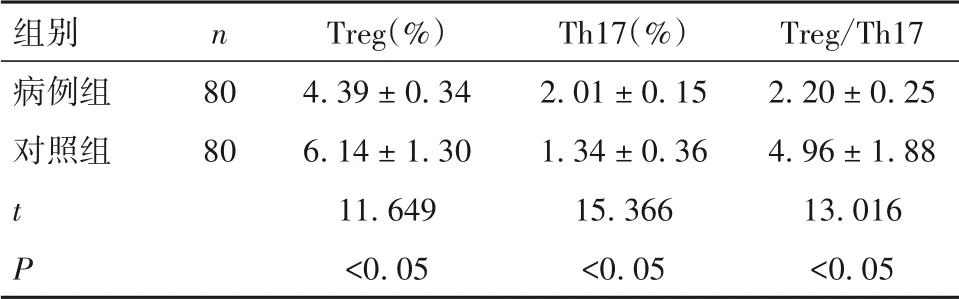
表1 病例组与对照组外周血Treg、Th17细胞百分比及Treg/Th17比较(± s)
组别病例组对照组t P n 80 80 Treg(%)4. 39 ± 0. 34 6. 14 ± 1. 30 11. 649<0. 05 Th17(%)2. 01 ± 0. 15 1. 34 ± 0. 36 15. 366<0. 05 Treg/Th17 2. 20 ± 0. 25 4. 96 ± 1. 88 13. 016<0. 05
2.2 病例组患者治疗前后外周血Treg、Th17 细胞百分比及Treg/Th17 比较 与治疗前相比,病例组治疗后外周血Treg 细胞百分比高,Th17 细胞百分比低,Treg/Th17高(P均<0. 05),见表2。
表2 病例组治疗前后外周血Treg、Th17细胞百分比及Treg/Th17比较(± s)

表2 病例组治疗前后外周血Treg、Th17细胞百分比及Treg/Th17比较(± s)
观察时间治疗前治疗后t P n 80 80 Treg(%)4. 39 ± 0. 34 5. 48 ± 0. 54 15. 278<0. 05 Th17(%)2. 01 ± 0. 15 1. 62 ± 0. 14 17. 001<0. 05 Treg/Th17 2. 20 ± 0. 25 3. 40 ± 0. 48 19. 832<0. 05
2.3 病例组治疗后不同疗效患者外周血Treg、Th17细胞百分比及Treg/Th17比较 见表3。
表3 病例组治疗后不同疗效患者外周血Treg、Th17细胞百分比及Treg/Th17比较(± s)
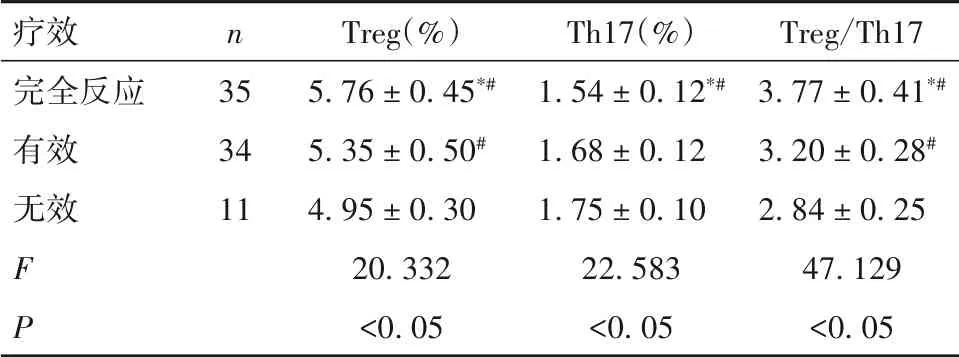
表3 病例组治疗后不同疗效患者外周血Treg、Th17细胞百分比及Treg/Th17比较(± s)
注:与有效相比,*P<0. 05;与无效相比,#P<0. 05。
疗效完全反应有效无效FP n 35 34 11 Treg(%)5. 76 ± 0. 45*#5. 35 ± 0. 50#4. 95 ± 0. 30 20. 332<0. 05 Th17(%)1. 54 ± 0. 12*#1. 68 ± 0. 12 1. 75 ± 0. 10 22. 583<0. 05 Treg/Th17 3. 77 ± 0. 41*#3. 20 ± 0. 28#2. 84 ± 0. 25 47. 129<0. 05
2.4 外周血Treg、Th17 细胞百分比及Treg/Th17 对ITP 的诊断效能 当外周血Treg 细胞百分比取4. 740% 时,诊断ITP 的ROC 曲线下面积(AUC)为0. 804,灵敏度为76. 3%,特异度为77. 5%;当Th17细胞百分比取1. 775%时,诊断ITP的AUC为0. 872,灵敏度为87. 5%,特异度为78. 7%;当Treg/Th17 取2. 585 时,诊 断ITP 的AUC为0. 901,灵 敏 度 为91. 3%,特异度为80. 0%;三者对ITP 均具有较高的诊断效能,其中Treg/Th17更优,见表4。
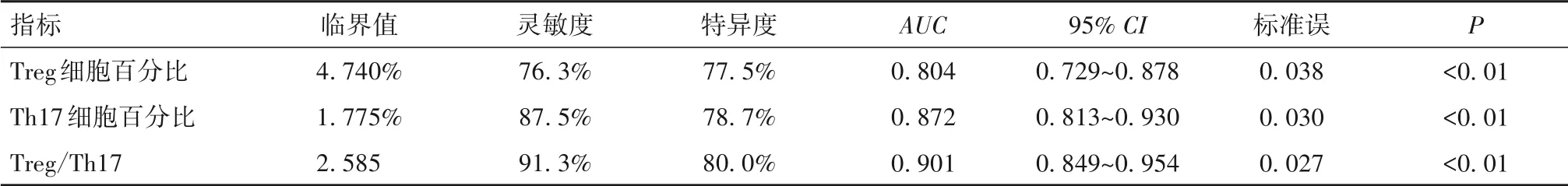
表4 外周血Treg、Th17细胞百分比及Treg/Th17对ITP的诊断效能
3 讨论
ITP 可发生于各年龄段群体,其中男女发病率无明显差异,但育龄期女性略高于同年龄组男性,不同个体该病的临床表现存在较大差异[11]。已有研究指出,T淋巴细胞亚群在ITP免疫应答的诱导中起着关键作用,产生诱导后引起的T淋巴细胞活化可导致正常免疫细胞发生损伤[12]。Treg细胞来源于胸腺的天然性细胞,对病原Th1 和Th17 的细胞增殖有着显著的抑制作用,可通过对外周免疫耐受的维持来避免其自身免疫及组织的损伤[13]。Th17细胞作为新的CD4+T 细胞亚型,其分泌的IL-17 可作为前炎性细胞因子作用于中性粒细胞,促使多种细胞释放炎性因子,在自身免疫性疾病以及集体防御反应中具有关键作用[14]。研究表明,Treg 细胞在分化及功能上与Th17细胞相互拮抗,Th17/Treg细胞平衡对维持正常免疫应答及防止自身免疫病具有重要意义[15]。
在本研究中,相较于对照组,病例组外周血Treg细胞百分比降低、Th17 细胞百分比升高、Treg/Th17降低,提示由于成人原发性ITP 患者存在Treg/Th17失衡现象,可用于成人原发性ITP 的辅助诊断。分析其作用机制可能如下:Treg 细胞能够控制机体自身免疫反应,并且可抑制抗原特异性T 细胞的免疫反应,当Treg 细胞百分比下降后,机体免疫抑制功能受到抑制,导致T 细胞的异常激活、耐受水平降低;而Th17 细胞百分比上升后,其分泌的促炎因子IL-17 水平随之上升,炎症效应因子水平增加,促炎作用增加,并可能通过与其他细胞因子相互作用,导致细胞浸润及组织损伤,参与自身免疫过程,二者比值失衡后,机体免疫防御功能及稳定维护作用受损,可能通过破坏单核吞噬细胞系统引起血小板减少,最终参与成人原发性ITP 的发病过程[16-17]。徐丹等[18]以86例妊娠期ITP 患者为研究对象,通过流式细胞术检测发现其存在Th17/Treg 失衡状态;HUA等[19]发现,原发性ITP 患者存在Th17/Treg 失衡,并推测其可能与CD4+细胞内microRNA 的异常表达相关。疗效方面,与治疗前相比,患者治疗后外周血Treg 细胞百分比升高、Th17 细胞百分比降低、Treg/Th17 升高,随着疗效的增加此种改善趋势更佳明显,且完全反应、有效、无效间外周血Treg、Th17、Treg/Th17 存在差异,提示此方案可能通过改善Treg/Th17失衡状态,发挥治疗效果。分析其作用机制如下:ITP 发病与免疫功能受损、炎症反应相关,而醋酸泼尼松作为糖皮质激素类药物,一方面可有效抑制细胞介导的免疫反应,降低T 淋巴细胞水平并抑制其向淋巴母细胞转化,改善免疫失衡状态;另一方面,醋酸泼尼松可抑制包括Th17 分泌的IL-17在内的炎性因子水平、减轻炎症反应,最终发挥对ITP 的治疗作用,而疗效越好的患者此种改善越明显[20-21]。王颖超等[22]以ITP患儿为研究对象,得出了与本研究一致的结论,并推测Treg/Th17 测定可用于ITP患者疗效的预测。
本研究中外周血Treg、Th17细胞百分比及Treg/Th17 对ITP 均具有较高的诊断效能,三者的特异度基本相同,Treg/Th17的敏感度最高,诊断效能更优,这说明联合检测Treg/Th17 对提高实验室诊断ITP具有一定的帮助,在鉴别诊断中具有一定价值。
综上所述,成人原发性ITP 患者外周血Treg 细胞百分比降低、Th17 细胞百分比升高、Treg/Th17 降低,且其水平变化与患者治疗效果有关,可用于疾病的辅助诊断及疗效辅助评估。

