苜蓿银纹夜蛾核型多角体病毒在宿主草地贪夜蛾选择压力下的毒力和基因变异
靳雯怡,佟 岩,孟 茜,陈新中,方分分,秦启联,张继红,舒锐豪,张 寰*
(1.河北大学生命科学学院,河北保定 071002;2.中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室,北京 100101;3.河南济源白云实业有限公司,河南济源 454652)
草地贪夜蛾Spodopterafrugiperda是联合国粮农组织(FAO)发布警告的世界性农业害虫,主要取食危害玉米、小麦等204种植物(https://www.cabi.org/ISC/datasheet/29810),是一种繁殖力极强、危害巨大的害虫。自2019年入侵我国后,快速入侵大部分省区,并在南部省区定殖,可能成为常发和暴发性兼具的农业害虫(崔志斌等, 2020)。由于草地贪夜蛾在原产地美洲已经对多种化学农药产生很高的抗药性,加之新近入侵,我国缺乏生物和生态的自然控制因子,其危害潜力巨大,对我国农业生产可能造成极大的破坏。通过二代测序和相关抗性基因扫描检测,发现入侵我国的草地贪夜蛾种群对有机磷类、有机氯类和拟除虫菊酯类等传统农药具有较高的抗性基因变异频率(崔志斌等, 2020)。而生物农药包括核型多角体病毒Nucleopolyhedrovirus(NPV)等绿色防控措施,不仅安全有效,且能够显著减缓草地贪夜蛾抗药性的产生。
核型多角体病毒(NPVs)是杆状病毒Baculovirus中发现较早、应用最广泛的昆虫病毒,主要用于防治鳞翅目害虫。世界上已有数十种杆状病毒成功用于防治农林害虫。我国已登记注册的病毒杀虫剂有10余种,应用最广泛的有棉铃虫核型多角体病毒(Helicoverpaarmigeranucleopoly-hedrovirus,HearNPV)、甜菜夜蛾核型多角体病毒(Spodopteraexiguamultiplenucleopolyhedrovirus,SeMNPV)、斜纹夜蛾核型多角体病毒(Spodopteralituranucleopolyhedrovirus,SpltNPV)等。
苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicamultiplenucleopolyhedrovirus,AcMNPV)是一种宿主范围较广的α-杆状病毒,可感染10科33种鳞翅目幼虫(王成燕, 2012)。研究表明,草地贪夜蛾幼虫对AcMNPV口服感染有较强的抗性(Haas-Stapletonetal., 2005),但草地贪夜蛾细胞系Sf 21及其克隆株Sf 9对AcMNPV出芽型病毒(Budded virus,BV)非常敏感。究其原因可能是AcMNPV的包涵体缺乏与草地贪夜蛾中肠柱状细胞特异性结合或融合的能力。野生型AcMNPV存在显著的基因型变异(Lee and Miller, 1978; Smith and Summers, 1978),此外,AcMNPV的基因型变异可能在包括毒力在内的表型特征上产生差异(KolodnyHirsch and VanBeek, 1997)。
选择毒力增强的变异体是提高杆状病毒毒力,并应用于生物农药的新方向。连续传代可以从一个异质性的野生型种群中挑选出更强毒力的同质分离株(Kolodny-Hirschetal., 1997)。已有在同源或异源宿主连续传代后筛选得到毒力增强病毒的报道(Kolodny-Hirschetal., 1997)。如果要将AcMNPV开发成商品用于防治草地贪夜蛾,那么必须对其进行毒株筛选和优化,提高AcMNPV对草地贪夜蛾的口服感染能力,使其毒力达到实际应用的水平。毒力和传播力之间博弈一直都是病毒进化的重要驱动因子。从害虫防控的角度来看,对病毒生物农药毒力的要求应高于对其传播力和产量的要求;反过来,从病毒生物农药生产的角度,还要考虑病毒接种量和产量等因素。本研究报道了在宿主草地贪夜蛾中连续压力筛选前后AcMNPV的生物学活性和基因发生的变化。
1 材料与方法
1.1 实验昆虫、细胞和病毒来源
甜菜夜蛾Spodopteraexigua、棉铃虫Helicoverpaarmigera、草地贪夜蛾云南种群,购买自河南济源白云实业有限公司,后在室内25℃±1℃条件下使用人工饲料饲养。
Sf 9细胞系在27℃±1℃条件下使用含有10%胎牛血清的Insect-XPRESSTM昆虫细胞培养液加入双抗(青霉素和链霉素)培养。
AcMNPV野生毒株由本实验室保藏。
1.2 AcMNPV毒株在草地贪夜蛾中连续传代
将用粉纹夜蛾Trichoplusisni幼虫扩增的AcMNPV,经甜菜夜蛾、棉铃虫交替感染扩增后,再次感染甜菜夜蛾,收取BVs接种Sf 9细胞,收获的多角体命名为P0;挑取空斑单克隆,将此BVs注射入草地贪夜蛾3龄幼虫,获得死亡幼虫,命名为P1;提取OBs,继续接种草地贪夜蛾,收获最早死亡的虫尸,连续接种收获20代,分别命名为P2~P20。连续传代采用50%致死浓度(LC50)接种。
1.3 病毒DNA的提取
取适量差速离心法纯化后的多角体,加入350 μL碱裂解液后混合均匀,37℃裂解30 min。然后加入约350 μL HCl(0.1 mol/L),调节溶液pH至7.0。加入10 μL蛋白酶K(20 mg/mL)和40 μL SDS(10%),混匀后置入65℃水浴中保持2 h后,分别使用适量Tris饱和苯酚,等量的饱和苯酚∶氯仿(1∶1)混合液,等量的氯仿∶异戊醇(24∶1)混合液,各提取一次,取出上层水相加入2倍体积无水乙醇混匀获得DNA沉淀,再用70%乙醇洗涤沉淀,后在室温下干燥;加入TE缓冲液100 μL溶解DNA,用分光光度法测定试样DNA浓度,保存于-20℃。
1.4 全基因组测序
选取P3与P10代AcMNPV进行illumina Hi-seq X PE 150测序(北京奥维森科技有限公司)。
1.5 PCR和电泳
采用PCR及Sanger测序对二代测序的结果进行进一步验证。使用TIANSeq高保真PCR反应预混液(天根生化科技有限公司,货号:NG219)进行PCR扩增,扩增条件见表1,引物序列见表2。反应产物使用1%琼脂糖凝胶电泳检测,将电泳呈阳性的PCR产物送至华大基因公司测序。
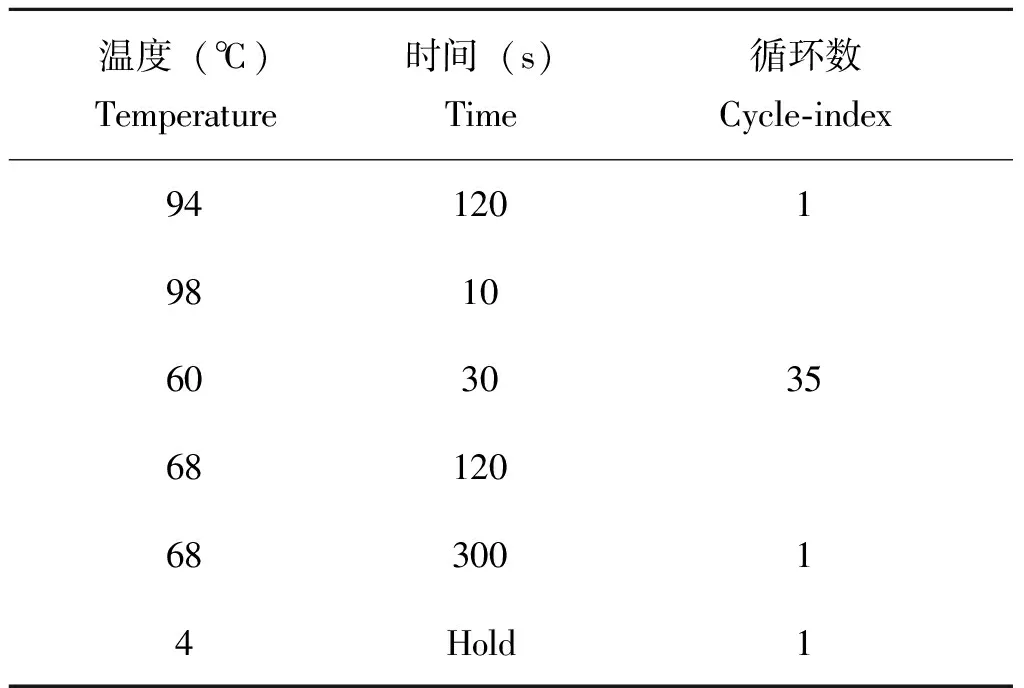
表1 PCR反应条件

表2 PCR实验引物序列
1.6 生物测定
选取P3,P6,P10,P15,P20代AcMNPV进行生物测定,将病毒进行浓度梯度稀释,稀释浓度为2×105、4×105、8×105、1.6×106、3.2×106、6.4×106OBs/mL。添加等量无菌去离子水作为空白对照。
饲料平板的制备:取草地贪夜蛾饲料与适量蒸馏水放于锅中加热融化,趁热倒入15孔板养虫盒内,每孔加入量以刚好铺满孔板底部为准,冷却凝固备用。
处理方法:饲料平板加入100 μL稀释好的病毒液,空白对照加等量蒸馏水,涂布均匀,再用已消毒的毛笔或镊子将草地贪夜蛾2龄幼虫转移至已加入病毒的饲料平板内。每个浓度30头。然后转移至温度25℃±1℃下继续培养。观察并记录饲料及幼虫感染死亡情况。
1.7 毒力计算
根据生物测定的结果,用SPSS 22.0对死亡率与浓度基于Probit回归模型进行回归分析,计算LC50,并以此为指标进行毒力分级。
2 结果与分析
2.1 生物测定以及毒力分析
将收集的虫尸纯化后得到OBs,计数后将病毒分别稀释至不同浓度,喂食30头草地贪夜蛾2龄幼虫,另以喂食等量去离子水作为空白对照组。统计10 d内幼虫死亡率(图1)。第3代死亡率为0。第6代,随着接种浓度增加,死亡率增加,但死亡率仍然很低,使用1.6~6.4×106OBs/mL,仅有1头死亡。但是,随着P10代以上,矫正死亡率显著提升。通过生物测定数据计算半致死浓度(LC50),经计算得P10、P15、P20代的LC50分别为4.845×107,2.665×107,2.925×107OBs/mL,由于感染P3和P6代AcMNPV的幼虫死亡率过低,故无法计算二者的LC50。该结果表明不同毒株毒力从高到低依次为P15,P10,P20,P6,P3。

图1 不同浓度病毒对草地贪夜蛾2龄幼虫致死率
2.2 测序结果及分析
选取P3和P10代AcMNPV进行二代测序,将测序结果拼接获得全基因组序列,与NCBI中序列(Accession number : NC_001623)进行比对,发现部分基因存在核苷酸突变和氨基酸突变。该结果表明7个编码基因ac34、fgf、lef12、lef2、lef9、arif1以及ac112基因发生了核苷酸突变,其中4个基因ac34、fgf、lef12和lef2发生了氨基酸突变。经进一步PCR验证,发现fgf基因为测序错误(结果未展示)。将这3个基因的测序结果翻译后进行BLAST比对(图2)。

图2 Ac34、LEF12、LEF2在P3和P10的氨基酸突变
图中可以看出Ac34的3个氨基酸突变均发生在第10代,LEF12的3个氨基酸突变发生在第3代和第10代,LEF2的4个氨基酸突变只发生在第3代,而第10代与NCBI序列相同,依据氨基酸结果以及核苷酸测序结果发现第10代出现了突变回复现象(图3)。生物测定结果表明,第10代病毒的毒力远远高于第3代。这可能是由于连续传代中宿主的选择性压力导致相同基因位点多次突变,将适宜宿主的突变保留,而与宿主适应性无关的突变被淘汰。

图3 lef2在P3和P10的核苷酸突变
3 结论与讨论
草地贪夜蛾入侵我国并将长期定殖,对其防控将成为长久的战役。病毒等微生物农药,可使害虫种群在田间形成流行病,是抑制其常在性危害的重要措施之一。体内连续传代过程中病毒活性增强的现象已有很多报道,并认为连续传代是从异质性的野生型群体中选择毒力更强的病毒全体(Kolodny-Hirsch and van Beek, 1997)。AcMNPV在小菜蛾Plutellaxylostella(Linnaeus)幼虫中连续传代后病毒毒力增强是由于基因型发生了变异(KolodnyHirsch and VanBeek, 1997)。病毒跨宿主连续传代,NPV往往对传代宿主毒力显著升高,并且与传代次数有关(王成燕, 2012)。
毒力和传播力的博弈一直都是病毒进化的驱动因素之一。病毒毒力和传播能力之间往往存在进化上的权衡。病毒在宿主体内的复制是促进病毒在各个宿主间传播的必要条件。根据传播毒力权衡假说,高毒力病毒具有较高的传播率(病毒复制与毒力呈正相关)和较快的传播速度(更快地杀死宿主)。较快的杀虫速度可能会增加病毒的适应度,导致感染昆虫体内的OBs能迅速释放到宿主血液中,使传播周期和病毒扩增增加。一项对舞毒蛾核型多角体病毒(Lymantriadisparnucleopolyhedrovirus,LdNPV)的研究表明,短期感染的毒力高于长期感染的毒力,这是因为宿主死亡率大的代价是病毒传播的减少(Cooperetal., 2002)。昆虫中肠是病毒入侵过程中基因型选择的主要场所。目前的研究表明,该过程也是病毒的遗传瓶颈,可能严重影响宿主初始基因型的多样性。该过程有助于基因型选择,只有复制最有效的基因型才能建立有效的感染。
本研究使用的AcMNPV野生株宿主为棉铃虫或甜菜夜蛾,经交叉世代感染获得,对两种宿主均有较高的毒力。然而,该毒株对草地贪夜蛾毒力较低,与Haas-Stapleton(2005)报道的结果一致(Haas-Stapletonetal., 2005)。本研究的压力筛选方法是选择将最先死亡的虫尸中收获的病毒多角体用于下一代接种,从而逐代缩短杀虫速度。虽然传代过程中LC50有所波动,但通过连续传代获得的AcMNPV毒株对宿主草地贪夜蛾的毒力有所增强。测定了几个世代AcMNPV毒力,毒力从高到底依次为P15、P10、P20、P6、P3。在前几代中,病毒的毒力与传代数呈正相关,该结果表明,随着传代次数增加,病毒对草地贪夜蛾幼虫的敏感性增强,对草地贪夜蛾的宿主适应性增强。在P20代,AcMNPV毒力下降,这可能是由于病毒中存在不同的突变亚株所致。在收集子代病毒时,优先选择致死时间较短的毒株,而不是致死效果最强的毒株,这可能导致了致死时间短的亚株成为子代的优势种,导致幼虫死亡率降低。
本研究的数据表明,AcMNPV在跨物种复制增殖过程中基因型发生了变异。本研究对AcMNPV第3代与第10代毒株进行了二代测序和序列比对,发现了多处SNP突变,包括一些编码氨基酸的基因突变。发现该病毒的7个编码基因存在单核苷酸多态性,这7个编码基因参与病毒入核、多角体产量、加速中肠初始感染、抑制凋亡等功能。其中4个编码基因发生同义突变可能是由于不同宿主的密码子偏好不同,对产生蛋白的影响不大;错义突变的基因由于氨基酸组成的改变对蛋白质的影响较大。编码错译突变的基因分别为ac34、lef12和lef2。
Ac34是一种促进晚期基因表达的激活蛋白,对病毒的致病性至关重要(Caietal., 2012)。Ac34序列高度保守,其C端保守性更强,序列中存在非保守的核定位信号,也存在潜在的转录后修饰位点(Qiuetal., 2017)。Ac34存在于细胞核和细胞质中,由于杆状病毒在细胞核内复制,Ac34的核定位可能对其促进病毒复制的功能至关重要(Zhangetal., 2019)。Ac34刺激病毒晚期基因转录,从而促进BVs的产生,缺失ac34后产生无传染性BVs,但细胞核内可观察到包被的核衣壳(Qiuetal., 2017)。缺失ac34不影响DNA复制以及病毒组装,而延迟晚期基因表达。进一步研究表明,晚期转录不需要Ac34,但晚期基因表达的扩增需要Ac34(Qiuetal., 2017)。
lef12是一种晚期表达基因,与病毒复制无关(Yuanetal., 2014),但在晚期转录中起直接作用。然而lef12缺失的重组病毒产量下降了5倍(Qiuetal., 2017)。lef12不是病毒基因组复制所必需的基因,但其缺失将导致宿主细胞的感病时间延迟,也显著降低病毒晚期和极晚期基因的转录水平,导致晚期和极晚期蛋白水平减少(Guarinoetal., 2002)。
LEF1为引物酶,而LEF2作为引物酶辅助因子,将LEF1纳入病毒DNA上组装的复制复合物中,LEF1与LEF2结合,同时与单链DNA形成稳定的复合物,并可能与其它DNA复制相关的蛋白质结合,实现DNA复制(Mikhailov and Rohrmann, 2002)。最近的研究表明,LEF2不是影响DNA复制的必要因素,而只是提高DNA复制效率的影响因子(Wuetal., 2010)。lef2的启动子序列包含两个晚期启动子共识基序(TAAG),因此lef2可能在感染晚期转录(Passarelli and Miller, 1993)。由于LEF2作为DNA复制的重要影响因素,DNA复制又是晚期和极晚期基因表达的必要因素,故lef2突变会抑制晚期和极晚期基因表达(Merringtonetal., 1996)。综上所述,LEF2影响病毒的方式有两种:直接作用于晚期和极晚期基因表达,或作用于病毒DNA复制,间接影响病毒增殖(Sriram and Gopinathan, 1998)。
上述3种基因以不同的方式影响病毒产生以及病毒毒力。在本研究中,lef12的基因突变在第3代和第10代均有发生,lef2的基因突变仅在第3代发生,ac34的基因突变仅出现在第10代毒株中,提示Ac34在提高AcMNPV对草地贪夜蛾致病性中的重要性。这3个编码基因特别是ac34的突变,可能是促进AcMNPV在草地贪夜蛾幼虫中连续传代毒力增强的原因,具体的机理有待进一步研究。

