长链非编码RNA RMRP对急性心肌梗死并发急性心力衰竭的预测价值*
揭 海,吴源聪,邢建庞
1.深圳市萨米医疗中心/深圳市第四人民医院心血管内科,广东深圳 518118;2.广东医科大学附属医院心血管内科,广东湛江 524002;3.惠州市第六人民医院心血管内科,广东惠州 516211
急性心力衰竭(AHF)是急性心肌梗死(AMI)患者在住院期间最常见的并发症,是影响AMI患者预后的重要危险因素,AMI并发AHF患者易出现休克和死亡[1]。在入院早期对AMI并发AHF的患者进行早期预测及干预,对减少AMI患者住院期间的并发症和改善预后意义重大[2]。长链非编码RNA(lncRNA)位于细胞核或细胞质中,长度超过200个核苷酸。研究证实,多种lncRNA参与心脏疾病发生和发展的病理生理过程,如急性冠状动脉综合征、心力衰竭、心肌病和心律失常等[3-6]。lncRNA RMRP是编码RNase线粒体RNA加工(MRP)的267个核苷酸RNA成分[7]。研究显示,lncRNA RMRP可促进胃癌、胶质瘤和肺癌的进展[8-9]。基因芯片结果显示,lncRNA RMRP在患有缺血性心肌病终末衰竭心脏及心脏肥大的小鼠模型中均明显上调,提示lncRNA RMRP可能参与调控缺血诱导的心肌损伤[10]。尽管如此,AMI患者血清lncRNA RMRP相对表达水平及临床意义尚不清楚。本研究旨在检测AMI患者血清lncRNA RMRP相对表达水平,并探讨其对AMI并发AHF的预测价值,现报道如下。
1 资料与方法
1.1一般资料 本研究纳入2018年7月至2019年3月于惠州市第六人民医院心血管内科住院的AMI患者142例为病例组,另选取同期于惠州市第六人民医院行健康体检的健康志愿者80例为对照组。病例组纳入标准:(1)年龄>18岁;(2)首次发病,且发病到入院时间<12 h;(3)经过冠状动脉造影检查后,符合2015年中国急性ST段抬高型心肌梗死诊断和治疗指南[10]。排除标准:(1)既往诊断有心肌病、瓣膜病、结缔组织病、心力衰竭等各类心脏疾病;(2)合并严重肝肾功能障碍、各类恶性肿瘤、严重感染、自身免疫性疾病、血液系统疾病、严重脑卒中等;(3)妊娠期女性。病例组中男80例,女62例;平均年龄(60.97±12.40)岁。对照组中男48例,女32例;平均年龄(59.85±12.28)岁。两组研究对象年龄和性别比较,差异无统计学意义(P>0.05),具有可比性。本研究通过惠州市第六人民医院伦理委员会审核批准,研究对象签署知情同意书。
1.2分组及诊断标准 病例组患者根据在住院期间是否发生AHF分为AHF亚组和非AHF亚组,其中AHF诊断标准如下[11]:(1)新发的典型心力衰竭临床表现(如疲乏、呼吸困难、不能平卧等);(2)心率加快,或出现奔马律,或下1/2肺野可闻及湿啰音(住院期间心功能Killip Ⅱ级或以上);(3)胸部影像学检查显示存在肺淤血、肺水肿、胸腔积液;(4)超声心动检查提示心功能受损[如左心室射血分数(LVEF)<0.5等];(5)心源性休克。
1.3临床资料收集和血清标本采集 从患者病历资料中提取如下资料,包括性别、年龄、吸烟史、高血压病史、糖尿病病史和体质量指数(BMI)等一般临床资料,收集患者超声报告资料。病例组患者在入院时采集外周静脉血10 mL,对照组采集清晨空腹静脉血10 mL,1 600 r/min,离心15 min后使用含乙二胺四乙酸的离心管留取上清液,在4 ℃条件下15 000 r/min,离心15 min,使用无RNA酶的冻存管收集上清液,置于-80 ℃冰箱保存备用。
1.4实时荧光定量聚合酶链反应(qRT-PCR) 血清标本经室温解冻复温后,采用Trizol试剂盒(美国Thermo Fisher Scientific公司)提取总RNA,后采用反转录试剂盒(美国Applied Biosystems公司)反转录成cDNA,采用qRT-PCR测定血清标本的lncRNA RMRP相对表达水平。qRT-PCR反应体系如下:SYBR Select Master Mix(2×) 5.0 μL,cDNA 1.0 μL,正向引物0.4 μL,反向引物0.4 μL,ddH2O 3.2 μL。反应条件:预热变性95 ℃ 3 min、95 ℃ 15 s、退火延伸60 ℃ 60 s、共40个循环。引物序列由上海吉玛生物有限公司合成,引物序列如下,正向:5′-GCC CAG CTT TCT TGA GTA A-3′;反向:5′-CAT ATG AGG AGT CGC AGG CA-3′。β-actin为内参,引物序列如下,正向:5′-GTC AAC GGA TTT GGT CTG TAT T-3′;反向:5′-AGT CTT CTG GGT GGC AGT GAT-3′。lncRNA RMRP相对表达水平的计算采用2-ΔΔCt法。
1.5超敏C-反应蛋白(hs-CRP)、肌钙蛋白I(cTnI)和N末端B型利钠肽前体(NT-proBNP)水平的测定 采用双抗体夹心ELISA测定待测血清hs-CRP、cTnI、NT-proBNP水平,简要步骤为:将患者血清解冻后,1 000×g离心10 min,取上清液。在酶标包被板上设标准品孔10孔,分别设定空白孔、对照孔及待测样品孔,在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL,置37 ℃温育30 min,洗涤5次,甩干,每孔加入酶标试剂50 μL,37 ℃温育30 min,洗涤5次,甩干,每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min,每孔加终止液50 μL,终止反应(此时蓝色立转黄色),以空白孔调零,用酶标仪在450 nm波长下依序测量各孔的吸光度(A)值,计算hs-CRP、cTnI、NT-proBNP水平。

2 结 果
2.1病例组和对照组各参数比较 病例组和对照组在一般临床资料(如年龄、性别、BMI、吸烟、高血压、糖尿病、血脂异常和累及病变动脉数目)之间比较,差异均无统计学意义(P>0.05),对照组LVEF、左心室短轴缩短率(LVFS)、hs-CRP、cTnI、NT-proBNP水平及lncRNA-RMRP相对表达水平均高于病例组(P<0.05)。见表1。
2.2AHF亚组和非AHF亚组各参数比较 AHF亚组血清lncRNA RMRP相对表达水平高于非AHF亚组(P<0.001),AHF亚组LVEF和LVFS低于非AHF亚组(P<0.05),AHF亚组hs-CRP、cTnI和NT-proBNP高于非AHF亚组(P<0.05),AHF亚组与非AHF亚组患者在一般临床资料,如年龄、性别、BMI、吸烟、高血压、糖尿病、血脂异常和累及病变动脉数目之间比较差异无统计学意义(P>0.05)。见表2。
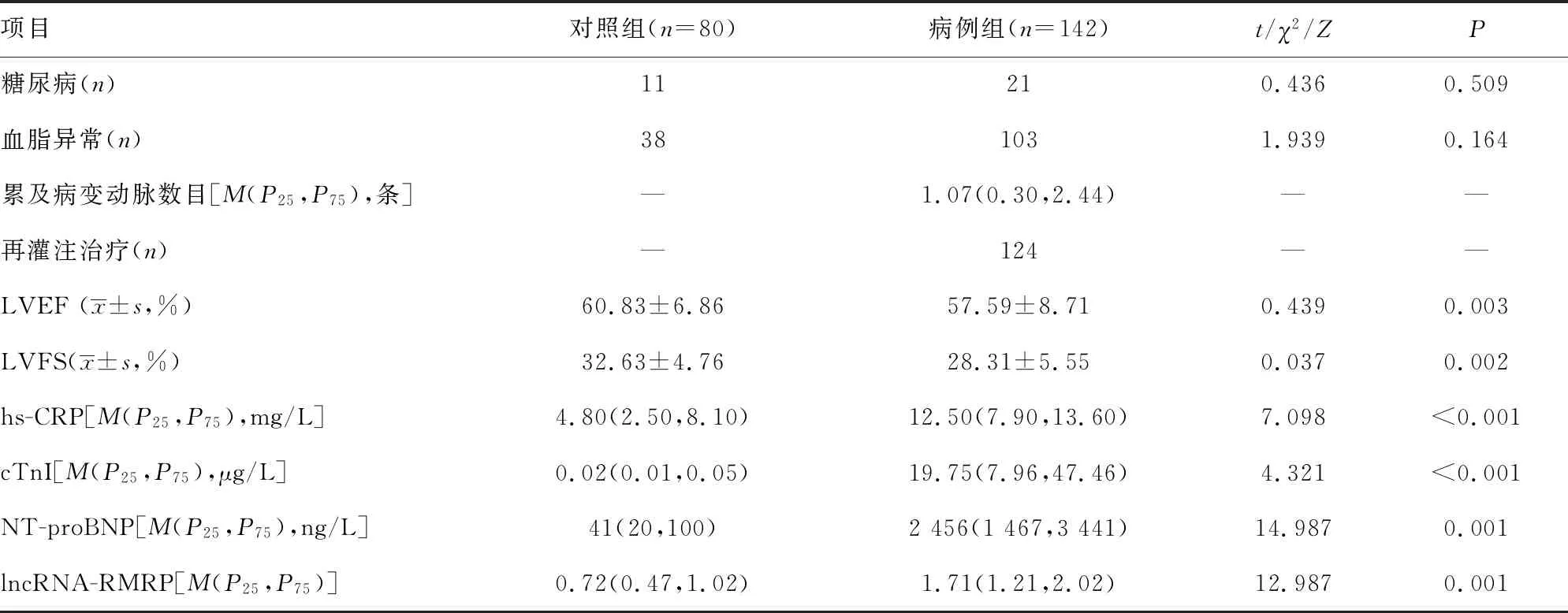
续表1 病例组和对照组各参数比较
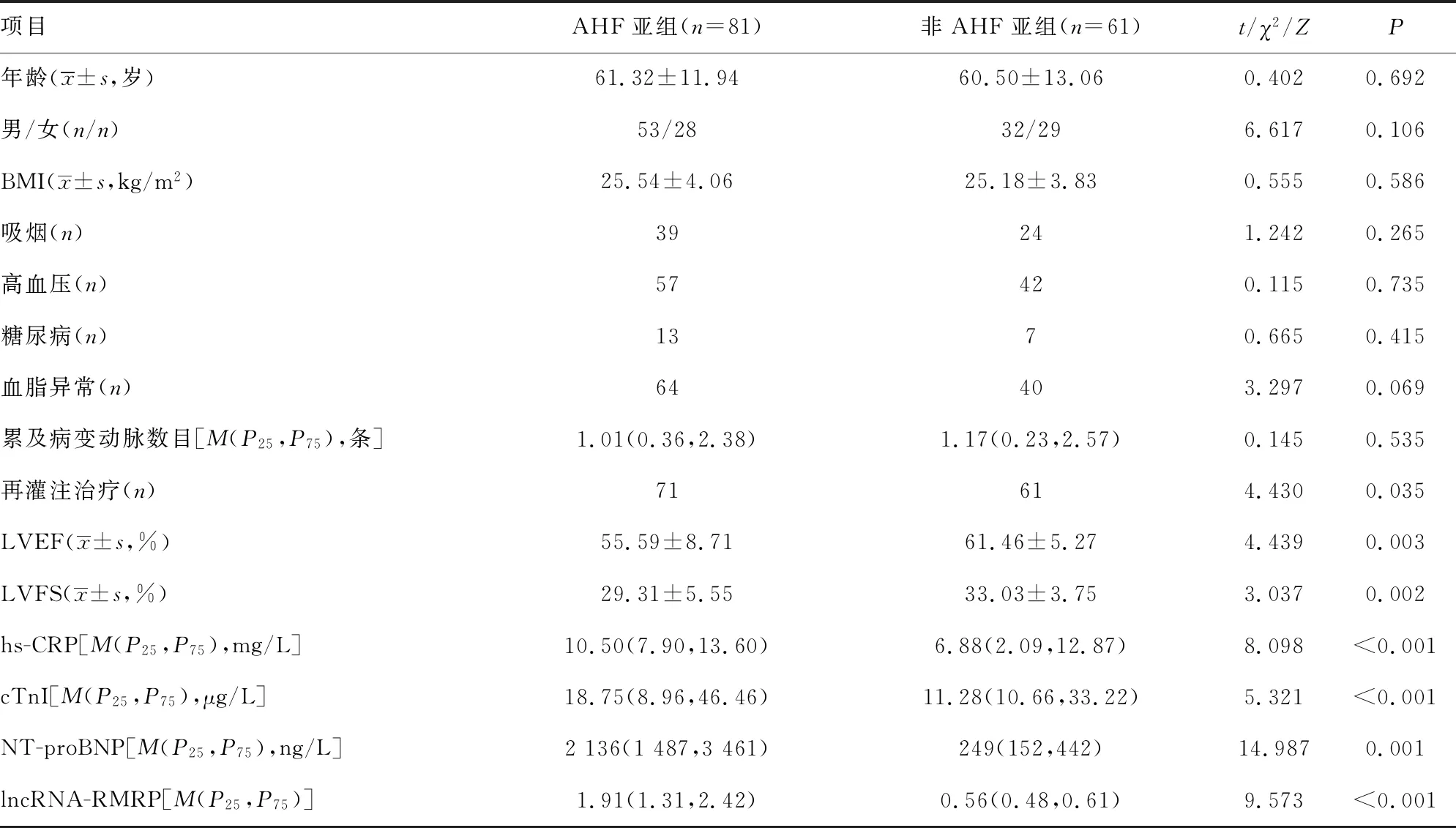
表2 AHF亚组和非AHF亚组各参数比较
2.3血清lncRNA-RMRP 相对表达水平与心力衰竭相关标志物间的关系 采用Spearman相关分析示,病例组血清lncRNA-RMRP相对表达水平与LVEF呈负相关(r=-0.843,P<0.001),与hs-CRP(r=0.643,P<0.001)、cTnI(r=0.743,P<0.001)和NT-proBNP(r=0.943,P<0.001)呈正相关。
2.4血清lncRNA-RMRP、NT-proBNP、cTnI和hs-CRP对AMI并发AHF的预测价值 ROC曲线显示,当血清lncRNA-RMRP截断值为1.34时,lncRNA-RMRP预测AMI患者并发AHF的AUC为0.896(95%CI:0.844~0.948,P<0.001),灵敏度为88.4%,特异度为83.3%;当血清NT-proBNP截断值为1 675 ng/L时,NT-proBNP预测AMI患者并发AHF的AUC为0.809(95%CI:0.717~0.932,P<0.001),灵敏度为78.2%,特异度为70.4%;当cTnI截断值为12.13 μg/L时,cTnI预测AMI患者并发AHF的AUC为0.746(95%CI:0.632~0.818,P<0.001),灵敏度为78.7%,特异度为72.4%;当hs-CRP截断值为9.24 mg/L时,hs-CRP预测AMI患者并发AHF的AUC为0.723(95%CI:0.604~0.738,P<0.001),灵敏度为61.3%,特异度为69.2%;血清lncRNA-RMRP预测AMI并发AHF的AUC大于NT-proBNP、cTnI和hs-CRP单项检测。见图1。
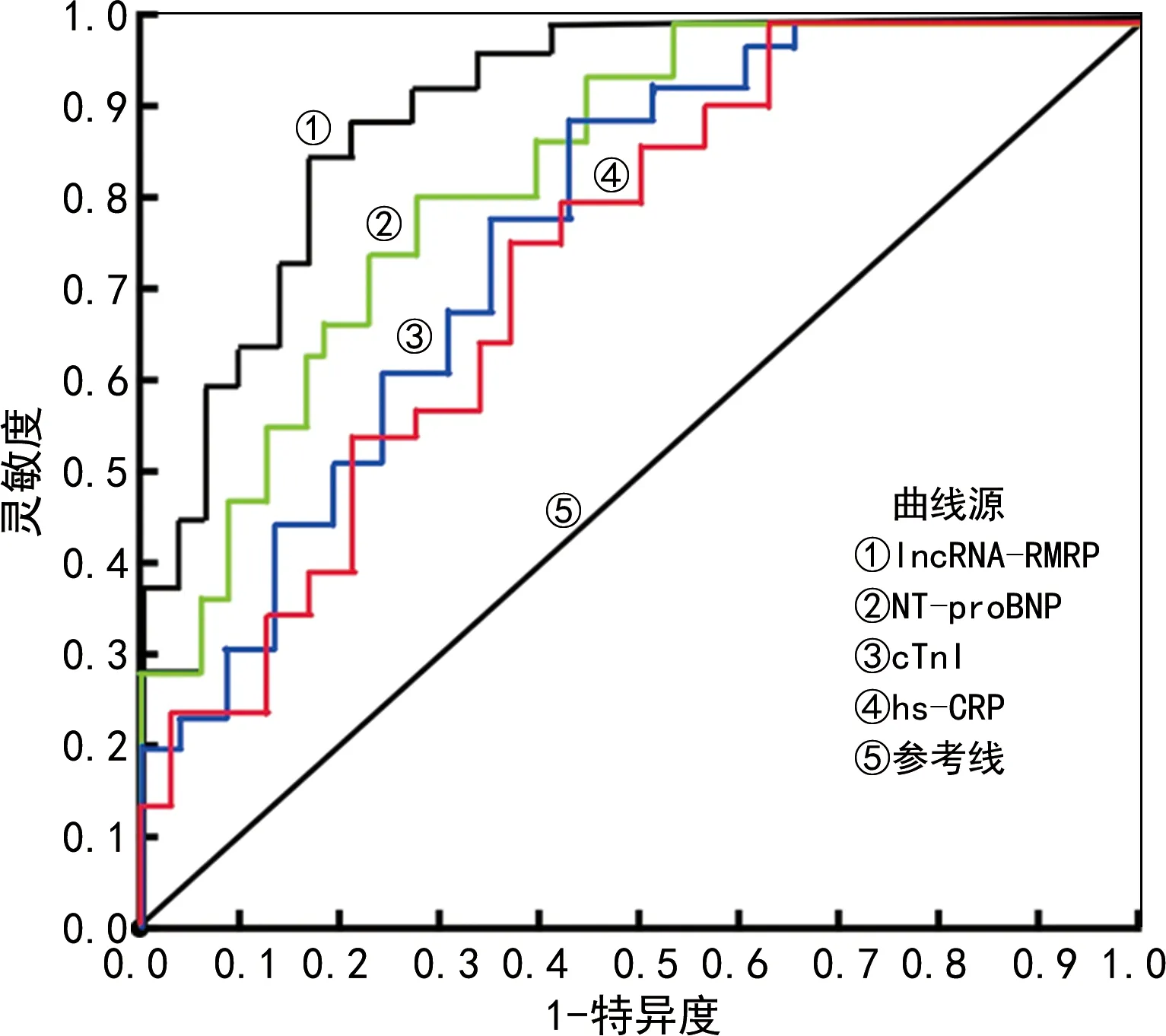
图1 血清lncRNA-RMRP、NT-proBNP、cTnI和hs-CRP对急性AMI并发AHF的预测价值
3 讨 论
AMI是严重的冠状动脉疾病之一,是全世界死亡和残疾的主要原因[12]。在AMI患者住院期间,心力衰竭是最常见的并发症,AMI患者并发AHF导致死亡的风险较单独AMI明显增加[13]。AMI导致AHF与多种因素密切相关,其中心肌缺血再灌注损伤为重要因素之一,心肌细胞内线粒体钙超载、氧化应激、ATP耗竭等原因均可导致心室肌功能障碍而引起AHF。药物治疗是对AMI并发AHF最有效的治疗方法,但是早期缺乏症状会导致预后不良,探索有效的生物标志物对于AMI并发AHF的早期发现和预后改善至关重要[14]。有文献报道,NT-proBNP和肌钙蛋白等生物标志物可预测AMI后的心血管并发症,但上述生物标志物易受到遗传背景、环境、生物学行为和其他疾病异质性的影响[15]。
lncRNA是一组长度大于200个核苷酸的RNA,在心血管等各种疾病中起着重要作用,特别是在细胞增殖、迁移、侵袭、凋亡和氧化应激、缺血缺氧过程中具有重要的调节作用[16-17]。lncRNA-RMRP是一种最近发现和鉴定出的lncRNA,研究发现,其在非小细胞肺癌、肝癌、胃癌和甲状腺癌中发挥癌基因的作用[18]。有研究显示,lncRNA-RMRP参与心肌细胞的缺氧凋亡过程,在体外培养的心肌细胞中,缺氧刺激能促进lncRNA-RMRP表达而降低心肌细胞凋亡水平[19]。
本研究通过qRT-PCR检测AMI患者血清中lncRNA-RMRP相对表达水平发现,与对照组相比,AMI患者血清中lncRNA-RMRP相对表达水平明显升高,同时发现AHF亚组患者血清中lncRNA-RMRP相对表达水平高于非AHF亚组患者,上述研究结果提示,随着心肌细胞损伤、坏死或凋亡数目增加,血清中lncRNA-RMRP相对表达水平升高,而并发AHF的患者血清lncRNA-RMRP 相对表达水平升高更为明显。尽管导致AMI患者血清lncRNA-RMRP相对表达水平升高的分子机制尚不清楚,其可能为心肌细胞在缺血缺氧刺激下导致lncRNA-RMRP相对表达水平升高。有文献报道,在肝细胞癌中,在缺氧培养条件下,lncRNA-RMRP相对表达水平升高,且lncRNA-RMRP 高表达与mi-613形成调节轴,促进肝癌的恶性进展[20]。
传统预测AMI并发AHF的血清标志物有B型钠尿肽、hs-CRP、胱抑素C和甲状腺激素等,尽管上述血清学标志物对AHF具有一定的预测价值,但普遍存在特异度和(或)灵敏度欠佳的问题[21]。AMI患者并发AHF的病理生理基础和起始事件为心肌梗死后发生左心室重构,有文献报道,在93例AMI患者中,联合检测NT-proBNP和糖类抗原-125水平预测AMI患者发生左心室重构的AUC为0.850 (95%CI:0.761~0.915)[22]。还有文献报道,在405例AMI患者中,住院期间发生AHF的患者85例,未发生AHF的患者320例,而入院时血清NT-proBNP和hs-CRP水平预测住院期间AMI并发AHF的AUC分别为0.919和0.705[23],与本研究结果类似。上述结果提示,NT-proBNP和hs-CRP是AMI患者并发AHF重要预测和诊断分子标志物。本研究发现,血清lncRNA-RMRP相对表达水平预测AHF的AUC为0.896,血清中NT-proBNP、cTnI和hs-CRP预测AMI并发AHF的AUC分别为0.809、0.746和0.723,上述结果提示lncRNA-RMRP相对表达水平对AMI患者并发AHF预测价值高于传统的AHF相关分子标志物。
文献报道,lncRNA是潜在的心肌损伤和心功能损害的有效分子标志物,例如lncRNA-NRF是AMI后预测AHF重要的血清标志物[24],其不仅可预测AMI后并发AHF,同时也是判断AHF预后不佳的重要的分子标志物。此外,本研究发现,AMI患者血清lncRNA-RMRP相对表达水平与心功能常见指标LVEF呈负相关,而与hs-CRP、cTnI和NT-proBNP呈正相关,提示心肌梗死患者血清lncRNA-RMRP相对表达水平能反映患者心功能和心肌损伤状态。对于AMI患者而言,尽早在住院期间发现和区分AHF高风险因素,不仅可对患者疾病严重程度进行有效分层,而且可对AHF的发生进行尽早干预,减少AMI并发症,提高患者的生存率和生存质量。
综上所述,本研究发现,AMI并发AHF患者血清lncRNA-RMRP相对表达水平升高,并发AHF患者血清lncRNA-RMRP相对表达水平高于未并发AHF的患者,血浆lncRNA-RMRP相对表达水平可作为AMI患者并发AHF的早期预测因子。

