染料木素脂质体的制备及其包封率和稳定性研究*
谢 琳,韦龙华,蒋雯丽,熊建文,易 慧,蔡锦源,崔 娜
柳州工学院食品与化学工程学院,广西 柳州 545616
染料木素(GEN)属于黄酮类化合物,化学名称为4',5,7-三羟基异黄酮(C15H10O5),是主要从染料木、山豆根、大豆、槐角、大叶千金拔等植物提取出来的一种异类黄酮类化合物。染料木素几乎不溶于水,溶于稀碱、乙醇等有机溶剂中。因其具有与雌性激素相似的化学结构,表现出雌激素样活性和作用,故又称为植物雌激素[1]。雌性激素刺激胶原蛋白等细胞外基质合成是其缓解皮肤老化、改善皱纹的主要机制[2]。此外还具有抗氧化、降血脂、抗肿瘤等多种药理活性。染料木素的天然资源富足,在大多数动物种类中表现出极低水平的毒性作用,被广泛应用于化妆品、食品与保健药用等领域[3]。染料木素是脂溶性药物,它的口服试剂和注射试剂药物利用率极低,如何提高药物利用及其溶解度等内容已成为当今药剂工作者们研究的热门课题,但目前还没有完善的关于染料木素脂质体制备的研究。
化妆品中的功能性成分必须透过角质层达到相应的作用部位,才能起到营养、改善皮肤状况的作用,而人的皮肤的角质层具有极强的屏障作用,大分子的功能性成分难以通透。将功能性成分装进脂质体囊泡中,由于脂质体与生物膜结构相似,功能性成分在脂质体的携带下经皮透过量增加。脂质体是将药物包封于类脂质双分子层的超微型球状载体。脂质体由磷脂和胆固醇组成,可使脂溶性药物易分散于水中,脂溶性药物被脂质体包封后的构成具有靶向性、缓释性和稳定性,且毒性低的新型药物剂型[4-7]。自从脂质体应用于化妆品后,人们就开始探究它对于皮肤的效用。经实验分析,它确实对肌肤具有效用,主要表现在以下几个方面:提高功能性药物的稳定性;使功能性药物留在表皮与真皮之间,提高药物利用率;保护肌肤的作用;对肌肤具有良好的保湿效果。目前制备脂质体的方法主要有乙醇注入法、逆向蒸发法、薄膜超声分散法、超临界CO2等[8]。文章采用薄膜超声分散法制备染料木素脂质体。脂质体的配方组成会影响脂质体的结构,从而影响包封率,因此文章通过正交设计优化染料木素脂质体的配方,为染料木素脂质体在化妆品、食品、药品中的开发提供参考依据。
1 试剂与仪器
试剂:卵磷脂、胆固醇(河南天兴食品添加剂,食品级);染料木素(中国食品药品检定研究所,纯度>98%);“吐温-80”(天津中和盛泰化工有限公司,食品级);三氯甲烷、甲醇、盐酸(西陇科学股份有限公司,AR级)。
仪器:JJ200电子天平(常熟市双杰测试仪器厂);TDZ4-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);旋转蒸发器RE-52A(上海亚荣生化仪器厂);UV-1800紫外分光光度计(上海美谱达仪器有限公司);KQ5200DE数控超声波清洗器(昆山市超声仪器有限公司);SHZ-D(Ⅲ)循环水式多用真空泵(河南省予华仪器有限公司);Nikon Eclipse E200光学显微镜(上海衡浩仪器有限公司)。
2 试验方法
2.1 染料木素标准曲线的绘制
精确称取染料木素1.6mg,放置于100mL容量瓶中用无水乙醇溶解并定容至刻度,得到染料木素标准溶液(16μg/mL),精确吸取1mL、1.5mL、2mL、2.5mL、3.0mL、3.5mL、4.0mL、4.5mL溶液并放置于10mL试管中,并用无水乙醇将体积调节至刻度,以无水乙醇作空白对照,在263nm处测取吸光度,以吸光度与标准浓度做标准曲线方程。
2.2 染料木素脂质体的制备
(1)溶剂及缓冲液制备:取70g甲醇于250mL烧杯中加入30g三氯甲烷,搅拌均匀,放置于棕色瓶中保存做溶剂。取30.285g Tris于250mL锥形瓶中加入200mL纯水,再加20mL浓盐酸,高温高压杀菌后,常温保存,控制pH值约在7.20,做缓冲液。
(2)染料木素的制备:按剂量比称取染料木素、大豆卵磷脂、胆固醇和“吐温-80”放置于烧瓶中,加入三氯甲烷-甲醇(3∶7)混合溶剂溶解,在一定温度下用旋转蒸发仪除去有机溶剂(控制压力在0.06MPa),直至烧瓶内壁形成一层干燥的薄层脂膜,继续旋转蒸发20min使脂膜完全干燥(控制压力在0.10MPa),加入超过量三羟甲基氨基甲烷(Tris)-HCl(pH值为 7.20)生物缓冲液(控制压力在0.02MPa)。继续减压蒸馏10min,超声波冰水浴10min(控制温度在10℃),重复3次,至体系均匀分散。
2.3 包封率的计算
总含量测定:取1mL脂质体于10mL试管中用无水乙醇定容至10mL进行破乳,取1mL破乳液稀释至10mL,用紫外分光光度计于263nm处测定吸光度。
游离染料木素测定:取2mL脂质体放置于离心管中,在3000r/min下离心30min,取上清液0.1mL于10mL试管中并定容至10mL刻度,用紫外分光光度计于263nm处测定吸光度。
计算方法:包覆率=(产品中染料木素总含量-液体介质中游离的染料木素含量)÷产品中染料木素总含量。
2.4 单因素实验
(1)温度对包覆率的影响。加入0.8g大豆卵磷脂、0.4g染料木素、0.20g胆固醇、5mL溶剂、0.10g“吐温-80”,改变温度(25℃、30℃、35℃、40℃、45℃),按2.3节制备并测定脂质体包封率。
(2)染料木素对脂质体的影响。加入0.80g大豆卵磷脂、0.20g胆固醇、5mL溶剂、0.10g“吐温-80”、30℃,仅改变染料木素含量,分别使大豆卵磷脂∶染料木素质量比为1∶1、2∶1、3∶1、4∶1、5∶1,按2.3节方法制备并测定脂质体包封率。
(3)胆固醇对脂质体的影响。加入0.80g大豆卵磷脂、0.40g染料木素、5mL溶剂、0.10g“吐温-80”、30℃,仅改变胆固醇含量,分别使大豆卵磷脂:胆固醇为1∶1、2∶1、3∶1、4∶1、5∶1,按第2.3节的方法制备并测定脂质体包封率。
(4)表面活性剂对脂质体的影响。加入0.8g大豆卵磷脂、0.4g染料木素、0.20g胆固醇、5mL溶剂、30℃,仅改变表面活性剂含量,使大豆卵磷脂∶表面活性剂质量比为2∶1、3∶1、4∶1、5∶1、8∶1,按2.3方法制备并测定脂质体包封率。
2.5 正交试验
A表示大豆卵磷脂与胆固醇质量比,B表示大豆卵磷脂与染料木素质量比,C表示大豆卵磷脂与“吐温-80”质量比。采用L9(34)正交试验表进行正交试验,如表1所示。
2.6 显微镜观察
取适量的染料木素脂质体稀释20倍,用吸管吸取,滴一滴于载玻片上,并用盖玻片盖住,用滤纸吸取多余水分置于显微镜下观察脂质体形态。
2.7 染料木素脂质体稳定性研究
(1)染料木素脂质体热稳定性测试。取染料木素脂质体,分为三组,放置于10mL试管中于4℃下3h,25℃下3h,37℃下3h和65℃下15min保存,并用紫外分光光度计测定吸光度。
(2)染料木素脂质体水解和贮存。制备三批脂质体,每批分为三组,于4℃各放一组避光保存,于1d、2d、3d、4d、5d测定pH值。取脂质体放置于4℃下,在4d内观察包封率。
(3)染料木素脂质体氧化测试。制备0.25mol/L盐酸200mL,加入硫代巴比妥酸0.75g,三氯乙酸30g,溶解并过滤取滤液,得到TTH试剂。取三批脂质体,每批分为三组,于4℃避光保存1d、2d、3d、4d、5d,各取1mL于10mL离心管中,加5mL TTH试剂,混匀,100℃水浴30min,冷却后加TTH试剂定容,混匀,3000r/min离心5min,以TTH试剂为空白对照,取上清液在535nm处测定吸光度。
3 结果与分析
3.1 染料木素标准曲线
染料木素标准曲线如图1所示。

图1 染料木素标准曲线
3.2 单因素实验
(1)温度对脂质体包封率的影响如图2所示。
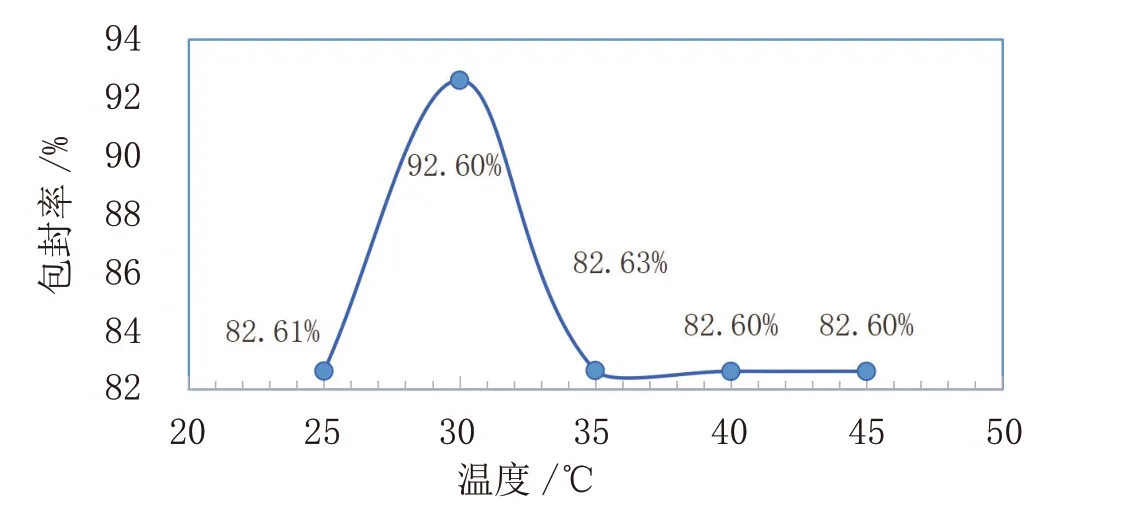
图2 温度对脂质体包封率的影响
由图2可知,随着温度的增加,包封率先增大后减小,最后居于平缓,在30℃达到最高。体系随着温度的升高,会导致大豆卵磷脂发生水解而使包封物渗漏,使得包封率降低,考虑到经济性及产率,选择30℃作为制备脂质体的温度。
(2)染料木素添加量对脂质体包封率的影响如图3所示。

图3 染料木素添加量对脂质体包封率的影响
实验中,大豆卵磷脂与染料木素比例分别为1∶1、2∶1、3∶1、4∶1及5∶1,测定其包封率。结果表明,随着染料木素添加量减少,包封率先增加后降低。当质量比为5∶1时,得到的包封率最低,且加入染料木素的量较少,脂质体中含有的量也较少,还浪费了大量的大豆卵磷脂和胆固醇壁材。当大豆卵磷脂与染料木素的质量比为3∶1时得到的包封率较高,且为93.11%。因此,选取1∶1、2∶1、3∶1作为正交试验的三水平。
(3)胆固醇对脂质体包封率的影响如图4所示。

图4 胆固醇对脂质体包封率的影响
实验中,大豆卵磷脂与胆固醇比例分别为2∶1、3∶1、4∶1、5∶1、6∶1、7∶1及8∶1,测定其包封率。结果表明,随着胆固醇添加量的减少,包封率先增加后减小。当大豆卵磷脂与胆固醇的质量比为2∶1时,脂质体中胆固醇的含量高使其嵌入双分子层夹层的含量就高,导致囊泡夹层空间缩小,染料木素进入夹层的含量降低,因此包封率较低;而当胆固醇的含量较低时,磷脂脂膜的流动性大,包封的药物易于渗漏,招致脂质体包封率低。当大豆卵磷脂与胆固醇的质量比为4∶1时所得到的包封率最高,且为92.60%,因此,选取大豆卵磷脂与胆固醇的质量比为3∶1、4∶1、5∶1作为正交试验三水平。
(4)表面活性剂对脂质体包封率的影响如图5所示。

图5 表面活性剂对脂质体包封率的影响
该实验在相同大豆卵磷脂用量、相同胆固醇用量及相同染料木素用量的条件下,考察“吐温-80”加入量对脂质体包封率的影响。在实验中,大豆卵磷脂与“吐温-80”比例分别为2∶1、3∶1、4∶1、5∶1、6∶1、7∶1及8∶1,测定其包封率,结果如图5所示。结果表明随着“吐温-80”添加量的减少,包封率逐渐增大。因此,选取6∶1、7∶1、8∶1作为正交试验的三水平。
3.3 正交试验结果
正交试验结果如表2所示。由表2可知,影响染料木素脂质体包封率的先后次序为A>B>C,根据均值可以得到染料木素脂质体的最优制备条件为A3B3C3,即大豆卵磷脂∶染料木素为3∶1,豆卵磷脂∶胆固醇大为5∶1,大豆卵磷脂与“吐温-80”的比例为8∶1。方差分析表如表3所示。根据表3可知,大豆卵磷脂∶胆固醇质量比具有显著性差异。

表2 正交实验结果

表3 方差分析表
3.4 最优验证
包封率验证结果如表4所示。由表4可知,在染料木素脂质体最优的制备条件下,三次重复实验包封率均在94%以上,平均包封率为95.14%。由此可知,实验重复性良好,最优制备条件正确,所选工艺条件是可取的。
3.5 脂质体的形态
最优制备条件下的染料木素脂质体形态为椭圆球形,外观完整,符合脂质体形态。其粒径大多在200~300nm,属于大单室脂质体,少部分粒径达到1~2μm。有专家在离体人体腹部皮肤扩散实验中CLSM技术发现粒径超过600nm的普通脂质体不能将内容物传递到皮肤深层;而粒径小于300nm时,可以实现内容物的皮肤深层传递;粒径小于70nm时,可以在表皮和真皮内获得最大的荧光度。由此可见制备的染料木素脂质体可以把染料木素传递到皮肤深层。该制备的脂质体可以运用在化妆品制剂中。
3.6 染料木素脂质体稳定性测试结果
(1)脂质体热稳定性。储存温度对包封率的影响如图6所示。

图6 储存温度对包封率的影响
由图6可知,染料木素脂质体的热稳定性随温度的增高而降低,在65℃时破壁效果明显,脂质体从95%降至75%,在常温和消化温度下脂质体也具有一定的破壁效应,只有在4℃时脂质体破壁不明显,因此可见脂质体应储存在低温环境下。在4℃储存染料木素脂质体10d,脂质体包封率变化不大,无明显差别,维持在95%以上。因此,脂质体在4℃ 贮存是优良的,此时脂质体稳定性良好。
(2)脂质体的水解。脂质体膜材的水解反应使得脂质体中的膜材磷脂容易发生水解,脂质体制剂酸度通过磷脂的水解而增长,因此随着酸度的改化,脂质体的pH值也会随之变化[9]。储存天数对pH值的影响如图7所示。由图7可知,脂质体溶液的pH随着时间的推移缓慢降低,表明了脂质体正在水解,但在前面几天脂质体水解缓慢,pH值未发生明显变化。因此在制备脂质体时应制备高浓度的脂质体溶液,防止水解反应产生,影响脂质体包封率[10]。

图7 储存天数对pH值的影响
(3)脂质体的氧化。磷脂的氧化产物丙二醛可以与硫代巴比妥酸反应,在高温下产生红色的产物,该产物在535nm处有特殊吸收峰[11-13]。储存天数与脂质体氧化的关系如图8所示。由图8可知,脂质体随着时间的推移,氧化产物增加,氧化物与硫代巴比妥酸反应呈红色。因此在储存染料木素脂质体的时候应该密封储存,防止脂质体过多与空气接触,使磷脂与氧气反应[14]。

图8 储存天数与脂质体氧化的关系
4 结论
文章采用了薄膜分散法,将染料木素制备成脂质体。从配方组成、稳定性等方面研究了脂质体,最后得出以下结论:最优旋转蒸发温度为30℃,此时大豆卵磷脂∶胆固醇为5∶1,大豆卵磷脂∶染料木素为3∶1,大豆卵磷脂∶“吐温-80”为8∶1;在最优的制备条件下得到的染料木素脂质体包封率为95.14%,粒径为200~300nm,有的高达1000nm。通过测定脂质体稳定性得出,制备脂质体应先制备高浓度的脂质体溶液,并在4℃的温度下储存。

