LncRNA-SNHG3通过Hedgehog通路对乳腺癌细胞增殖的作用
李 妍 马小平 刘 丹 赵 兵
乳腺癌是最常见的恶性肿瘤之一,也是全球女性癌症相关死亡的第二大原因[1]。据统计,2018年中国乳腺癌发生率为36.1%,病死率为8.8%[2]。尽管近年来,诊断方法和治疗措施在不断优化,但乳腺癌患者的5年总生存率仍然很低[3]。因此,迫切需要进一步探究乳腺癌的发病机制。长非编码RNA(long non-coding RNAs,LncRNAs)是长度大于200个核苷酸的非编码RNA,在不同的病理生理过程中发挥着一系列特定的功能[4]。LncRNA小核仁RNA宿主基因3(small nucleolar RNA host gene 3,SNHG3)与肿瘤进展和不良预后有关[5]。已有相关文献证明,敲低SNHG3可抑制体外乳腺癌细胞增殖、迁移和侵袭能力,抑制体内肿瘤生长[6]。然而SNHG3在乳腺癌中的作用机制尚不明确,还需要进一步探索。Hedgehog信号通路是一条从细胞膜到细胞核的高度保守的信号传递进化途径,在胚胎发育过程中起着重要作用[7]。有研究发现, LncRNA EGOT通过激活Hedgehog途径促进胃癌细胞增殖,使细胞周期阻滞于G1期,从而促进胃癌的进展[8]。目前,还未有关于SNHG3调控Hedgehog信号通路的相关报道。本研究旨在探究SNHG3是否通过调控Hedgehog通路影响乳腺癌细胞增殖,以期为明确乳腺癌的发病机制及开发新的癌症治疗靶点提供新的科学资料。
材料与方法
1.材料:乳腺癌细胞MDA-MB-453和HEK-293T细胞购自中国科学院典型培养物保藏委员会细胞库;sh-NC、sh- SNHG3、oe-NC、oe- SNHG3和病毒包装质粒购自上海吉满生物科技有限公司;LipofectamineTM2000 Transfection Reagent购自赛默飞世尔科技(中国)有限公司;cyclopamine购自美国MedChemExpress公司;PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒购自宝日医生物技术(北京)有限公司;2×SYBR Green qPCR Mix购自美国Bimake公司;GLI1抗体购自英国Abcam公司。
2.细胞培养:MDA-MB-453用含10%胎牛血清的PRMI1640培养基,置于37℃、5% CO2培养箱中培养。HEK-293T细胞用含10%胎牛血清的DMEM培养基培养,细胞置于37℃、5% CO2培养箱中培养。待细胞融合度达到90%左右时,胰酶液消化细胞,按照1∶3比例进行传代培养。
3.慢病毒包装:取对数期生长的HEK-293T细胞,将其接种于6孔板,每孔1×106个细胞,细胞继续培养24h后,弃去细胞旧培养基,更换为新鲜培养基。将1.5μg sh-NC、sh- SNHG3、oe-NC和oe- SNHG3质粒分别加入到含1.5μg 病毒包装质粒的250μl的无血清DMEM中,另外将6μl LipofectamineTM2000加到250μl的无血清DMEM中,将两管溶液室温孵育5min,随后将两管溶液充分混匀,继续孵育20min,加入到细胞中。细胞置于37℃、5% CO2培养箱中培养72h。收集细胞上清液,3000r/min离心20min,弃去细胞碎片。慢病毒液置于-80℃条件下保存。
4.慢病毒感染:将对数期生长的MDA-MB-453细胞接种于6孔板,每孔1×105个细胞,细胞继续培养24h后,添加含有6μg/ml polybrene的新鲜培养基。将细胞随机分为对照组、sh-NC组、sh-SNHG3组、oe-NC组、oe-SNHG3组和oe- SNHG3+cyclopamine组,按照分组,各添加 30 MOI相应慢病毒液,对照组细胞正常培养。细胞继续培养72h后,向oe- SNHG3+cyclopamine组细胞中加入10μmol/L的cyclopamine,其余组细胞加入等量PBS。细胞继续培养24h后,进行后续实验操作。
5.RT-qPCR检测SNHG3 mRNA表达:收集慢病毒感染后的MDA-MB-453细胞,加入Trizol试剂裂解细胞,提取RNA并立即反转录合成cDNA。按照2×SYBR Green qPCR Mix使用说明书所示,配制RT-PCR反应体系,反应程序为:95℃、2min;95℃、15s,58℃、15s,72℃、40s,40个循环;72℃ 5min延伸。以U6 mRNA表达量为内参,采用2-ΔΔCt法计算SNHG3 mRNA表达。实验中所需引物序列为SNHG3(上游引物:5′- TTCAAGCGATTCTCGTGCC-3′; 下游引物:5′-AAGATTGTCAAACCCTCCCTGT-3′),U6(上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′; 下游引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′)。
6.CCK-8检测细胞活力: 将MDA-MB-453细胞接种于96孔板中,每孔细胞数量为5×103个。细胞继续培养12、24、48和72h后,向每孔细胞中加入10μl CCK-8溶液,将培养板置于37℃培养箱中孵育4h,用酶标仪测定各孔在450nm处的吸光度(A)值。
7.克隆形成实验检测细胞增殖:将慢病毒感染后的MDA-MB-453细胞接种于培养皿中,每皿接种300个细胞。细胞置于37℃、5% CO2培养箱中连续培养2周。弃去培养液,4%多聚甲醛室温固定细胞15min。吉姆萨染色液染色10min后,流水冲洗,空气干燥。肉眼直接计数克隆数。
8.Western blot法检测Gli1蛋白表达:收集慢病毒感染后的MDA-MB-453细胞,蛋白裂解液裂解细胞后,收集细胞上清液。取20μg蛋白加入到凝胶中,进行电泳操作。电泳结束后,将蛋白质转印至PVDF膜上。加入5%脱脂奶粉室温下封闭PVDF膜3h。随后加入GLI1抗体(1∶2000),4℃条件下孵育过夜。加入特异性二抗(1∶5000),室温孵育1h。向PVDF膜均匀滴加ECL化学发光试剂,暗室曝光。Image J软件进行蛋白条带的灰度分析。

结 果
1.慢病毒感染效率检测:荧光显微镜观察各组细胞发光情况,结果显示,除对照组细胞外,其余组细胞均高表达绿色荧光。与对照组比较,sh-NC组和oe-NC组细胞中SNHG3 mRNA的表达比较,差异无统计学意义(P>0.05);与sh-NC组比较,sh- SNHG3组细胞中SNHG3 mRNA的表达明显降低(P<0.05);与oe-NC组比较,oe- SNHG3组细胞中SNHG3 mRNA的表达明显升高(P<0.05,图1、图2)。

图1 荧光显微镜观察慢病毒感染后MDA-MB-453细胞发光情况(×200)

图2 RT-PCR检测MDA-MB-453细胞中SNHG3 mRNA表达与sh- NC组比较,*P<0.05;与oe-NC组比较,#P<0.05
2.SNHG3对MDA-MB-453细胞增殖的影响:与对照组比较,sh-NC组和oe-NC组细胞活力和克隆形成数比较,差异无统计学意义(P>0.05);与sh-NC组比较,sh- SNHG3组细胞活力和克隆形成数明显降低(P<0.05);与oe-NC组比较,oe- SNHG3组细胞活力和克隆形成数明显升高(P<0.05,图3)。

图3 SNHG3对MDA-MB-453细胞增殖的影响A.CCK-8检测MDA-MB-453细胞活力;B.克隆形成实验检测MDA-MB-453细胞增殖能力;与sh-NC组比较,*P<0.05;与oe-NC组比较,#P<0.05
3.SNHG3对MDA-MB-453细胞Hedgehog通路的影响:Western blot法检测各组细胞中Gli1蛋白表达,与对照组比较,sh-NC组和oe-NC组细胞中Gli1蛋白表达比较,差异无统计学意义(P>0.05);与sh-NC组比较,sh- SNHG3组细胞中Gli1蛋白表达明显降低(P<0.05);与oe-NC组比较,oe- SNHG3组细胞中Gli1蛋白表达明显升高(P<0.05,图4)。

图4 Western blot法检测SNHG3对MDA-MB-453细胞Hedgehog通路的影响与sh- NC组比较,*P<0.05;与oe-NC组比较,#P<0.05
4.cyclopamine对MDA-MB-453细胞Hedgehog通路的影响:20μmol/L和40μmol/L的 cyclopamine可明显抑制细胞活力(P>0.05),因此,后续实验中cyclopamine的使用浓度为10μmol/L。与oe-NC组比较,oe- SNHG3组细胞中SNHG3 mRNA表达和Gli1蛋白表达明显升高(P<0.05);与oe- SNHG3组比较,oe- SNHG3+cyclopamine组细胞中SNHG3 mRNA表达比较,差异无统计学意义(P>0.05),Gli1蛋白表达明显降低(P<0.05,图5)。

图5 cyclopamine对MDA-MB-453细胞Hedgehog通路的影响A.CCK-8检测MDA-MB-453细胞活力;B.RT-PCR检测MDA-MB-453细胞中SNHG3 mRNA表达;C.Western blot法检测MDA-MB-453细胞中Gli1蛋白表达;与0μmol/L组比较,*P<0.05;与oe-NC组比较,#P<0.05;与oe- SNHG3组比较,ΔP<0.05
5.cyclopamine对MDA-MB-453细胞增殖的影响:与oe-NC组比较,oe- SNHG3组细胞活力和克隆形成数明显升高(P<0.05);与oe- SNHG3组比较,oe- SNHG3+cyclopamine组细胞活力和克隆形成数明显降低(P<0.05,图6)。
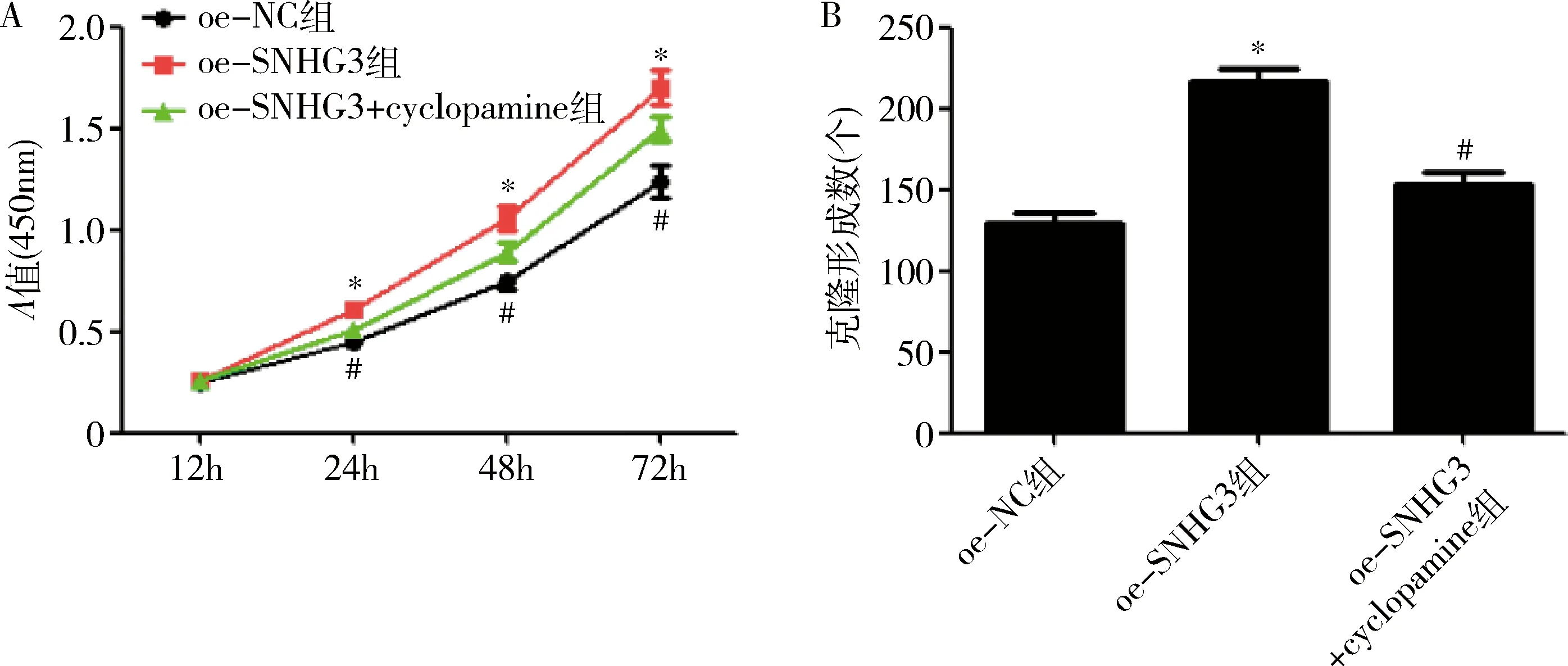
图6 通路抑制剂cyclopamine对MDA-MB-453细胞增殖的影响A.CCK-8检测MDA-MB-453细胞活力;B.克隆形成实验检测各组MDA-MB-453细胞增殖能力;与oe-NC组比较,*P<0.05;与oe- SNHG3组比较,#P<0.05
讨 论
在世界范围内,乳腺癌是影响女性的最常见癌症,浸润性导管癌是最常见的肿瘤亚型,其发生率呈逐年上升趋势[9]。虽然随着早期发现的普及和手术、化放疗、内分泌治疗及分子靶向药物治疗等综合治疗的开展,乳腺癌患者病死率有所下降,但仍有相当一部分患者无法从现有的治疗模式中获益,而最终出现复发转移[10]。目前乳腺癌发生、发展的分子机制尚不明确,因此深入研究其机制,探索更多的靶点,对于乳腺癌的治疗及降低复发率等具有重要的意义。
LncRNAs主要由RNA聚合酶Ⅱ转录,但不能翻译成蛋白质[11]。研究表明,lncRNAs在多种生物学过程中发挥着重要作用,包括转录、翻译和表观遗传学[12]。LncRNAs可作为肿瘤抑制基因和癌基因,影响细胞增殖、凋亡、分化、侵袭、迁移和免疫反应抑制等过程[13]。此外,lncRNAs可作为肿瘤早期诊断的分子标志物和肿瘤治疗的新靶点[14]。SNHG3是一种致癌LncRNA[15]。目前的研究表明,SNHG3可通过多种机制促进癌症的发生、发展和预后[16]。研究表明,SNHG3在乳腺癌组织中高表达。SNHG3通过激活Notch信号通路,促进乳腺癌细胞的增殖和转移[17]。此外,敲低SNHG3通过miR-326/ITGA5轴和抑制Vav2/rac1信号通路抑制了三阴性乳腺癌细胞的恶性发展[18]。本研究结果显示,敲低SNHG3可抑制乳腺癌细胞活力和克隆形成数,而过表达SNHG3可促进乳腺癌细胞活力和克隆形成数。该研究结果表明,SNHG3在乳腺癌中是一个促癌因子。
Hedgehog信号通路通过信号级联发挥其生物学效应,最终导致胶质瘤相关癌基因(glioma-associated oncogene,Gli)转录因子激活型和抑制型之间的平衡改变[19]。Gli作为一种多功能转录因子,包括Gli1、Gli2和Gli3 3个成员,其中Gli1是转录激活因子[20]。在乳腺癌的相关研究中,Hedgehog信号通路的激活对乳腺癌的进展具有重要意义[21]。目前,已有证据显示,LncRNA SNHG6通过激活Hedgehog信号通路促进胆囊癌细胞的上皮-间充质转化、细胞增殖和侵袭[22]。目前虽无法证明SNHG3与Hedgehog信号通路的相关性,但Pandolfi等[23]研究发现在人类黑色素瘤中,E2F1与Patched1、Gli1和Gli2的表达显著相关。E2F1是Hedgehog信号的重要介体,它是激活Hedgehog通路诱导黑色素瘤生长所必需的。Shi 等[24]通过实验证明了E2F1可激活SNHG3,促进非小细胞肺癌细胞增殖和迁移。以上研究结果说明SNHG3和Hedgehog信号通路之间可能呈相关性。本研究结果显示,敲低SNHG3可抑制乳腺癌细胞中Gli1的蛋白表达,而过表达SNHG3可促进乳腺癌细胞中Gli1的蛋白表达。进一步实验结果显示,在过表达SNHG3的乳腺癌细胞中,Hedgehog通路抑制剂cyclopamine可明显抑制Gli1的蛋白表达,抑制细胞活力和克隆形成数。该研究结果表明,SNHG3通过激活Hedgehog通路在乳腺癌细胞中发挥促肿瘤作用。
综上所述,敲低SNHG3通过抑制Hedgehog通路活化抑制乳腺癌细胞增殖,而过表达SNHG3通过激活Hedgehog通路促进乳腺癌细胞增殖。该研究结果为明确乳腺癌的发病机制及开发乳腺癌治疗靶点提供了新的研究策略。

