气体过饱和对不同早期发育阶段鲫的影响研究
吴凡 魏念 杜开开 柳凌 倪朝辉 李云峰

摘要:汛期长江流域大坝的泄洪可能导致下游水体气体过饱和,干扰或损害下游水生生物的正常生命活动。为了研究水体气体过饱和对长江流域重要经济鱼类鲫的影响,将处于不同早期发育阶段(受精卵、仔鱼、稚鱼和幼鱼)的鲫(Carassius auratus)暴露于气体饱和度分别为110%,120%,130%和140%的水体中,其中受精卵暴露至出膜,仔鱼、稚鱼和幼鱼均暴露96 h。结果表明:受精卵的孵化率变化范围为61.43%~72.86%,实验组与对照组之间孵化率无显著差异;仔鱼、稚鱼和幼鱼实验组均出现不同程度的气泡病症状;实验组死亡率随饱和度和暴露时间的增加而升高;相同饱和度下幼鱼死亡率最高,稚鱼次之,仔鱼最低;随着饱和度的升高,幼鱼的半致死时间显著减少。
关 键 词:气体过饱和;鲫;早期发育阶段;半致死时间;长江流域
中图法分类号:S931.3
文献标志码:A
文章编号:1001-4179(2021)09-0052-06
DOI:10.16232/j.cnki.1001-4179.2021.09.009
0 引 言
水体里气体压力超过大气压力时会产生气体过饱和的现象[1],光合作用[2]、海浪[3]、温度[4]以及大坝泄洪[5]均有可能造成这种现象。大坝泄洪时,下游气体过饱和水体中的气体释放缓慢,过饱和持续时间长,影响面积大[6-7]。已有研究表明,暴露于气体过饱和水体的鱼类会患气泡病[8],患病鱼类表现出生長缓慢、游动异常、体表出血、鳍条有气泡等症状[9],死亡率也增加[10]。
气体过饱和对河流生态系统的影响已成为全球关注的环境问题[11-12]。美国、挪威和加拿大均出现由大坝泄洪产生的气体过饱和水体导致的下游鱼类大量死亡的事件[13-15],相关研究发现鱼类的死亡率随水体里气体饱和度增加而升高[16]。为保护生存在大坝下游的水生生物,美国限定河流水体的气体饱和度阈值不超过110%[17]。我国在长江上游规划和建设了一批高水头大坝[18],观测发现,这些大坝在泄洪时,下游水体的气体饱和度普遍能达到130%以上[19]。2014年,溪洛渡大坝泄洪期间,下游约有40 t鱼类死亡,这可能是由下游水体气体过饱和导致[20]。对长江鱼类的研究发现,不同尺寸的鱼对气体过饱和的耐受性存在差异[21],且不同气体饱和度的水体对鱼类的致死效应也不同[22]。近年来,国家越来越重视长江生态环境以及鱼类资源的保护,随着长江流域水电开发程度逐步提高,气体过饱和仍将是今后很长时间内需要重视和解决的环境问题,且气体过饱和对鱼类早期发育阶段的影响研究相对较少。本文将研究气体过饱和对鲫早期发育的4个阶段(受精卵、仔鱼、稚鱼和幼鱼)的影响,分析各早期发育阶段鲫对不同饱和度的气体过饱和水体的耐受性。
1 材料和方法
1.1 实验材料
本次实验所使用的鲫受精卵、仔鱼、稚鱼以及幼鱼均取自长江水产研究所荆州窑湾实验场。其中受精卵为受精后1 h;仔鱼为出膜后3 d;稚鱼为出膜后20 d;幼鱼体长为(3.65±0.26)cm,体重为(1.57±0.38)g。
1.2 实验设备
气体过饱和水体是通过压力作用将空气溶入水中所形成[24]。将气体过饱和水体与地下水在实验桶(半径0.4 m,长1.2 m)中混合形成实验所需的饱和度分别为110%,120%,130%和140%的气体过饱和水体。实验过程中通过温控系统和气体饱和度调节装置来控制实验桶中水温变化不超过±0.5 ℃,气体饱和度不超过±1%/4 h。实验过程中溶解氧和水温由美国哈希公司生产的HQ30D测定仪测定,气体饱和度由丹麦Oxyguard公司生产的Handy Polaris TGP测定仪检测,使用日本奥林巴斯公司生产的Olympus SZ61解剖镜对受精卵以及鱼体特征进行观察,拍摄软件为ToupView 4.10。
1.3 气体过饱和暴露实验
实验设对照组和实验组,对照组用水为地下水,气体饱和度为(93.7±3.5)%,实验组水体气体饱和度分别为110%,120%,130%以及140%,各饱和度均设3组平行样。实验中,水温控制在适宜的孵化和生长的范围内[25-26]。
将受精卵(每组70颗)置于金属笼(直径15.0 cm×高16.5 cm,小孔直径0.1 cm)中,然后放入各实验桶中。金属笼位于水面下5.0 cm。暴露实验持续至对照组中的受精卵出膜,水温为(19.3±0.5)℃。每4 h调节一次各实验水体的气体饱和度,通过解剖镜观察受精卵的各项特征,同时记录实验结束时对照组和各实验组的出膜个数。
将仔鱼(每组30尾)置于塑料网盒(长6.0 cm×宽4.0 cm×高8.0 cm,网目40)中,然后分别放入实验桶中。塑料网盒位于水面下5.0 cm。暴露实验持续96 h,水温为(18.9±0.4)℃。每4 h调节一次各实验水体的气体饱和度,观察并记录仔鱼的异常行为以及死亡个体数,通过解剖镜和软件观察并拍摄死亡仔鱼的症状。
将稚鱼(每组30尾)置于金属笼(直径15.0 cm×高16.5 cm,小孔直径0.1 cm)中,然后分别放入实验桶中,金属笼位于水面下5.0 cm。暴露实验持续96 h,水温为(21.7±0.4)℃。每4 h调节一次各实验水体的气体饱和度,观察并记录稚鱼的异常行为以及死亡个体数,通过解剖镜和软件观察并拍摄死亡稚鱼的症状。
将幼鱼(每组15尾)置于金属笼(直径16.5 cm ×高18.0 cm,小孔直径0.4 cm)中,然后分别放入实验桶中。金属笼位于水面下5.0 cm。暴露实验持续96 h,水温为(22.9±0.5)℃。每4 h调节一次各实验水体的气体饱和度,观察并记录幼鱼的异常行为以及死亡个体数,通过解剖镜和软件观察并拍摄死亡幼鱼的症状。
1.4 数据统计
实验数据计算与分析均在EXCEL2016中进行,具体分析方法如下。
孵化率=出膜个体数/总孵化个体数,采用单因素方差分析来检验实验组和对照组孵化率之间的差异。
死亡率用于评估受不同水平的气体饱和水的实验性鱼类的死亡过程,计算方法:p=n/N×100%,其中p是实验鱼的死亡率,n是死鱼的数量,N是实验鱼的总数。采用单因素方差分析来检验实验组之间死亡率的差异。
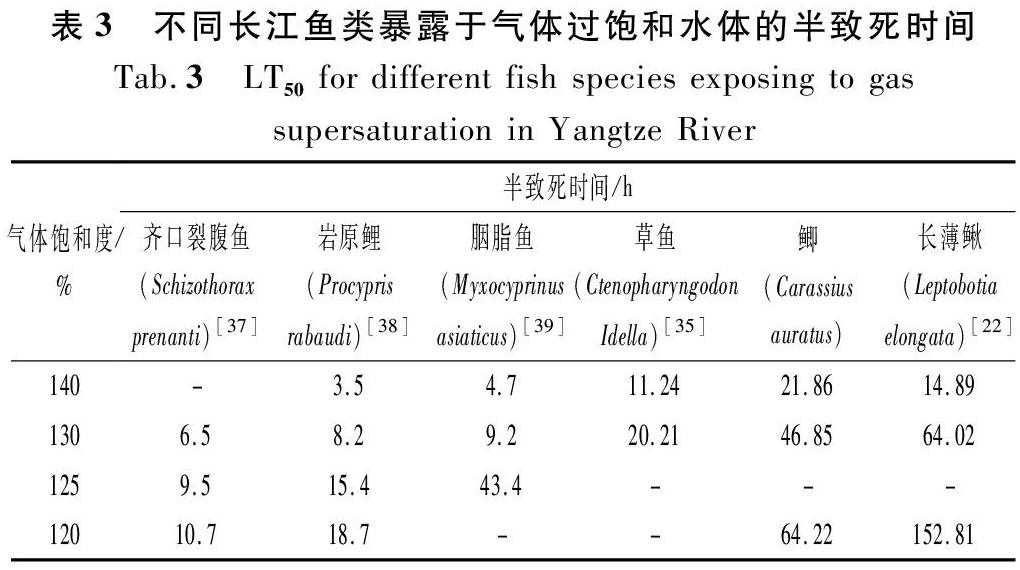
半致死时间(semi-lethal time,LT50)用于确定实验鱼对气体过饱和水的耐受性。通过致死时间对数值拟合回归线,死亡率的概率单位值计算:P=a lg(t)+b,其中P为概率单位,a和b分别为回归线的斜率和截距,t为实验鱼的致命时间。当概率单位P值为0.5时的时间即为LT50。采用单因素方差分析来检验实验组之间LT50的差异。
2 实验结果与分析
2.1 鲫受精卵的暴露实验
受精卵孵化率范围为61.43%~72.86%。方差分析结果表明,实验组与对照组孵化率之间无显著差异(P>0.05)(见图1)。解剖镜下观察发现各饱和度下的受精卵发育情况与对照组一致,未观察到异常。
2.2 鲫仔鱼、稚鱼、幼鱼的暴露实验结果
解剖镜下观察发现,仔鱼、稚鱼和幼鱼均有不同程度的气泡病症状(见图2)。仔鱼主要表现为腹部有气泡(见图2(a));稚鱼腹部膨大,解剖后发现肠道内有气泡(见图2(b));幼鱼眼眶周围、鳃和鳍条上均有气泡,腹鳍基部充血,解剖发现内脏团和肠道内有大量气泡(见图2(c))。
图3(a)表明,气体饱和度110%的水体中仔鱼均未发生死亡,饱和度120%,130%和140%的仔鱼死亡率增加极缓慢。实验结束时,各饱和度的仔鱼死亡率均未超过10%。图3(b)表明,气体饱和度140%水体中的稚鱼在24 h内开始出现死亡,饱和度130%的稚鱼在24~32 h开始出现死亡,饱和度120%的稚鱼在32~40 h开始出现死亡,饱和度110%的稚鱼在72~80 h才开始出现死亡。0~80 h各饱和度下稚鱼的死亡率增长较慢,80 h后死亡率加速上升。图3(c)表明,气体饱和度140%和130%水体中的幼鱼在8 h内开始出现死亡,饱和度120%和110%的幼鱼在8~16 h内开始出现死亡。其中饱和度140%下幼鱼的死亡率增长最快,72 h死亡率达100%;其次为饱和度130%和120%;饱和度110%下幼鱼的死亡率在0~72 h增长缓慢,72~80 h死亡率加速上升,80 h后死亡率增长速度减缓。结果表明,饱和度越高实验鱼出现死亡的时间越早,且鲫仔鱼、稚鱼和幼鱼在各气体饱和度的死亡率随暴露的时间推延而增高。
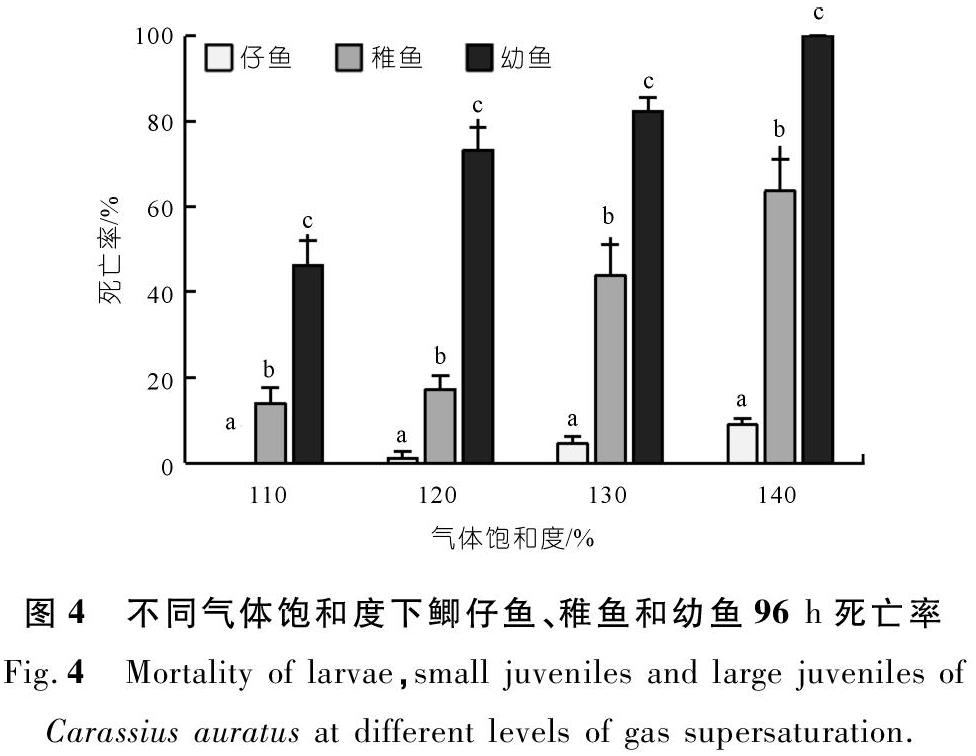
不同饱和度下,仔鱼、稚鱼和幼鱼的96 h死亡率差异显著(P<0.05),同样饱和度下,仔鱼到幼鱼的死亡率呈增加趋势(见图4)。暴露96 h后,气体饱和度110%,120%,130%和140%的仔鱼死亡率分别为0,1.11%,4.56%和9.13%,稚鱼的死亡率分别为14.12%,17.31%,43.78%和63.59%,幼鱼的死亡率分别为46.11%,73.22%,82.33%和100%(见表1)。结果表明,随着气体饱和度的升高,实验组的死亡率显著增加。
2.3 鲫幼鱼的半致死时间
由于鲫仔鱼和稚鱼(除饱和度140%外)在实验结束时还有一半以上的实验鱼存活,因此本文不做其半致死时间计算。表2显示鲫幼鱼半致死时间结果,饱和度110%,120%,130%和140%下鲫幼鱼半致死时间均值分别为104.68,64.22,46.85 h和21.86 h。随着饱和度的升高,实验鱼的半致死时间逐渐减少。结果表明,水体中的气体饱和度越高对实验鱼的致死效应越强。
3 讨 论
气体过饱和暴露实验结果表明,水体气体过饱和对鲫受精卵的孵化无显著影响,与Gale等[27]实验结果一致。Gale等研究发现大马哈鱼的受精卵对水体气体过饱和表现出较强的耐受性,且实验组的鱼卵重量、直径以及孵化率与对照组相比均未出现明显的差异。
本次研究结果表明,相同饱和度下,鲫从仔鱼到稚鱼再到幼鱼的死亡率逐渐升高。Weitkamp等[28]研究也表明,从出膜的仔鱼发育到幼鱼阶段,鱼类对气体过饱和的耐受性逐渐降低。这可能与鱼类从仔鱼发育到幼鱼,呼吸方式从皮肤呼吸逐渐转变为鳃呼吸[29]有关。在鱼类鳃形成前,氧气主要是通过皮肤扩散到卵黄囊的微血管中,这些血管中充满了含氧和脱氧的混合血液[30]。当血管中氧气局部压力较低时,血管内气泡形成所需的气体饱和度更高,而当血管内氧气局部压力升高时,则容易在血管内形成气泡[31]。在鳃呼吸开始之前,仔鱼微血管中混合血液的氧气局部压力相对较低,可能会降低血管内气泡形成的概率[32]。随着鱼类的生长,皮肤呼吸转变为鳃呼吸,氧气通过鳃进入动脉中,动脉中的氧气局部压力增加,高于仔鱼微血管中的氧气局部压力[31]。因此,当幼鱼暴露于气体过饱和水体时,动脉血管内气泡形成的概率增加,血栓的形成加速,从而增加了鱼类的死亡率。解剖镜观察结果(见图2)表明,仔鱼仅在腹腔内有气泡,稚鱼腹腔膨大、肠道内有气泡,而幼鱼在头部、鳍条、内脏团以及肠道内均有气泡。气泡存在部位的差异可能与鱼类在仔鱼和稚鱼阶段时,水体里的气泡被误食进入肠道然后扩散至腹腔内存在一定关联,但在幼鱼阶段,由于鳃以及循环系统的发育,水体里的气泡可通过鳃进入血液运输到鱼体各组织器官。
研究结果同时也表明,鲫死亡率随水体中的气体饱和度升高而增加,与Xue等[21]研究结果一致。其他研究人员也发现,随着水体气体饱和度的升高,实验鱼的死亡时间逐渐缩短[33],耐受性逐渐降低[34-55]。这可能是由于氣体饱和度越高,鱼类误食水体中气泡的机率越大。食入的气泡可逐渐在肠道内积累,并通过扩散作用进入腹腔,导致鱼类腹腔膨大,从而使鱼体失去平衡,游动异常。同时气体饱和度越高,动脉血管中形成气泡的概率越大[31],气泡逐渐堆积形成血栓,导致鱼类因血液流动停滞而窒息死亡。另外,有研究表明气体饱和度升高会导致鱼体内血红蛋白的表达量下降[36]。血红蛋白是血细胞中运输氧气和二氧化碳的重要部分,其表达量下降可能会影响血液里氧气的吸收和二氧化碳的排出,这些未能及时处理的气体在血管内堆积,进一步加速了血栓的形成,最终加剧鱼类死亡。
將鲫幼鱼在各气体饱和度水体的半致死时间与部分长江重要鱼类进行对比(见表3),结果表明不同鱼类对气体过饱和的耐受性存在差异,鲫相较其他鱼类(长薄鳅除外)具有更强的耐受性。大坝泄洪时下游水体处于过饱和状态,长期暴露于此环境可能威胁鱼类生命安全。因此,建议开展更多有关气体过饱和对鱼类影响的研究,为了解鱼类对气体过饱和的生理和行为反应机制以及建立气体过饱和度的评价体系提供基础资料。
4 结 论
(1)从受精卵到幼鱼阶段,气体过饱和水体对鲫的致死效应逐步增加。
(2)在孵化阶段,气体饱和度的变化对鲫受精卵的孵化无明显影响;在仔鱼、稚鱼和幼鱼阶段鲫死亡率随着气体饱和度的升高而增加。
参考文献:
[1] WILLIAMS J G.Mitigating the effects of high-head dams on the Columbia River,USA:experience from the trenches[J].Hydrobiologia,2008,609(1):241-251.
[2] BOYD C E,WATTEN B J,GOUBIER V,et al.Gas supersaturation in surface waters of aquaculture ponds[J].Aquacultural engineering,1994,13(1):31-39.
[3] STICKNEY A P.Supersaturation of atmospheric gases in the coastal waters of the Gulf of Maine[J].Fish Bulletin,1968,67(3):117-123.
[4] KRISE W F,SMITH R A.Communications:Eye abnormalities of lake trout exposed to gas supersaturation[J].The Progressive Fish‐Culturist,1993,55(3):177-179.
[5] GALE W L,MAULE A G,POSTERA A,et al.Acute exposure to gas‐supersaturated water does not affect reproductive success of female adult chinook salmon late in maturation[J].River Research Applications,2004,20(5):565-576.
[6] FENG J,LI R,LIANG R,et al.Eco-environmentally friendly operational regulation:an effective strategy to diminish the TDG supersaturation of reservoirs[J].Hydrology Earth System Sciences,2014,18(3):14355-14390.
[7] CRUNKILTON R L,CZARNEZKI J M,TRIAL L.Severe gas bubble disease in a warmwater fishery in the midwestern United States[J].Transactions of the American Fisheries Society,1980,109(6):725-733.
[8] MAY B.Evaluation on the effects of gas bubble disease on fish populations in the Kootenai River below Libby Dam[C]∥Proceedings of the 53rd Annual Conference Western Association of State Fish and Game Comnfissioners,1973:525-540.
[9] WANG Y M,LI Y,AN R D,et al.Effects of total dissolved gas supersaturation on the swimming performance of two endemic fish species in the upper Yangtze River[J].Scientific reports,2018,8(1):1-9.
[10] DAWLEY E M,EBEL W J.Effects of various concentrations of dissolved atmospheric gas on juvenile chinook salmon and steelhead trout[J].Fishery Bulletin,1975,73(4):777-796.
[11] KAMAL R,ZHU D Z,MCARTHUR M,et al.Field study on the dissipation of supersaturated total dissolved gases in a cascade reservoir system[C].World Environmental and Water Resources Congress 2016,2016:452-460.
[12] WITT A,STEWART K,HADJERIOUA B.Predicting total dissolved gas travel time in hydropower reservoirs[J].Environmental Engineering,2017,143(12):06017011.
[13] CHEN Y B,PENG Q D,LIAO W G.The evolvement study on supersaturation of dissolved gas in the middle reaches of Yangtze River after the Three Gorges project running[J].Hydroecol,2009,2(5):1-5.
[14] STENBERG S K.Effects of gas supersaturation on migrating Atlantic salmon smolt (Salmo salar)in Evangervatnet[D].Bergen:The University of Bergen,2016:87.
[15] BROSNAN I G,WELCH D W,SCOTT M J.Survival rates of out-migrating yearling Chinook salmon in the lower Columbia River and plume after exposure to gas-supersaturated water[J].Aquatic Animal Health,2016,28(4):240-251.
[16] LI N,FU C,ZHANG J,et al.Hatching rate of Chinese sucker (Myxocyprinus asiaticus Bleeker)eggs exposed to total dissolved gas (TDG)supersaturation and the tolerance of juveniles to the interaction of TDG supersaturation and suspended sediment[J].Aquaculture Research,2019,50(7):1876-1884.
[17] Us Army Corps of Engineers.Technical Analysis of TDG Processes[M].Kansas City:US Army Corps of Engineers-Northwest Division,Environmental Resources and Fish Planning Oces,2005:367.
[18] HUANG H L,YAN Z.Present situation and future prospect of hydropower in China[J].Renewable Sustainable Energy Review,2009,13(6-7):1652-1656.
[19] LI R,LI J,LI K F,et al.Prediction for supersaturated total dissolved gas in high-dam hydropower projects[J].Science in China Series E:Technological Sciences,2009,52(12):3661-3667.
[20] JI Q F,XUE S D,YUAN Q,et al.The tolerance characteristics of resident fish in the upper Yangtze River under varying gas supersaturation[J].Environmental Research Public Health,2019,16(11):1-13.
[21] XUE S D,WANG Y M,LIANG R F,et al.Effects of total dissolved gas supersaturation in fish of different sizes and species[J].Environmental Research Public Health,2019,16(13):2444.
[22] 袁嫄,袁佺,王遠铭,等.总溶解气体过饱和对长薄鳅的急性和慢性致死效应研究[J].四川大学学报:工程科学版,2017(增2):56-61.
[23] 张政,肖柏青.高坝下游水中总溶解气体过饱和研究进展[J].人民长江,2020,51(4):14-19.
[24] 吴凡,杜开开,柳凌,等.气体过饱和对草鱼和鲢受精卵、仔鱼和幼鱼的影响[J].淡水渔业,2020,50(4):91-98.
[25] 夏飞利.彭泽鲫的人工繁殖技术[J].农村实用工程技术:温室园艺,1996(8):17.
[26] 祝玮.浅谈鲫鱼生长发育的影响因素[J].北京农业,2011,15:110.
[27] GALE W L,MAULE A G,POSTERA A,et al.Acute exposure to gas-supersaturated water does not affect reproductive success of female adult chinook salmon late in maturation[J].River Research Applications,2004,20(5):565-576.
[28] WEITKAMP D E,KATZ M.A review of dissolved gas supersaturation literature[J].Transactions of the American Fisheries Society,1980,109(6):659-702.
[29] 施瑔芳.鱼类生理学[M].北京:农业出版社,1991:56.
[30] DETTLAFF T A,GINSBURG A S,SCHMALHAUSEN O I.Sturgeon fishes:developmental biology and aquaculture[M].Berlin:Springer Science & Business Media,2012:153.
[31] FIDLER L E.A study of biophysical phenomena associated with gas bubble trauma in fish[D].Vancouver:University of British Columbia,1985:62.
[32] COUNIHAN T D,MILLER A I,MESA M G,et al.The effects of dissolved gas supersaturation on white sturgeon larvae[J].Transactions of the American Fisheries Society,1998,127(2):316-322.
[33] ALDERDICE D F,JENSEN J O T.An explanation for the high resistance of incubating salmonid eggs to atmospheric gas supersaturation of water[J].Aquaculture,1985,49(1):85-88.
[34] JENSEN J O T,SCHNUTE J,ALDERDICE D.Assessing juvenile salmonid response to gas supersaturation using a general multivariate dose-response model[J].Fisheries Aquatic Sciences,1986,43(9):1694-1709.
[35] FAN Z Q,DENG Y X,YUAN Q,et al.Effect of total dissolved gas supersaturation on the tolerance of grass carp (Ctenopharyngodon idellus)[J].Environmental Sciences Europe,2020,32(5):1-10.
[36] 董曉煜,张秀梅,张沛东.溶解氧与养殖密度对褐牙鲆幼鱼血细胞数量及血红蛋白含量影响的研究[J].渔业科学进展,2008,29(6):40-46.
[37] WANG Y M,LI K F,LI J,et al.Tolerance and avoidance characteristics of Prenant′s schizothoracin Schizothorax prenanti to total dissolved gas supersaturated water[J].Fisheries Management,2015,35(4):827-834.
[38] HUANG X,LI K F,DU J,et al.Effects of gas supersaturation on lethality and avoidance responses in juvenile rock carp (Procypris rabaudi Tchang)[J].Zhejiang University Science B,2010,11(10):806-811.
[39] CHEN S C,LIU X Q,JIANG W,et al.Effects of total dissolved gas supersaturated water on lethality and catalase activity of Chinese sucker (Myxocyprinus asiaticus Bleeker)[J].Zhejiang University Science B,2012,13(10):791-796.
(编辑:黄文晋)

