不同剩余采食量的蛋鸭盲肠微生物组成及多样性研究
杨 速 白 天 操勇清 黄学涛 陈斌丹 王武强 沈军达 田 勇 李国勤 陶争荣 陈 黎 赵阿勇 卢立志 曾 涛*
(1.浙江师范大学化学与生命科学学院,金华 321004;2.浙江省农业科学院畜牧兽医研究所,杭州 310021;3.浙江农林大学动物科技学院,杭州 311300;4.甘肃农业大学动物科学技术学院,兰州 730000;5.诸暨市国伟禽业发展有限公司,绍兴 311800;6.缙云县农业农村局,丽水 321400)
近年来,我国蛋鸭育种工作有些突破,但蛋鸭的饲料利用率相较于鸡和肉鸭仍然较低,而饲料成本在现代家禽生产中约占总成本的70%[1],因此研究有效提高蛋鸭饲料利用率的技术体系及其机制,对提升我国蛋鸭生产养殖水平和产业科技发展具有重要意义。Koch等[2]提出的剩余采食量(residual feed intake,RFI)是目前衡量家禽饲料利用率的理想选择指标。RFI指维持机体代谢过程和生产所需的期望采食量与实际采食量的差值[3]。研究表明,RFI能通过有效的个体选择进行改良[4-6]。Faure等[7]以RFI为选育指标,经过对大白猪6个世代的选育之后,平均日增重相同(760 g/d),但低RFI组比高RFI组平均日采食量减少216 g/d,饲料转化率提高11.7%。Bordas等[8]对产蛋鸡的饲料利用率进行了17代选育后发现,低RFI组的孵化率比高RFI组高30%。研究发现,选择低RFI的番鸭饲养至7周龄可提高饲料利用率[9]。本团队前期研究发现,蛋鸭RFI与采食量(FI)、饲料转化率呈极显著的正相关,表明在蛋鸭育种中选择低RFI的蛋鸭能够提高饲料利用率[10-11]。
肠道微生物与宿主的相互作用所构成的肠道微生物系统越来越受到关注,肠道微生物对宿主的影响包括代谢、免疫和行为等[12-13]。其中,肠道微生物对家禽营养吸收的影响是畜牧学研究的热点之一。家禽肠道较短,食糜排空快,但在盲肠中停留时间较长,以供微生物发酵[14]。与其他肠段相比,家禽盲肠中微生物数量最多,产生的非淀粉多糖酶可将小肠无法消化吸收的非淀粉多糖发酵成短链脂肪酸,对促进营养物质吸收和提高饲料转化率至关重要[15-16]。除了可以发酵饲料中难以消化的成分,某些肠道微生物也可以通过产生抗炎代谢物促进肠道健康,保证肠道正常功能,从而提高营养物质的消化吸收[17]。对不同动物的大量研究表明,肠道微生物与饲料利用率存在相关性。在猪方面,高饲料利用率的猪肠道微生物有更多利用食物中多糖和蛋白质的能力,其可能通过发酵多糖产生挥发性脂肪酸(volatile fatty acid,VFA)改善肠道健康,进而提高猪的饲料利用率[18]。在反刍动物方面,Guan等[19]研究发现,高RFI和低RFI组牛瘤胃微生物菌群结构存在显著差异;肠道菌群中的琥珀酸菌属、优杆菌属等与RFI相关,其可能的作用机理是通过参与VFA的合成与吸收,调节宿主的能量代谢,进而影响机体RFI[20]。在家禽方面,不同饲料利用率肉鸡在6个分类水平上优势菌群种类一致,但相对丰度存在差异[21];不同产蛋率下肉鸡肠道菌群存在差异,并进而影响肉鸡繁殖性能[22];在产蛋鸡上,盲肠微生物多样性较十二指肠和粪便微生物多样性高,对饲料利用率发挥着重要作用[23]。这些研究结果表明,畜禽RFI与肠道微生物群落多样性及菌群组成、功能存在一定的联系。因此,本研究旨在通过比较不同RFI蛋鸭个体的盲肠微生物组成,筛选候选差异菌群,为今后通过调控肠道菌群提高蛋鸭饲料利用率提供思路。
1 材料与方法
1.1 试验动物和基础饲粮
试验选取400日龄的绍兴鸭300只,由绍兴市诸暨市国伟禽业绍兴鸭国家级保种场提供。采用3层梯形式笼舍进行单笼饲养,每个笼位用隔板隔开,以避免因相互啄食饲料而造成试验误差。基础饲粮选用产蛋鸭高峰期颗粒状配合饲料(蛋倍利),购自上海香川饲料有限公司。预试期10 d,正试期60 d(410~470日龄),期间纪录每个个体的采食量、平均蛋重(EML)、初始体重(IBW)、终末体重(FBW),并计算每个个体的增重(GW)和代谢体重(BW0.75)。
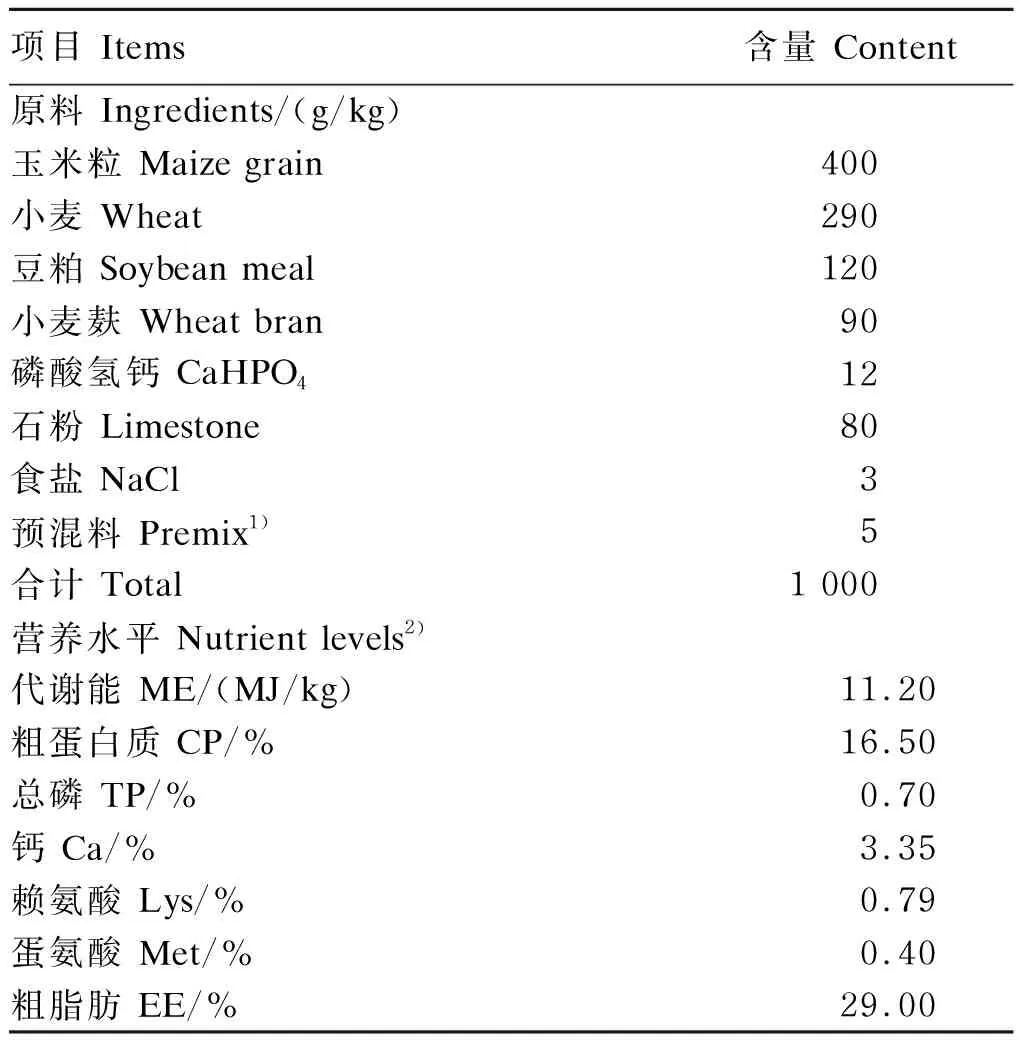
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis)
1.2 RFI测定
RFI测定利用多元线性回归方程计算个体RFI并排序,选取RFI最高和最低的各15只鸭,分别为高RFI组(HRFI组)和低RFI组(LRFI组),屠宰后采集盲肠内容物,置于-80 ℃超低温冰箱保存。
RFI模型如下:
RFI=FI-(μ+a×BW0.75+b×GW+c×EML)[24]。
式中:FI为采食量;μ为截距;a、b、c为偏回归系数;BW0.75为代谢体重;GW为增重;EML为平均蛋重。
1.3 肠道微生物检测
使用德国QIAGEN公司的QIAamp Fast DNA Stool Mini试剂盒提取盲肠微生物总DNA。经DNA质检过后,HRFI组共提取到有效样本13个,LRFI组共提取到有效样本11个。以提取的基因组DNA为模板,根据测序区域选择带有barcode的特异引物,使用上游引物(F341:5′-CCTACGGGNGGCWGCAG-3′)和下游引物(R805:5′-GACTACHVGGGTATCTAATCC-3′)对细菌V3+V4区进行PCR扩增。PCR扩增程序为:95 ℃预变性2 min;95 ℃变性45 s,55 ℃退火30 s,72 ℃延伸30 s,共28个循环;72 ℃延伸7 min。将PCR扩增所获得的产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,于-20 ℃保存。后续测序由浙江天科高新技术发展有限公司完成。本试验采用QIIME2(2019.4)、R语言等软件对盲肠微生物进行Alpha多样性分析,采用主坐标分析(PCoA)、主成分分析(PCA)和无度量定标(MNDS)法进行Beta多样性分析,采用STAMP软件分析组间差异菌群。
1.4 数据统计分析
采用Excel 2019和SPSS 22.0对所有数据进行整理和统计分析,采用t检验和Wilcox秩和检验。试验结果采用“平均值±标准误”(mean±SE)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同RFI蛋鸭生产性能比较
由表2可知,HRFI组RFI、采食量极显著高于LRFI组(P<0.01),2组之间RFI差值达到了63.35 g/d,采食量差值达到了57.00 g/d。HRFI组料蛋比极显著高于LRFI组(P<0.01)。2组之间增重、平均蛋重、产蛋率和体重均无显著差异(P>0.05),说明RFI的高低对蛋鸭体重、增重、平均蛋重和产蛋率没有显著影响。
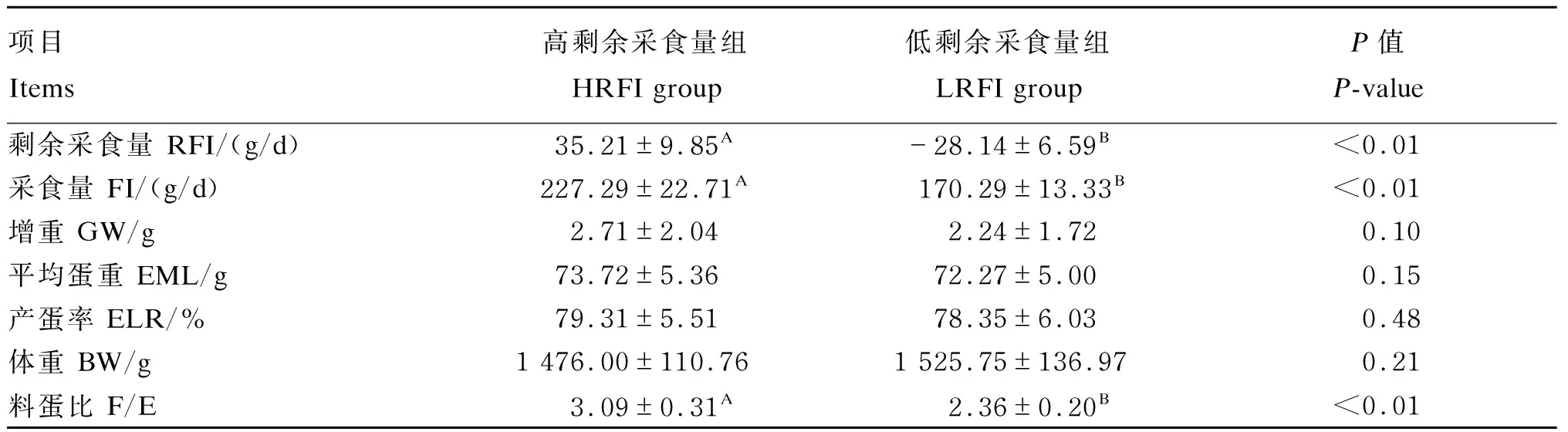
表2 不同RFI蛋鸭生产性能比较Table 2 Comparison of performance of laying ducks with different RFI
2.2 Alpha多样性分析
2.2.1 稀释曲线和相对丰度等级曲线
由图1可知,稀释曲线图中,HRFI组各样本稀释曲线较LRFI组短且更平缓,说明LRFI组物种相对丰度较HRFI组高。相对丰度等级曲线图中,LRFI组相对丰度等级曲线在垂直方向上较为平缓且在水平方向上跨度较大;HRFI组各样品相对丰度等级曲线在垂直方向上与LRFI组差异不大,在水平方向上跨度均较小,说明LRFI组相对丰度等级较HRFI组高,但物种分布均匀度差异不大。
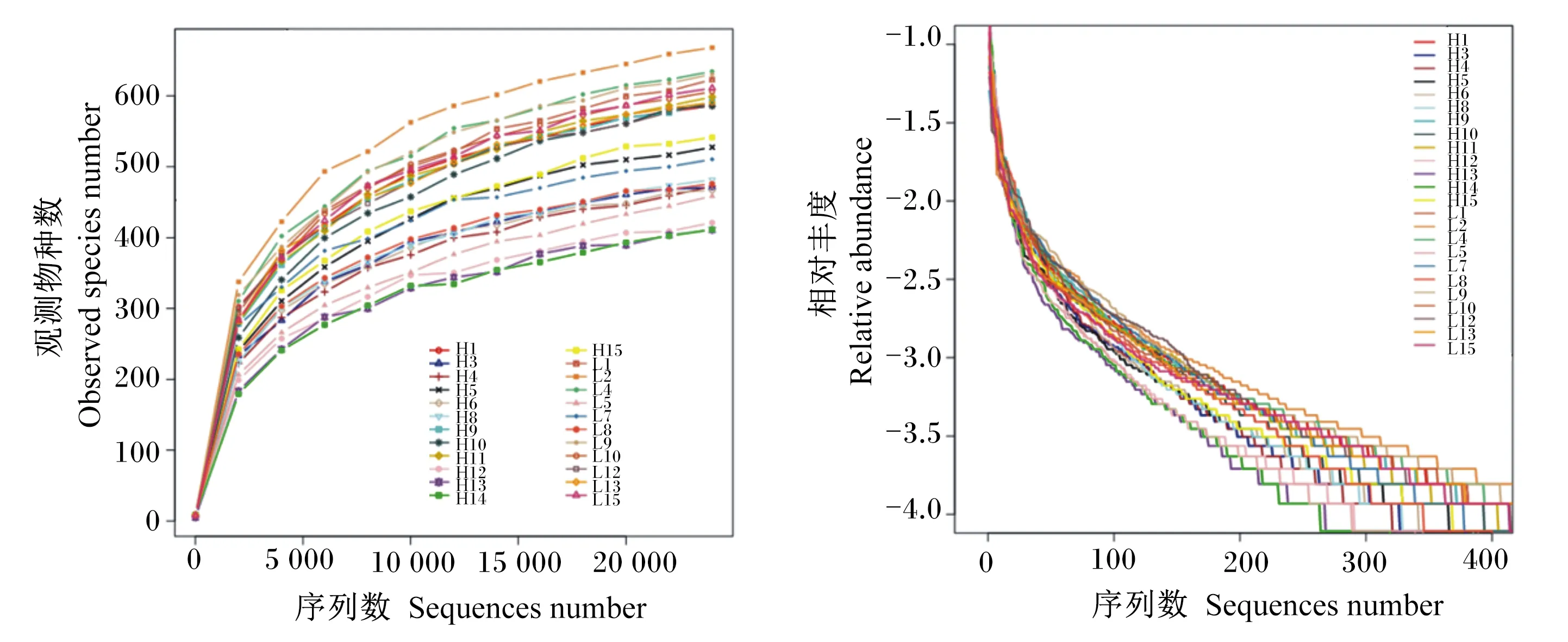
H:高剩余采食量组 HRFI group;L:低剩余采食量组 LRFI group。
2.2.2 Alpha多样性指数分析
由图2可知,LRFI组Chao1指数显著高于HRFI组(P=0.018 9),说明LRFI组在菌群丰富度上高于HRFI组;LRFI组Shannon指数显著高于HRFI组(P=0.025 7),说明LRFI组菌群多样性高于HRFI组;HRFI组和LRFI组Simpson指数均高于0.95,并且LRFI组高于HRFI组(P>0.05),说明HRFI组和LRFI组的组内菌群多样性和均匀度均较高。
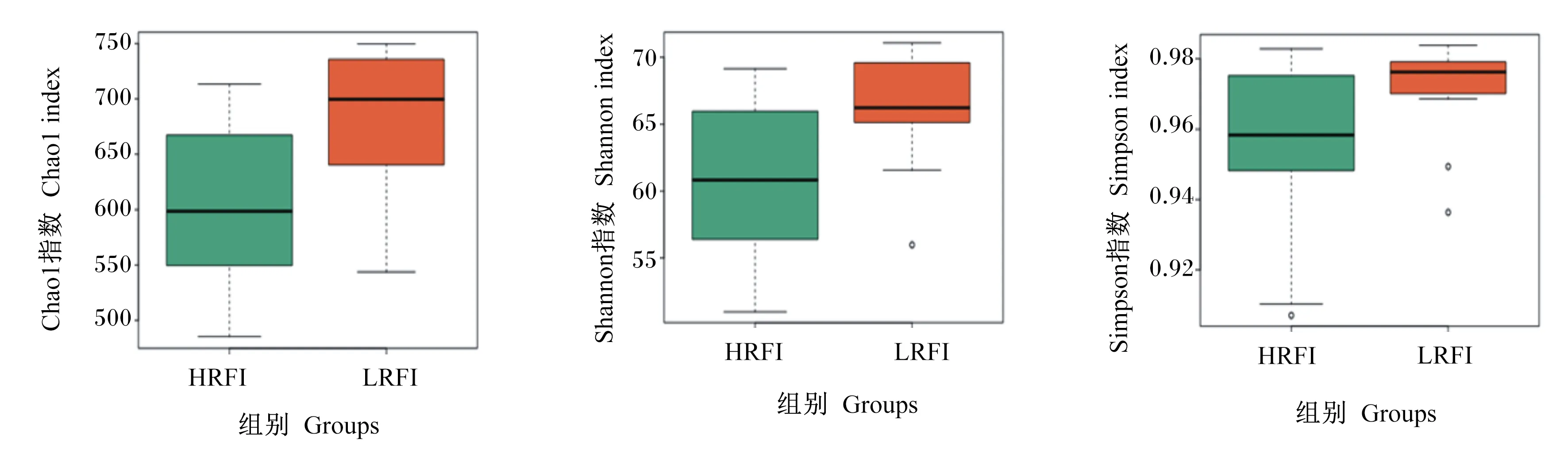
图2 不同RFI组盲肠微生物Alpha多样性Fig.2 Alpha diversity of cecal microorganisms of different RFI groups
2.2.3 Beta多样性分析
由图3可知,由PCoA图可见,HRFI组与LRFI组的微生物群落分离明显,表明2组样本菌群结构存在差异,主坐标1占比55.57%,主坐标2占比13.25%;由PCA图可见,主成分1占比12.17%,主成分2占比8.69%;由NMDS图可见,落在<0.2内的点占绝大多数,表明数据分析可靠性高。

图3 不同RFI组PCoA、PCA和NMDS图Fig.3 PCoA, PCA and NMDS figures of different RFI groups
2.3 微生物群落结构分析
2.3.1 门水平上菌群结构
由图4可知,在门水平上,LRFI组蛋鸭肠道优势菌群为厚壁菌门(Firmicutes),HRFI组优势菌群为变形菌门(Proteobacteria),而拟杆菌门(Bacteroidetes)在2组中差异较小。2组物种相对丰度排名前5的菌群包括Bacteroidetes(50.6%)、Firmicutes(31.43%)、Proteobacteria(7.17%)、梭杆菌门(Fusobacteria)(4.06%)和脱铁杆菌门(Deferribacteres)(2.00%)。其中,HRFI组Proteobacteria、Fusobacteria、Deferribacteres和Bacteroidetes相对丰度较LRFI组高,分别高2.12%、1.53%、1.31%和0.99%;而LRFI组仅Firmicutes相对丰度较HRFI组高,高4.75%。
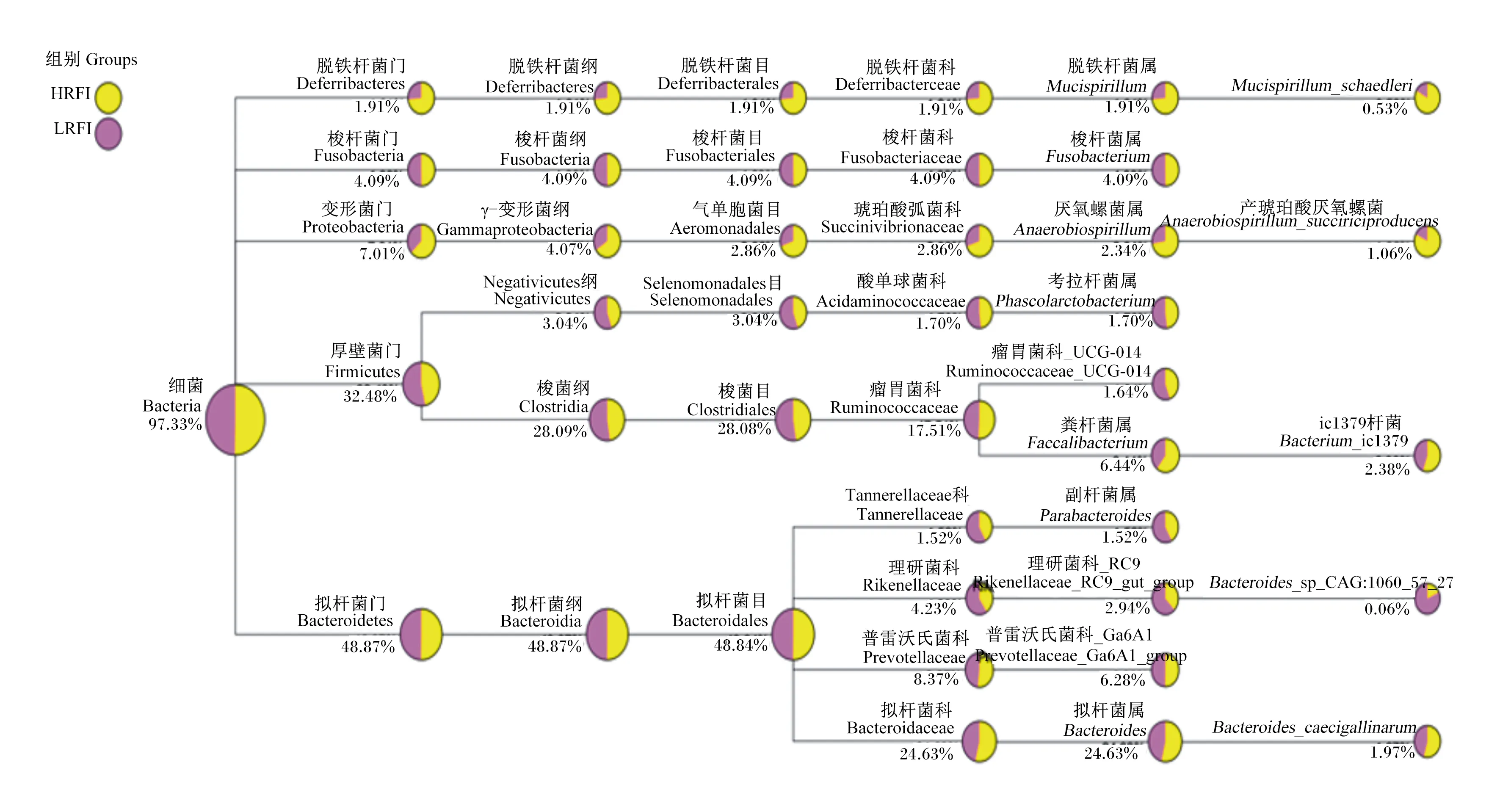
图4 HRFI组和LRFI组门水平优势菌群Fig.4 Dominant flora of HRFI group and LRFI group at phylum level
2.3.2 属水平上菌群结构
根据操作分类单元(OTUs)结果在属水平对2组排名前10的微生物菌属进行分析。由图5可知,2组相对丰度排名前10的微生物菌属组成相同,包括拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)、普雷沃氏菌科_Ga6A1(Prevotellaceae_Ga6A1_group)、梭杆菌属(Fusobacterium)、理研菌科_RC9(Rikenellaceae_RC9_gut_group)、厌氧螺菌属(Anaerobiospirillum)、脱铁杆菌属(Mucispirillum)、考拉杆菌属(Phascolarctobacterium)、瘤胃菌科_UGG-014(Ruminococcaceae_UCG-014)和副杆菌属(Parabacteroides)。其中,HRFI组Bacteroides、Faecalibacterium、Anaerobiospirillum、Mucispirillum和Fusobacterium相对丰度均高于LRFI组,分别高3.71%、2.68%、2.09%、1.81%和1.53%;而LRFI组其余5个菌属总相对丰度比HRFI组高1.57%,其他未知微生物菌属相对丰度比HRFI组高7.90%。
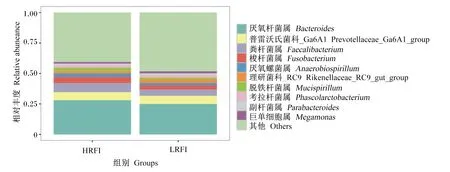
图5 HRFI组和LRFI组属水平上排名前10的微生物菌属Fig.5 Top 10 microorganism genus in HRFI group and LRFI group at genus level
2.4 不同RFI个体盲肠菌群差异分析
为分析HRFI组和LRFI组的差异菌群,进行组间t检验。由图6可知,在属水平,共有18个差异菌群,其中HRFI组仅有支原体属(Mycoplasma)相对丰度极显著高于LRFI组(P<0.01);LRFI组中,Rikenellaceae_RC9_gut_group、产粪甾醇真杆菌([Eubacterium]_coprostanoligenes_group)、瘤胃菌科_UGG-010(Ruminococcaceae_UCG-010)、巴氏杆菌(Barnesiella)、瘤胃球菌属_2(Ruminococcus_2)、乳梭菌属(Lachnoclostridium)、瘤胃菌科_NK4A214(Ruminococcaceae_NK4A214_group)、瘤胃菌科_UCG-009(Ruminococcaceae_UCG-009)、斯莱克氏菌属(Olsenella)、艾伯森杆菌属(Eisenbergiella)、互营球菌属(Syntrophococcus)、艾诺玛菌属(Enorma)、大肠杆菌-至贺氏菌属(Escherichia-Shigella)、小纺锤状菌属(Fusibacter)相对丰度显著高于HRFI组(P<0.05),克里斯滕森菌科_R-7(Christensenellaceae_R-7_group)、颤杆菌克属(Oribacterium)、乳头杆属(Papillibacter)相对丰度极显著高于HRFI组(P<0.01)。
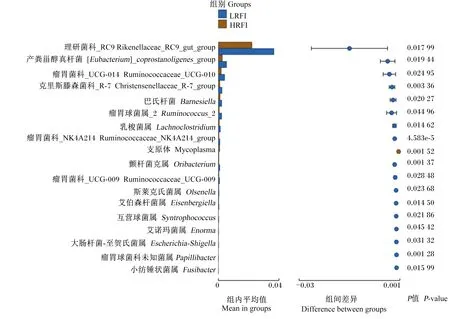
图6 属水平上HRFI组和LRFI组组间菌群差异分析Fig.6 Analysis of bacterial community differences between HRFI and LRFI groups at genus level
3 讨 论
3.1 不同RFI对蛋鸭生产性能的影响
本研究显示,HRFI组蛋鸭采食量、RFI和料蛋比均极显著高于LRFI组,而RFI对蛋鸭体重、增重、平均蛋重、产蛋率均无显著影响。之前在绍兴鸭和缙云麻鸭上的研究表明,RFI与采食量呈极显著正相关[10],而在北京肉鸭上的研究表明,RFI与采食量、饲料转化率呈中度正相关[25],这与本研究结果一致。对奶牛的研究表明,RFI最低的个体比RFI最高的个体节约了15%的饲料[26],而选育低RFI的肉牛也能达到显著减少饲料消耗的目的[27]。对羊的研究表明,RFI与干物质采食量呈显著正相关,而RFI对羊体重、平均日增重等无显著影响[28],这与本研究结果一致。
3.2 不同RFI对蛋鸭盲肠微生物多样性的影响
大量研究表明,畜禽的生产性能、饲料利用率和RFI与肠道微生物的组成存在相关性。本研究将同一场地内相同饲养管理条件且遗传背景相似的绍兴鸭分成HRFI和LRFI组,通过比较盲肠微生物多样性和差异菌群,尝试在盲肠微生物与RFI之间建立联系。对猪[29-31]和鸡[21]肠道微生物与饲料转化率的关联研究表明,饲料转化率高的个体Alpha多样性更高或趋于更高。本研究中,丰富度曲线、Chao1指数、Shannon指数和Simpson指数均表明LRFI组菌群Alpha多样性高于HRFI组,与之前的研究结果一致。
3.3 不同RFI对蛋鸭门水平上盲肠微生物结构的影响
本研究中,在门水平上,LRFI组蛋鸭肠道优势菌群为Firmicutes,HRFI组优势菌群为Proteobacteria,而Bacteroidetes在2组中差异较小。El等[32]研究表明,Firmicutes和Bacteroidetes为主要编码碳水化合物活性酶的菌群。肠道内Firmicutes与Bacteroidetes的比例(F/B)会影响宿主从食物中获取能量的能力[33]。对大鼠的研究表明,在食物诱导的肥胖个体中F/B更高[34]。肥胖人群中Bacteroidetes相对丰度高于较瘦人群,当持续减少摄入的热量,体重逐渐降低,Firmicutes相对丰度逐渐减小[35]。Firmicutes是不同RFI猪群肠道的主要差异菌群[36]。Han等[37]研究了不同体重断奶仔猪肠道菌群的差异,在体重较高的仔猪肠道中,Firmicutes对丰度高于体重较低的个体;相反,Bacteroidetes和Proteobacteria对丰度在体重较低的个体中更高。这与在人和哺乳动物上的研究结果相似,家禽盲肠中Firmicutes相对丰度与体增重[38]和产蛋性能[22]存在正相关。另一项研究表明,早期在鸡上使用抗生素会减少Firmicutes相对丰度,增加Proteobacteria相对丰度;在后期,低Firmicutes相对丰度的个体T细胞免疫活性降低[38],揭示了Firmicutes和Proteobacteria对宿主免疫功能的影响。
3.4 不同RFI对蛋鸭属水平上盲肠微生物结构的影响
在属水平上,HRFI组与LRFI组蛋鸭肠道菌群相对丰度排名前10的菌属相同,其中LRFI组Rikenellaceae_RC9_gut_group、Phascolarctobacterium和Parabacteroides相对丰度高于HRFI组。Rikenellaceae是产蛋鸡相对丰度最高的3个菌群之一[40],同时也是肉鸡[21]和猪[10]盲肠中的优势菌群,可以促进饲粮中蛋白质和碳水化合物的分解[41]。对大鼠的研究表明,在饲粮中添加高水平的脂肪,Phascolarctobacterium和Parabacteroides相对丰度随之升高,且二者的相对丰度可能与体增重、体脂率以及代谢水平的变化有关[42]。此外,Parabacteroides可以通过诱导抗炎因子的产生以及抑制炎症因子的分泌减少肠道炎症反应,维持肠道正常功能[17]。
3.5 不同RFI对蛋鸭盲肠微生物结构差异的影响
本研究中,HRFI组和LRFI组蛋鸭存在18个差异菌群,其中HRFI组仅Mycoplasma相对丰度显著高于LRFI。之前的研究显示,Mycoplasma将碳水化合物作为主要能量物质,且在正常饲喂条件下哺乳动物肠道中很少见Mycoplasma[43],猪粪便中Mycoplasma相对丰度与丁酸含量呈正相关[29],膳食纤维组仔猪肠道菌群中Mycoplasma相对相对丰度显著降低,表明Mycoplasma可能与宿主竞争性利用碳水化合物,且不能帮助代谢不易消化吸收的膳食纤维,进而影响宿主饲料利用率。其余17个差异菌群中12个为厚壁菌门,2个为拟杆菌门。其中厚壁菌门的[Eubacterium]_coprostanoligenes_group[30,44]、瘤胃菌科(Ruminococcaceae)[30,42]、克里斯滕森菌科(Christensenellaceae)[36]和瘤胃球菌属(Ruminococcus)[45]对促进宿主消化吸收营养物质或提高饲料利用率有积极作用。
4 结 论
LRFI组蛋鸭盲肠微生物多样性较高,2组菌群结构存在差异。门水平上,LRFI组蛋鸭盲肠优势菌群为Firmicutes,HRFI组优势菌群为Proteobacteria;属水平上,LRFI组Christensenellaceae_R-7_group、Oribacterium、Papillibacter等17个菌群相对丰度高于HRFI组,而HRFI组仅Mycoplasma相对丰度高于LRFI组。

