FSH受体抑制剂对卵巢发育及FSHR和ERβ表达水平研究
巩转娣,袁肇方,牛宇辉,张向博,3,魏锁成,3
(1.西北民族大学 医院,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;3.西北民族大学 生物医学研究中心,甘肃 兰州 730030)
癌症的早期诊断是提高患者生存率的关键因素[1].卵泡刺激素受体(Follicle-stimulating hormone receptor,FSHR)的表达水平与卵巢癌,特别是上皮性卵巢癌(Epithelial ovarian cancer,EOC)的发生密切相关[2].FSHR过度表达与EOC细胞中潜在致癌途径的增加有关.因此,抑制FSHR过度表达可能减缓EOC的发生[1,4].研究FSHR在卵巢癌治疗过程中水平变化可能会提供新的治疗方案和诊断的准确性[3].雌激素受体β(Estrogen receptor β,ERβ)介导雌激素发挥生理作用.ERβ可以增强ERα介导的激素依赖性癌细胞的增殖[5],因此,ERβ的水平与卵巢癌发生相关[6].
FSHR结合抑制剂(FSHR binding inhibitor,FRBI)最初从绵羊和人的卵泡液中分离得来,是一种8肽[7].FRBI可阻断FSH与FSHR的结合,并在受体水平改变FSH的作用.体内给予FRBI可抑制排卵,并引起小鼠卵泡闭锁.前期研究认为FRBI可以调控绵羊卵丘细胞复合体(Cumulus-oocyte complexes,COCs)中FSHR和促黄体素受体 (luteinizing hormone receptor,LHR)的mRNA和蛋白表达水平,同时增加绵羊COCs雌二醇(Estradiol,E2)的产生[8].然而,关于FRBI对卵巢癌患者FSHR与ERβ水平及E2分泌的影响作用和机制鲜少报道[9].迄今为止,尚不清楚FRBI是否会影响与卵巢癌发生相关的FSHR和ERβ基因和蛋白的表达水平[7,10].基于此,本研究假设FSH受体结合抑制剂(FRBI)能够影响卵巢发育,改变组织中FSHR和ERβ的表达水平.通过实验研究,初步探明FRBI通过改变卵泡中FSHR和ERβ表达水平来抑制癌症发生的作用与机制.
1 材料和方法
1.1 材料
1.1.1 试剂 FRBI(南京肽业生物技术有限公司合成),TRIzol试剂(美国Invitrogen公司),小鼠雌二醇ELISA试剂盒(武汉华美生物工程有限公司),引物由北京奥科鼎盛生物科技有限公司合成.
1.1.2 实验动物 SPF级23~25日龄雌性小白鼠180 只,体质量(22.3±1.52) g[兰州大学动物实验中心,合格证号: SCXK (Gansu) 2005-0007].
1.2 实验方法
1.2.1 实验动物处理 所有小鼠经过10天的实验室适应期后,随机分为FRBI处理组、FSH处理组和对照组(CG)(n=30).FRBI组小鼠再次分为FRBI-1,FRBI-2和FRBI-3,FRBI-4组.分别以10、20、30和40 mg/kg体重的剂量肌内注射FRBI(表1),连续五天,每天1次.FSH组小鼠连续5天肌内注射10 IU FSH,每日1次,作为阳性对照组.对照组小鼠肌内注射0.2 mL生理盐水,连续5天,每天1次,作为空白对照组.每天早上(上午8点至9点)进行注射.

表1 小鼠实验分组设计
1.2.2 测量和样本收集 每组分别于第0、7、10、15、20和30天经尾静脉注射0.1 mg/kg二甲苯胺噻嗪麻醉后处死各5只小鼠.无菌收集卵巢,称重卵巢重量.在光学显微镜下,计数每个卵巢中次级卵泡数(SF,直径2~5 mm),平均值由左右卵巢计算.同时在第0、7、10、15、20和30天收集血样,血清分离后-20 ℃保存.
1.3 卵巢的测量
10%甲醛固定的卵巢,石蜡包埋,切片,并用H.E.染色.在光学显微镜下观察切片,计数次级卵泡.采集卵巢显微图像.使用Images Advanced 3.2和Image Pro Plus 2.0分别测量卵巢皮质的厚度(ovarian cortex thickness,OCT),次级卵泡的最大纵径(maximum longitudinal diameter,MLD) 和 最 大 横 径 (maximum transverse diameter,MTD).
1.4 FSHR和ERβ mRNA的实时RT-PCR(qRT-PCR)
用TRizol法从卵巢中提取总RNA,试剂盒反转录成cDNA ,再分别进行qRT-PCR分析.
1.4.1 引物设计 根据Beacon Designer 7.0软件设计FSHR特异性引物(NM_013523.3)和ERβ(NM_007956.4)以小鼠GAPDH(HM_043737.1 NM_008084.2)基因的表达作为内参基因[11].
用于qPCR的引物序列如下:FSHR (F: CGTCCTGATGAGCAAGTTTGG,R: TGGGCTGATTGACTTAGAGGG);ERβ (F: CTTGTGTGTGGACACTCCGT,R:AAGAAAGGCACAAGGCACGA),GAPDH (F: CTTCAACAGCGACACTCACTCT,R: CCACCACCCTGTTGCTGTA).
1.4.2 RNA提取及cDNA合成 根据产品使用说明,用TRIzol试剂提取卵巢样品总RNA.用上标TM Ⅲ第一链合成系统逆转录PCR(RT-PCR)合成cDNA.应用Nanodrop分光光度计对cDNA进行定量分析,再用去离子水稀释50倍,将其用作荧光定量RR-PCR(qPCR)的模板.
1.4.3 荧光定量RT-PCR(qPCR) GAPDH作内参基因ERβ和FSHR的相对定量采用2-ΔΔCt方法.
1.5 测定小鼠卵巢中ERβ和FSHR蛋白质
用Western blotting测定ERβ和FSHR蛋白在卵巢组织中的表达水平.将兔抗FSHR和ERβ多克隆抗体(1︰200)和β-肌动蛋白多克隆抗体(1︰1000)稀释并在4 ℃孵育过夜,与适当的第二抗体孵育1小时(1︰2000),加入免疫印迹化学发光试剂,显影.用凝胶图像分析仪扫描照片.用Quantity One 软件分析每个条带的吸光度值(A).FSHR条带的吸光度与β-actin条带吸光度值之比表示组织中 FSHR的相对含量.
1.6 测定血清雌二醇(E2)浓度
严格按照ELISA试剂盒的说明书进行操作,测定血清雌二醇(E2)浓度.标准曲线的相关系数为0.999 3,各组间的变异系数低于6%.
1.7 数据统计分析
统计分析采用SPSS 21.0软件.五组的所有变量均符合单向方差分析(ANOVA)的假设.分析后的数据再进行两两差异检验,P<0.05为差异显著.用Pearson进行相关性分析,以确定FRBI剂量与其他指标的相关性.
2 结果
2.1 卵巢皮质厚度(OCT)
与CG相比,FSH组的卵巢皮质厚度(OCT)增加(图1).FRBI组的OCT比CG和FHS组减少.在第30天,FRBI-4组的OCT低于FSH组(P<0.05).结果表明,高剂量FRBI(40 mg/kg)可以抑制小鼠的卵巢发育.

图1 卵泡雌激素受体结合抑制剂(FRBI)对小鼠卵巢皮质厚度的作用(×100)
2.2 卵巢次级卵泡的数目
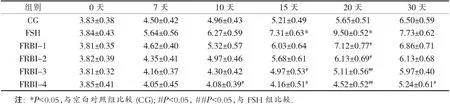
表2 不同时间点的次级卵泡数
表2数据显示,FSH组的次级卵泡数(SF)与CG相比增加,在第20天达到最大值(P<0.01).FRBI处理组的SF数量随着FRBI剂量而逐渐下降.在第15天,FRBI-3和FRBI-4组的次级卵泡数(SF)显著低于FSH组(P<0.05或P<0.01).表明较高剂量的FRBI(30和40 mg/kg)能够减弱FSH对卵泡发育的促进作用,导致卵泡成熟不良.
2.3 次级卵泡的纵径(MLD)和横径(MTD)
在整个实验中,四个FRBI组的MLD与FSH组、CG相比,呈剂量依赖性降低(图2).FRBI-4组的MLD在第20天和第30天显著低于CG和FSH组(P<0.05).与CG比较,在第20天,FRBI-3和FRBI-4组的MLD减少率分别为24.11%和27.47%.MTD结果与MLD类似,FRBI各组同样递减.结果表明,较高剂量的FRBI(40 mg/kg)处理小鼠后,可以阻滞卵泡发育.
2.4 FSHR mRNA在卵巢中的表达水平
为了评价FRBI对小鼠卵巢中FSHR mRNA表达的影响,用qPCR检测FSHR mRNA的水平.如图3所示,四个FRBI处理组小鼠卵巢中FSHR mRNA水平呈剂量依赖性的逐渐下降.第15天,与对照组(CG)相比较,FRBI-1、FRBI-2、FRBI-3和FRBI-4的FSHR mRNA水平分别降低7.94%、27.78%(P<0.05)、29.37%(P<0.05)和43.65%(P<0.01).结果表明,大剂量FRBI给药(30 mg/kg~40 mg/kg)可以抑制卵巢FSHR mRNA的表达.
2.5 ERβ和FSHR蛋白在卵巢中的表达水平
ERβ和FSHR蛋白在小鼠卵巢中表达见图4.与CG相比,FSH组ERβ和FSHR蛋白水平升高.第15天FSH组ERβ和FSHR蛋白水平高于CG组(P<0.05).4个FRBI处理小鼠的ERβ和FSHR蛋白水平与CG和FSH组相比逐渐下降.FRBI-4的ERβ蛋白水平在第20天时小于CG(P<0.05)(见图3).另外,FRBI-3和FRBI-4组ERβ蛋白水平在第10天后均低于FSH组(P<0.05或P<0.01).
在第10天、第15天和第20天,FRBI-4组的FSHR蛋白质水平低于CG.同时,FRBI-3和FRBI-4组的FSHR蛋白质水平显著低于FSH组(P<0.05或P<0.01)(见图5).结果显示,较高剂量FRBI(30 mg/kg或40 mg/kg)可以抑制小鼠卵巢中ERβ和FSHR蛋白的表达水平.

2.6 血清雌二醇(E2)
随着FRBI剂量的增加,FRBI处理组的血清E2浓度逐渐降低(表3),特别是在第15天和第20天,FRBI-2、FRBI-3和FRBI-4的E2浓度组均显著低于CG和FSH组(P<0.05或P<0.01).表明FRBI可以减少E2的合成与分泌.

表3 血清雌二醇浓度 (pg/mL)
2.7 Pearson相关性分析
如表4所示, Pearson相关性分析显示,FRBI给药剂量与所有其他检测指标呈显著负相关(P<0.05或P<0.01).然而,FSHR mRNA和ER蛋白的表达水平与OCT、MLD呈正相关(P<0.05).表明FRBI对卵巢和卵泡发育有明显的抑制作用.
3 讨论
FSHR主要在卵泡颗粒细胞中表达[8].FRBI阻断FSH与FSHR的结合,在受体水平上改变了FSH的作用[8,12].但是目前关于人类和动物中FSHR表达水平和卵巢癌的资料很少[10,13].
本研究通过观察不同剂量的FRBI对小鼠卵巢的作用,探讨FRBI对小鼠卵巢组织中FSHR和ERβ表达的影响,初步阐明FRBI通过改变FSHR水平来抑制癌症的疗效和ERβ.研究发现,FRBI组的卵巢皮质厚度(OCT)与CG、FHS组相比减少.FRBI-4组的OCT在第30天时低于FSH组,FRBI-3和FRBI-4组的次级卵泡数(SF)小于FSH组.在第20天,FRBI-3和FRBI-4组次级卵泡的最大横径(MTD)比CG组降低了24.11%和27.47%.此外,Pearson相关分析表明,FRBI的剂量与卵巢皮质厚度(OCT)、次级卵泡(SF)、卵泡最大纵径(MLD)、FSHR mRNAs和蛋白表达以及ERβ蛋白表达水平均呈负相关.因此,FRBI抑制卵泡的发育,导致次级卵泡数量减少[1,14].但是其作用机制还需要继续深入探究.
FSHR过度表达促进EOC细胞的增殖,因此抑制FSHR过表达有利于抑制EOC的肿瘤发生和发展[4,14].初步研究表明,在绵羊COCs中FRBI促进了E2产生[9].据报道,ERβ及其亚细胞定位可能在卵巢癌的发病机制中起关键作用[15].越来越多的研究表明,ERβ不仅与卵巢癌的发病机制有关,而且还与治疗反应有关[16-17].因此,卵巢癌细胞中的ERβ表达可能使该受体成为卵巢癌治疗中的潜在靶标[13,18].
先前的研究表明,在卵巢癌患者和动物模型中已经显示了ERβ表达与存活的正相关性[9,19].由于ERβ5过表达可通过FAK/c-Src活化增强卵巢癌细胞迁移、侵袭和增殖,ERβ的过表达抑制卵巢癌细胞的生长和迁移并诱导细胞凋亡[20].ERβ5是卵巢癌的潜在愈后指标和治疗靶点[9].然而,关于ERβ在卵巢和卵巢癌中作用机制报道很少[19].
研究结果表明,高剂量的FRBI可以抑制卵巢FSHR和ERβ在基因和蛋白水平的表达.FRBI组中随着FRBI剂量增加FSHR mRNA表达水平却在逐渐下降.在第15天,FRBI-2,FRBI-3和FRBI-4中FSHR mRNA分别减少27.78%、29.37%和43.65%.与CG和FSH组相比,FRBI处理后的小鼠ERβ和FSHR蛋白水平逐渐降低.在第20天,FRBI-4组的ERβ蛋白水平小于CG组.因此,FRBI抑制卵巢组织中ERβ蛋白的过度表达,从而抑制了卵巢癌的癌变.我们的研究结果与初始报告相似[10-11].这些发现可能是FRBI在受体水平上干扰FSH-FSHR复合物[21],这为研究抗癌治疗提供了新思路.
卵巢癌是一种激素反应性癌症,60%~100%的卵巢癌都表达雌激素受体(ERs).在卵巢癌患者中,E2的浓度通常比正常水平高100~1 000倍.E2浓度增加可以刺激卵巢上皮细胞的增生和恶性变化,导致卵巢的肿瘤发生[22-23].迄今为止,关于FRBI对卵巢卵泡中E2分泌影响的文献鲜见[10,23].本研究表明,FRBI-2、FRBI-3和FRBI-4组的E2浓度均低于CG和FSH组,即FRBI可以降低小鼠E2合成与分泌,这与文献报道相一致[23],其详尽机理有待深入研究.
4 结论
FRBI可以减少小鼠卵巢皮质厚度(OCT)和次级卵泡数量,较高剂量的FRBI(30 mg/kg和40 mg/kg)可抑制卵巢和卵泡发育,降低卵巢内ERβ、FSHR mRNA和蛋白的表达水平,并抑制E2分泌.FRBI的剂量与卵巢皮质厚度、次级卵泡、卵泡最大纵径、FSHR mRNAs和蛋白表达以及ERβ蛋白表达水平呈显著负相关.我们的研究结果为FRBI的抗癌作用提供了一定的科学依据.

