鸟嘌呤核苷酸交换因子在胃癌组织中的表达及其临床意义
胡欣雨 姚晖 夏冬 Sami UL Haq Niazi
在我国,胃癌的发病率仅次于肺癌,死亡率排第3位,全球每年胃癌新发病例约120万,中国约占40%。早期胃癌病人的生存率能达到90%,但早期胃癌缺乏特异性症状与体征,导致其早期检出率较低。我国早期胃癌的检出率仅10% 左右,严重影响病人的预后[1]。有研究表明,肿瘤的浸润、转移与病人的预后密切相关,取决于肿瘤迁移和侵袭中信号通路的失调。Rap蛋白(Ras-associated-Protein)是小GTP酶Ras家族中的一员,参与细胞黏附、细胞连接、侵袭、迁移等功能,同时又是细胞信号传递过程中多个信号通路交叉点的关键分子[2]。Rap鸟苷酸交换因子(guanine nucleotide exchange factors,GEFs)可从无活性的Rap1蛋白释放GDP,结合GTP从而激动Rap蛋白,促进其后续活化。Crk蛋白通过介导蛋白质复合物的形成在细胞信号通路中发挥重要作用,并已在多种肿瘤中发现其过表达促进了细胞的扩散及侵袭[3],其中C3G(Crk SH3-domain-binding guanine-nucleotide exchange factor)就是最普遍表达的Rap鸟苷酸交换因子。有研究表明,在肿瘤中C3G基因存在的一些突变与病人存活率的降低有关[4]。来自不同的公共基因数据库的信息显示,C3G表达水平在胃癌中有所增加。C3G可能可以作为一种新的胃癌诊断、预后标志以及一个新的治疗靶点。我们通过国外公共信息大数据分析C3G蛋白在胃癌组织及正常组织中的表达,采用免疫组化分析检测胃癌及癌旁组织中C3G的表达并分析其相关临床、病理资料,了解胃癌的发生、发展及预后是否与C3G的表达有相关性,探讨C3G在胃癌的发生、发展过程的作用。
对象与方法
一、对象
2012年12月~2015年12月我院就诊的符合纳入标准的胃癌病人121例。男性62例,女性59例;年龄≥60岁66例,<60岁55例;中-高分化腺癌76例,低分化腺癌45例;伴有淋巴结转移64例,无淋巴结转移57例;浸润深度T1-2 49例,T3-4 72例。收集所有符合纳入标准的胃癌病人的癌组织及癌旁组织(距离病灶组织距离至少5 cm以上的正常胃黏膜组织)。纳入标准:(1)一般临床资料及病理资料均保存完整;(2)术前均未接受放疗、化疗及生物治疗辅助治疗手段;(3)未合并其他系统恶性肿瘤;(4)手术方式为根治性切除术,术后病检确诊为胃癌;(5)术后接受常规随访,未失联。
二、方法
1.C3G的表达采用免疫组化法。病理组织蜡块经资深病理医师阅片确认后切片、烤片,用二甲苯常规脱蜡、水化,置于EDTA缓冲液中微波修复,5%BSA(牛血清白蛋白)封闭后加入一抗,4 ℃过夜,PBS溶液清洗后滴加相应种属的二抗,37 ℃孵育,其后每片加入50~100 ml DAB溶液,显色完全冲洗后苏木素复染,盐酸酒精分化,再次冲洗后氨水反蓝,流水冲洗,经过梯度酒精脱水干燥,二甲苯透明,中性树胶封固。显微镜下阅片,每张切片中含有的正常胃黏膜、炎性细胞等作为内对照,先使用低倍镜,后用高倍镜。结果判定:C3G阳性细胞为位于细胞质内的棕黄色颗粒或团块,且观察不少于5个高倍镜视野。当阳性染色的细胞≤10%时定为阴性表达,即弱表达;>10%为阳性表达。使用Image J软件计算其阳性面积及IOD值,分析所选病例癌组织及癌旁组织平均光密度(IOD/area)。
2.基因数据库分析:登陆Oncomine数据库(https://www.oncomine.org/)获取权限后按以下数据检索条件进行检索:(1)Gene:C3G(RapGEF1);(2)Analysis Type:CANCER vs NORMAL;(3)Cancer Type:gastric cancer。以上筛选条件均设置为p-Value:1E-4;Fold Change。
3.随访:采用电话与临床查阅病历的方式随访,记录所纳入研究的病人生存时间,随访日期截止至2020年8月10日,平均随访时间为55.10个月。
三、统计学方法
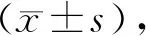
结果
1.基因数据库结果:根据检索条件搜索到6个数据集,筛选符合条件的研究数据(排除胃肠道肿瘤类别)。荟萃分析表明,与正常组织比较,C3G在胃癌组织中表达高于正常组织,差异有统计学意义(P<0.05)。见图1。

图1 Oncomine数据库中C3G在胃癌组织及癌旁组织中表达的荟萃分析
2.免疫组化染色:在胃癌及癌旁组织中,C3G蛋白阳性表达率分别为70%(112/160)及31.25%(50/160)。计算其平均光密度(IOD/area),C3G在肿瘤细胞中表达为(0.108±0.025),在癌旁组织中表达为(0.059±0.017),差异有统计学意义(P<0.05),证明C3G在胃癌组织中呈高表达。见图2、图3。
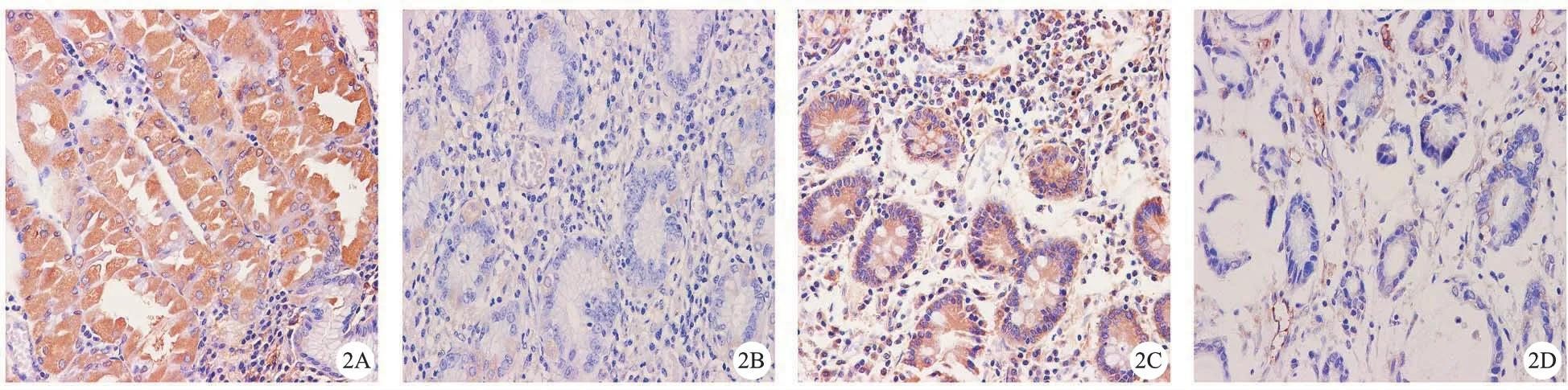
A:癌旁组织C3G阳性(苏木素染色×400);B:癌旁组织C3G阴性(苏木素染色×400);C:胃癌组织C3G阳性(苏木素染色×400);D:胃癌组织C3G阴性(苏木素染色×400)
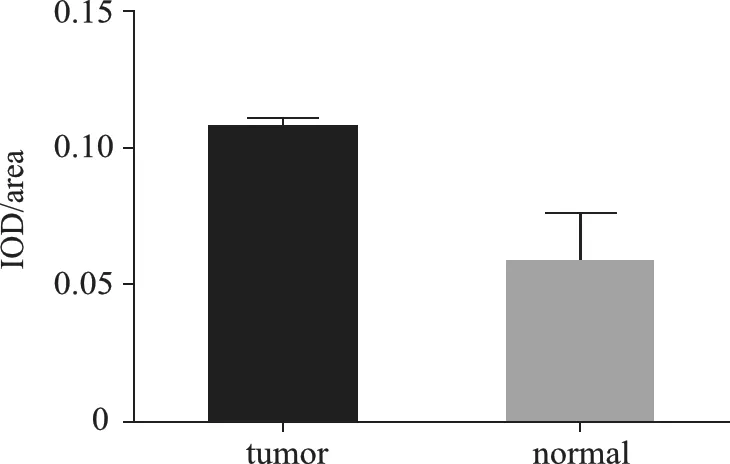
图3 C3G蛋白在胃癌组织及癌旁组织表达结果
3.C3G蛋白表达与胃癌病人预后的关系 :随访结果显示,截至2020年8月10日,C3G蛋白阳性表达68例,死亡30例,存活38例;C3G蛋白表达阴性53例,死亡8例,存活45例。通过Kaplan-Merier生存曲线分析,C3G蛋白阴性表达组平均生存时间为58.1个月(95%CI:56.2~59.9),C3G蛋白阳性表达组平均生存时间为53.7个月(95%CI:51.3~56.1),C3G蛋白阳性表达组生存结局劣于C3G蛋白阴性表达组,差异有统计学意义(P<0.05)。见图4。

图4 胃癌病人C3G蛋白阳性表达与阴性表达的总生存曲线
4.终点事件:以随访结束时,病人是否死亡为因变量,以C3G蛋白表达情况、年龄、性别、肿瘤浸润深度、肿瘤分化程度、淋巴结是否转移为自变量,通过χ2检验可知,与存活组比较,死亡组女性偏多,肿瘤浸润深、分化程度高、伴有淋巴结转移、C3G蛋白阳性表达的病人所占比例较高,差异有统计学意义(P<0.05)。见表1。
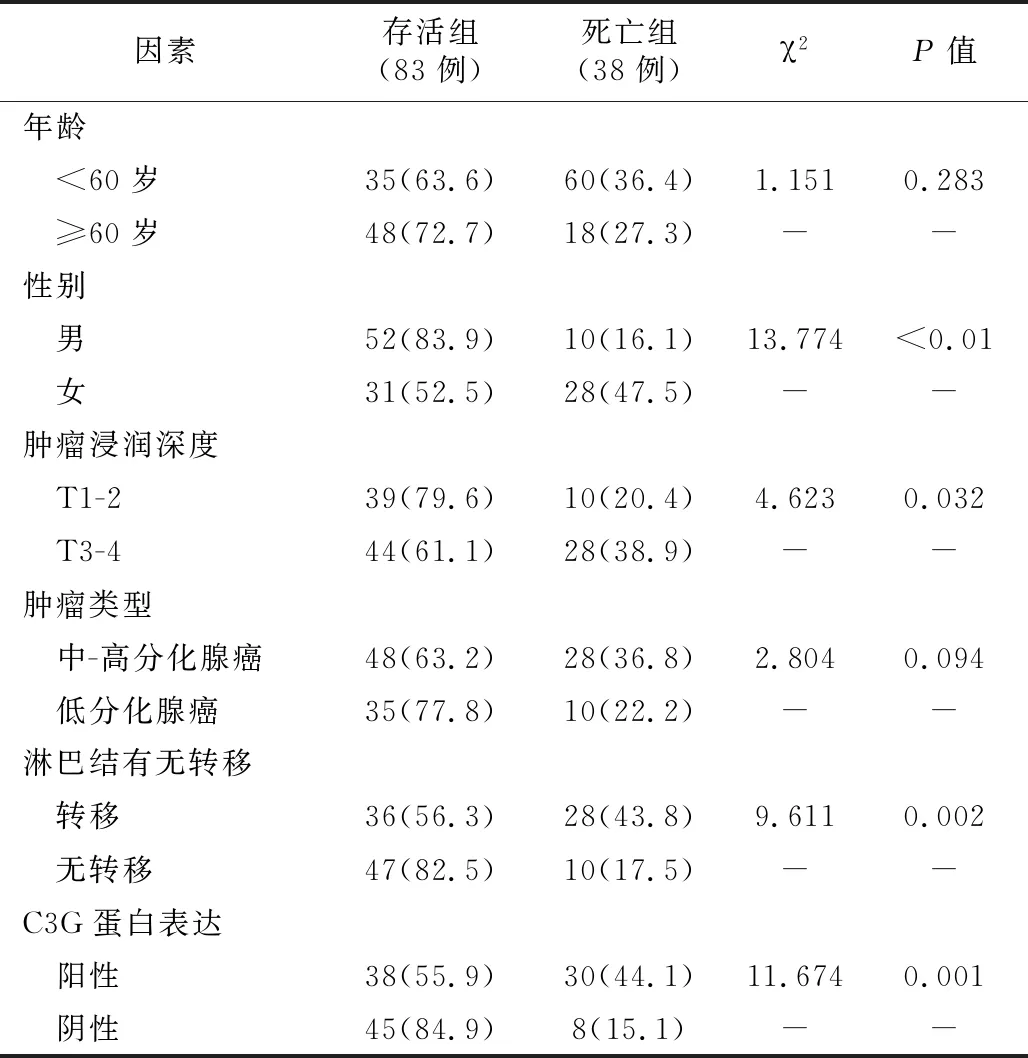
表1 存活组与死亡组临床、病理资料对比(例,%)
5.胃癌组织中C3G蛋白阳性表达与病人临床资料的关系: 单因素分析显示,性别、C3G蛋白阳性表达、肿瘤浸润深度及淋巴结是否转移是为影响胃癌病人死亡的独立危险因素(P<0.05)。根据单因素分析的结果进一步纳入风险比例回归模型分析,结果表明,蛋白的阳性表达、胃癌肿瘤浸润深度及淋巴结是否转移仍是有意义(P>0.05)。见表2、表3。

表2 影响胃癌病人死亡的单因素Cox分析
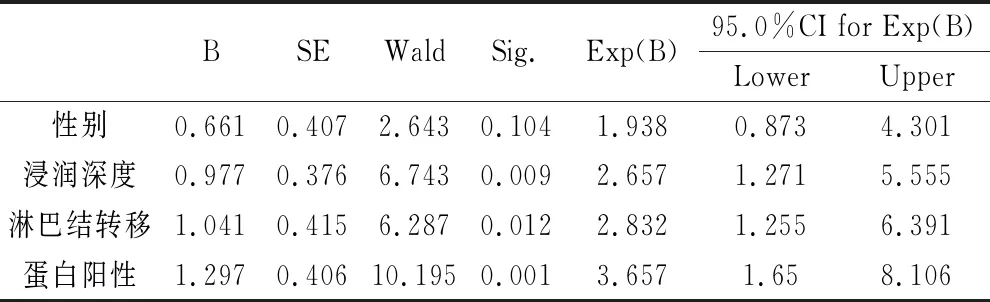
表3 影响胃癌病人死亡因素的多因素Cox分析
讨论
C3G,也称RapGEF1,作为Ras大家族中重要成员,如Rap1及R-Ras的鸟苷酸核酸因子[5],在癌症的发生发展中起重要作用。有研究表明,Rap 1通过抑制小GTP结合蛋白Ras到c-Raf-1的信号转导来抑制促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的活化[6-7],也可以通过B-Raf蛋白激活MAPK级联反应,同时也激活MAPK蛋白家族的其他成员,所以Rap1可以在不同的细胞环境中促进或抑制其生长。C3G在癌症中既有抑制癌症的发生发展的作用,亦有促进癌细胞增殖作用[4-9]。在小鼠的成纤维细胞中,外源性的C3G的过表达通过介导sis、ras和v-raf等致癌基因的活化和共转染来抑制其锚定非依赖性生长而作为抑癌基因[10];卵巢癌中通过C3G/Rap1通路促进MMP-2、MMP-9的分泌,增强细胞浸润能力[11];在肾小球肾炎中增强肾小球上皮细胞的迁徙而抑制高侵袭性乳腺癌细胞[12-15];宫颈癌中通过上游调控序列频繁甲基化减少C3G表达促进细胞的增殖[16-20];肝脏中低水平的C3G可能会促进肝癌细胞的迁移和侵袭[21];在非小细胞肺癌中,内源性的C3G的上调及过表达可通过影响CRK-Rap1信号通路来发挥致癌作用[22]。
DNA甲基化是最早发现的基因表观修饰方式之一,可参与癌症的发生、发展及转移[23]。检索生物信息数据库发现,在胃癌及癌旁组织中,C3G表达在癌组织中较正常组织高表达且具有统计学意义。有研究表明,在胃癌中基因组序列band CA-8主要表现为去甲基化,其定位于C3G的第一个内含子的酶切位点NotI上(GeneID:2889,chr 9q34.3),肿瘤的发生发展与C3G内含子序列发生频繁去甲基化有关。有研究表明,肿瘤的预防和治疗可通过去甲基化恢复某些关键的抑癌基因或DNA修复基因的活性这一手段来达到[24-25]。因此,C3G蛋白的表达可能成为评估罹患胃癌风险及胃癌治疗的指标。
结合既往研究可知,C3G对细胞的生长、分化、增殖、迁移等有一定的作用,但其在胃癌细胞中的具体作用尚不明确。本研究结合免疫组化的结果及临床病理资料的分析,胃癌组织中C3G蛋白呈高表达,且C3G蛋白阳性表达病人生存时间明显低于阴性表达组,分析影响胃癌病人预后的单因素、多因素COX风险比例回归模型,C3G蛋白的表达为影响胃癌病人预后的独立危险因素,与其他学者在卵巢癌及肝癌中的发现一致[4,7]。综合研究结果表明,C3G蛋白可能参与肿瘤的分化、侵袭、迁徙等过程,并且能在一定程度上反应肿瘤的恶性程度。C3G的高表达可成为病人不良预后的因素之一,但具体如何参与了细胞的增殖、迁移等过程尚需进一步研究。
综上所述,C3G在胃癌组织中表达较正常组织上调,对胃癌的发生发展具有一定的促进作用,其高表达病人预后生存周期较低。C3G可能成为胃癌的治疗、预后监测指标之一。

