miR-139调控巨噬细胞极化在过敏性哮喘中的作用
钟 民,张莺莺,吕 坤
(皖南医学院第一附属医院 弋矶山医院 1.重大疾病非编码RNA转化研究安徽普通高校重点实验室;2.中心实验室;3.检验科,安徽 芜湖 241001)
哮喘是一种异质性疾病,具有不同的临床表型,而过敏性哮喘作为其重要的表型之一,占成人哮喘病例的50%以上,在儿童哮喘中更高达90%以上[1]。作为复杂疾病,过敏性哮喘的发病机制十分复杂,至今尚未完全阐明。研究表明,过敏性哮喘与M2型巨噬细胞的活化和极化密切相关[2-4],差异调控巨噬细胞极化可能为过敏性哮喘的免疫治疗提供新的途径。微小RNA(microRNA,miRNA)是一类广泛存在于真核细胞中的长度为19~24个核苷酸的非编码小分子调控RNA,在基因调控方面起着极为重要的作用,控制细胞的生长发育,决定细胞分化的类型,调节细胞增殖与凋亡[5-7]。本课题组在前期研究中为探讨lncRNA AK085865基因敲除后骨髓来源的巨噬细胞(bone marrow-derived macrophage,BMDMs)中miRNA表达水平的变化,对野生型与AK085865-/-小鼠BMDMs(M0)进行测序,发现了miR-139在AK085865-/-小鼠中低表达,抑制miR-139会促进巨噬细胞向M1极化,并抑制巨噬细胞向M2极化[8]。然而,目前关于miR-139调控巨噬细胞极化在过敏性哮喘小鼠中的作用尚未被揭示。本研究拟对过敏性哮喘小鼠肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中miR-139进行实时定量表达研究,初步探讨其调控巨噬细胞极化在过敏性哮喘中的作用。
1 材料和方法
1.1 实验动物 6~8周雌性C57BL/6野生型小鼠购自南京青龙山实验动物中心,并饲养于皖南医学院弋矶山医院中心实验室的IVC动物实验室中,适应7 d后用于实验。按随机方法分为对照组和模型组,每组10只,用于检测miR-139表达水平。治疗分组则随机分为哮喘组和治疗组,每组20只。所有动物饲养以及动物实验操作遵从实验动物护理和使用指南(中华人民共和国科技部,2006),并获得皖南医学院动物伦理委员会批准。
1.2 主要试剂 尘螨蛋白由皖南医学院基础医学院提供;miR-139 antagomir及Bulge-LoopTMmiRNA Primer set购自广州锐博生物公司;HE染液、PAS染液及吉姆萨染液购自北京Solarbio公司;Trizol试剂购自Invitrogen公司;cDNA第一链合成试剂盒购自赛默飞公司;PrimeScript RT-PCR Kit购自Takara公司;SYBR®Green PCR购自QIAGEN公司;小鼠的流式抗体:藻红蛋白-花青素7标记的抗CD11c抗体(PE-Cy7-CD11c)、别藻蓝蛋白标记的抗iNOS抗体(APC-iNOS)、别藻蓝蛋白标记的抗CD206抗体(APC-CD206)均购自美国BD生物公司;ELISA试剂盒购自杭州联科生物有限股份公司;iNOS、Arg-1及GAPDH引物均由上海生工生物公司设计合成。iNOS上游引物:5′-ATCTTTGCCACCAAGATGGCCTGG-3′,iNOS下游引物:5′-TTCCTGTGCTGTGCTACA-GTTCCG-3′;Arg-1上游引物:5′-TGACTGAAGTAGA-CAAGCTGGGGAT-3′,Arg-1下游引物:5′-CGACATCAAAGCTCAGGTGAATCGG-3′;GAPDH上游引物:5′-GGTTGTCTCCTGCGACTTCA-3′,GAPDH下游引物:5′-TGGTCCAGGGTTTCTTACTCC-3′。
1.3 主要方法
1.3.1 构建过敏性哮喘小鼠模型及治疗 尘螨蛋白液(Df1)和氢氧化铝佐剂充分混匀后于0、7、14天对小鼠进行腹腔注射(100 μg),对照组用PBS替代(100 μL);于第21天开始对小鼠雾化1周(50 μg),对照组用PBS替代(50 μL)。对于miR-139治疗,治疗组小鼠从第20天开始每天尾静脉注射100 μg miR-139 antagomir,哮喘组小鼠则用100 μL PBS进行治疗,直到处死小鼠。
1.3.2 BALF获取 末次雾化24 h后以4%水合氯醛腹腔注射麻醉小鼠,在会厌软骨处做一T形切口,插入气管插管,用注射器吸入PBS反复灌洗,并离心收集细胞待用。
1.3.3 组织病理学观察 小鼠BALF获取后,通过气管插管向肺组织灌注4%多聚甲醛使其膨胀,用眼科剪剪下并置于4%多聚甲醛中固定,行HE及PAS染色分别观察炎性细胞浸润及杯状细胞黏液分泌程度。
1.3.4 气道高反应检测 用无菌生理盐水配置不同浓度的乙酰胆碱,将小鼠放入无创伤性全体积呼吸计量器体描箱中,以生理盐水的Penh值为基础值,绘制不同乙酰胆碱浓度激发下Penh值变化的百分比曲线。
1.3.5 炎性细胞数目及炎性细胞因子检测 BALF中炎性细胞数目检测使用瑞氏-吉姆萨染色(A液和B液)计算。IFN-γ及IL-4炎性细胞因子表达水平根据ELISA试剂盒说明书分别检测,根据所测OD值及标准品浓度绘制标准曲线,进而计算细胞因子浓度。
1.3.6 M1/M2巨噬细胞表达水平检测 收集BALF中的细胞,根据流式抗体说明书进行相应的染色:M1型巨噬细胞表型为CD11C+iNOS+,M2型巨噬细胞表型为CD11C+CD206+;总RNA提取后进行逆转录反应后配备qRT-PCR反应体系,M1型巨噬细胞检测标志物为iNOS;M2型标志物为Arg-1。以GAPDH作为内参,用2-△△CT公式进行分析,判定iNOS/Arg-1的相对表达水平。

2 结果
2.1 miR-139在过敏性哮喘小鼠中高表达 实时荧光定量PCR检测结果显示miR-139在过敏性哮喘小鼠BALF中表达水平(2.824±0.266)较对照组(1.019±0.191)增加,差异有统计学意义(t=21.413,P=0.000),说明miR-139在过敏性哮喘的发病过程中起着重要的作用。
2.2 抑制miR-139表达降低了过敏性哮喘小鼠肺组织炎症程度 通过建立尘螨蛋白Df1诱导的小鼠过敏性哮喘来确定抑制miR-139表达水平对哮喘发病的影响。在未经治疗的过敏性哮喘小鼠中,支气管周围存在严重的炎症反应,治疗7天后,炎症反应减轻(t=7.177,P=0.000),伴随着杯状细胞增生与黏液分泌减少(t=5.267,P=0.001;)。见图1。

与哮喘组比较,**P<0.05。
2.3 抑制miR-139表达减少了BALF中炎性细胞的数目和细胞因子表达水平 过敏性哮喘小鼠经治疗后,BALF炎症细胞的总数量(t=9.468,P=0.000)、嗜酸性粒细胞(t=8.327,P=0.000)与巨噬细胞(t=5.375,P=0.0058)均下降(图2A)。ELISA结果表明,抑制miR-139表达后哮喘小鼠BALF中炎性细胞因子也降低(IFN-γ:t=4.784,P=0.001;IL-4:t=4.892,P=0.001;图2B),表明沉默miR-139的表达能够减少炎症细胞分泌的细胞因子。

与哮喘组比较,**P<0.05。
2.4 抑制miR-139表达减轻了过敏性哮喘小鼠气道高反应性 与哮喘组小鼠相比,治疗组小鼠气道阻力(Rn)减少(15mg/mL:t=4.762,P=0.001;25 mg/mL:t=10.914,P=0.000;50 mg/mL:t=11.398,P=0.000;图3)。
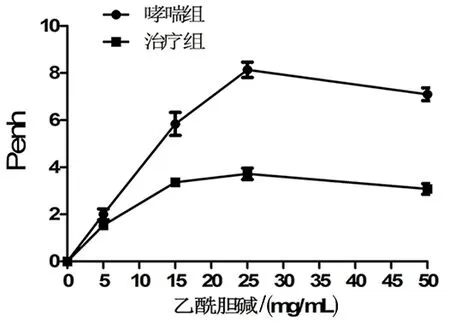
图3 气道高反应性检测
2.5 抑制miR-139表达抑制了过敏性哮喘小鼠体内M2型巨噬细胞极化 本研究用流式检测了M1和M2型巨噬细胞的比例,与哮喘组相比,治疗后的哮喘小鼠M2型巨噬细胞在BALF中下降了约55%(CD206:t=4.151,P=0.003;图4A),与PCR结果相似(Arg-1:t=11.465,P=0.000;图4B),说明沉默miR-139的表达能够减轻哮喘气道微环境中M2型巨噬细胞极化。
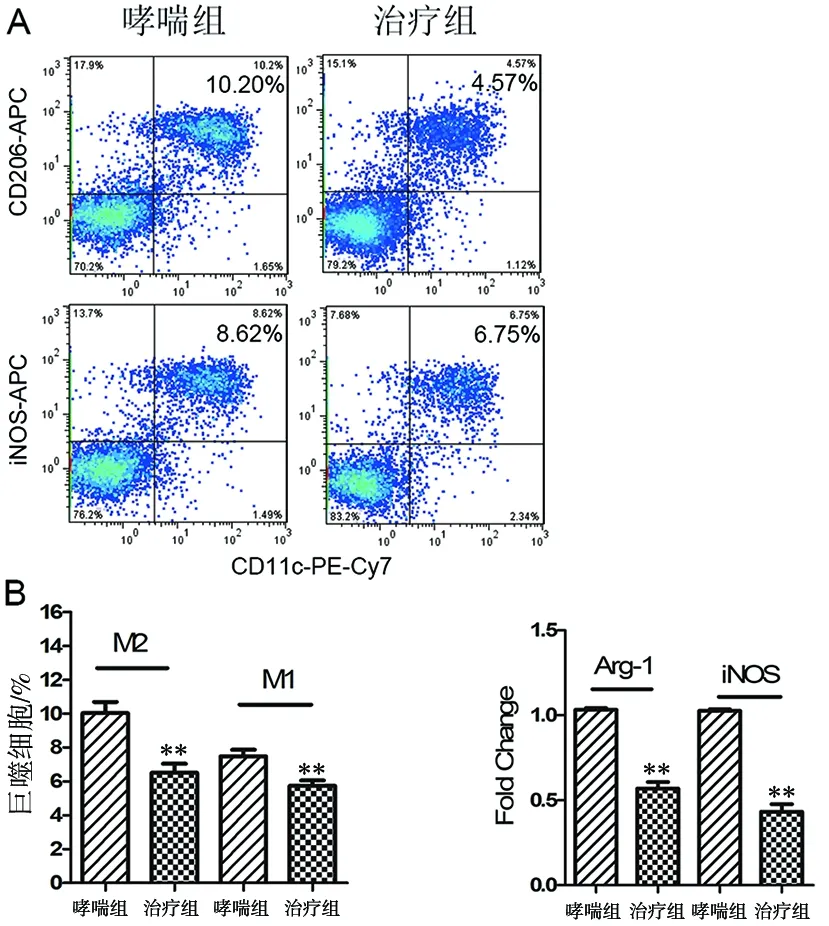
A.流式检测BALF中M1/M2巨噬细胞比例;B.qRT-PCR检测BALF中M1/M2巨噬细胞相关基因表达水平。与哮喘组比较,**P<0.05。
3 讨论
巨噬细胞是一种重要的抗原提呈细胞,是正常肺组织中含量最丰富的免疫细胞群之一,通过合成和分泌多种如细胞因子等的炎性介质作用下,参与到其他炎症细胞的趋化和功能发挥中。在过敏原刺激下会激活肺上皮细胞和其他先天免疫细胞,活化细胞释放多种细胞因子并明显影响肺泡巨噬细胞(alveolar macrophages,AMs)极化和迁移。Mathie等发现氯膦酸盐脂质体消耗AMs可以引起屋尘螨致敏小鼠的Th2型过敏性免疫反应[9],但Lee等发现清除小鼠过敏性哮喘模型中AMs减轻了Th2型炎症程度和气道重塑,并伴随着Th1免疫应答的增强[10]。M1巨噬细胞可能是非过敏性哮喘的主要效应细胞,而M2巨噬细胞在过敏性哮喘中占主导作用。因此,通过分子干预调节巨噬细胞表型在治疗哮喘和其他过敏性炎性疾病中具有重要潜力。
研究证明miRNA可通过调控巨噬细胞极化在感染、肿瘤生长、炎症活化等多种病理过程中发挥重要作用[11-13]。目前已报道的miR-148a-3p[14]、miR-21[15]与miR-495[16]等均可促进巨噬细胞向M1型极化,而miR-511-3p[17]、miR-146a[18]与miR-145-3p[19]等则促进巨噬细胞向M2型极化。本课题组前期研究发现miR-139可调控巨噬细胞极化,因此,本研究中我们通过对过敏性哮喘小鼠静脉注射miR-139 antagomir,试图阐明miR-139调控巨噬细胞极化在过敏性哮喘中的作用。通过干扰miR-139表达水平后,发现哮喘小鼠气道炎症程度及气道高反应性明显下降,伴随着BALF中M2型巨噬细胞比例的下降,提示miR-139基因敲除可减轻过敏性哮喘小鼠的易感性,为过敏性哮喘的发病机制研究和生物学防治提供了新的理论基础和实验依据。

