不同配比基质对番茄生长和根际微生物数量的影响
王闯,曹娜,付成龙,3,徐宁,朱珊珊,3,刘国娟,徐卉,孙晓慧,张淑琪
(1.聊城职业技术学院,山东 聊城 252000;2.聊城市茌平区农业发展服务中心,山东 聊城 252100;3.山东蒙恩现代农业发展有限公司,山东 聊城 252000)
番茄(Solanumlycopersicum)是多年生草本植物,属茄科茄属番茄亚属,在全球蔬菜作物中总产量位居首位[1],也是我国目前主要的周年生产类蔬菜之一[2,3]。由于栽培基质的质量直接影响番茄的生长质量,因此随着设施无土栽培在全国的日益兴起,对番茄栽培基质的研究显得尤为重要[4,5]。
草炭是当前番茄设施栽培中应用最广泛的基质之一,是不可再生资源[6]。椰糠是植物性有机质,碳素含量较高,疏松透气性强,单独用作基础栽培基质时容易引起番茄缺素症,使植株叶色变浅甚至泛黄[7]。菇渣(双孢菇菌渣)中含有大量菌体蛋白、多种代谢产物及未被充分利用的养分,是较好的栽培基质原料[8]。利用菇渣生产栽培基质成本较低,且菇渣可以进行栽培后的再发酵应用[9]。本试验用椰糠、菇渣、草炭、珍珠岩、蛭石按不同比例复配成栽培基质,研究水肥一体化条件下不同配比基质对设施番茄生长和根区微生物数量的影响,从中筛选出最适番茄生长复合基质配比,以期为番茄设施无土栽培基质配比提供理论参考。
1 材料与方法
1.1 试验地概况
试验于2019年1—6月在聊城职业技术学院实训基地温室内进行。温室长60.0 m,宽15.0 m,高4.2m。试验期间温室内平均气温为23.6℃,平均光合有效辐射为198.9μmol/(m2·s),平均CO2浓度为441μmol/mol,平均空气相对湿度为62.7%。
1.2 试验材料
供试材料为椰糠、菇渣、草炭、蛭石、珍珠岩,基质理化特性见表1。

表1 不同类型育苗基质的理化特性
菇渣发酵方法:将菌棒粉碎,加水混合均匀,使含水量保持在60%左右,做成高80 cm、直径150 cm的发酵堆,每隔50 cm打孔,当温度升至60℃以上时翻堆,不定期加水使含水量保持在60%左右,当堆体温度与环境温度基本一致、菇渣呈褐色时,停止发酵并风干保存。
供试番茄种苗为采购于市场的番茄品种圣尼斯7845。滴灌施肥设备由山东莘沃科技有限公司设计提供。
1.3 试验设计与样品采集
试验采用单因素随机区组设计,共设6个处理,各处理栽培基质配方见表2。于2019年1月20日将种苗栽植于规格为长×宽×高=35 cm×20 cm×20 cm无土栽培袋中。每处理设5个重复,每重复24株。株距45 cm,行距70 cm。各处理间其它生产管理措施一致。
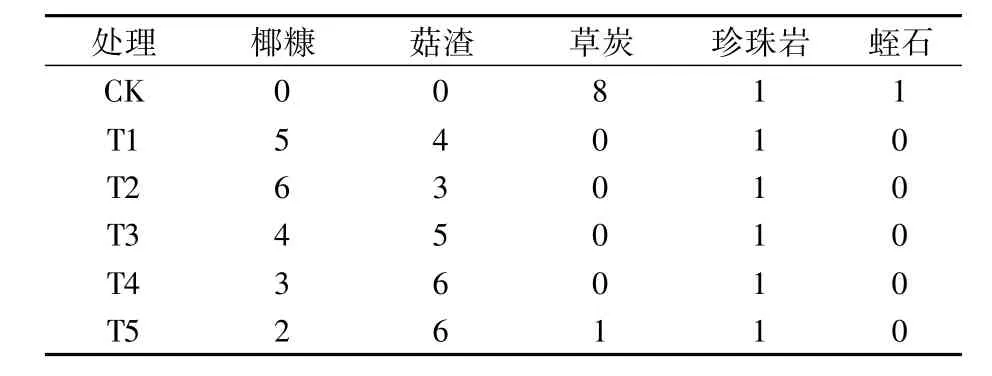
表2 不同处理栽培基质配方比例
各处理随机选取并标记12株番茄作为调查测量对象。分别于定植后15 d(开花初期)、30 d(坐果初期)、45 d(坐果期)、60 d(膨大期)、75 d(采收初期)、90 d(采收盛期)、105 d(采收末期)、120 d(拉秧期)进行农艺性状测定及根际微生物取样。用五点取样法取番茄根际0~5、5~10 cm基质层样,混匀后去除根系等杂质,密封带回实验室,于4℃冰箱内保存备用。
1.4 测定指标与方法
株高:测量茎基部到生长点的长度;茎粗:测量第一节间往上1 cm处的粗度;产量:按处理分批收获成熟果实累计产量,计算平均单株产量,折算每平方米产量;果数:统计单株收获果实数量,计算平均单株果数;单果重:收获期每处理随机称取5次,每次10个果实,计算单果重。
根系活力测定:用0.4%的TTC溶液与等体积的磷酸缓冲液混合制备反应液。各处理不同生育期内分别取根系样品0.5 g浸入10 mL反应液,并于37℃下保存1 h,加入浓度为1 mol/L的硫酸溶液2 mL,停止反应后取出根系,采用TTC染色法[10]测定根系活力。
根区溶液EC值参照熊静[11]的方法测定。
植株根际微生物测定:采用牛肉膏蛋白琼脂培养基分离培养细菌[12];采用马丁氏琼脂培养基分离培养真菌[13];采用改良高氏一号琼脂培养基分离培养放线菌[14]。
1.5 数据处理
采用Microsoft Excel 2007进行数据整理并作图,SPSS 20.0软件进行方差分析及差异显著性检验。
2 结果与分析
2.1 不同配比基质对不同生育时期番茄株高和茎粗的影响
由图1可以看出,随着番茄生长发育进程,6组处理株高均逐渐增高。定植后15 d,各处理株高差异不大;定植后30~120 d,T1株高始终显著高于其它5组处理;定植后30~60 d,T2株高仅次于T1,但与CK差异不显著;定植后75~120 d,T2株高显著高于CK;番茄整个生育期中,T4株高相对较矮。对比定植后120 d与15 d时的株高,CK、T1、T2、T3、T4、T5分别增长12.74、14.70、13.30、12.89、12.73、12.69倍。
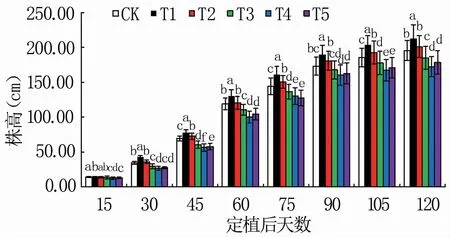
图1 不同配比基质对不同生育时期番茄株高的影响
由图2可知,随着定植时间延长,各处理番茄茎粗生长量存在差异。定植后15 d,各处理茎粗差异不大;定植后30~120 d,T1茎粗显著大于其它5组处理;定植后30~120 d,T2茎粗仅次于T1,显著大于其它4组处理;番茄整个生育期内,T1茎粗始终最大,T4茎粗较小。对比定植后120 d与15 d的茎粗,CK、T1、T2、T3、T4、T5分别增长1.32、1.72、1.51、1.27、1.04、1.21倍。
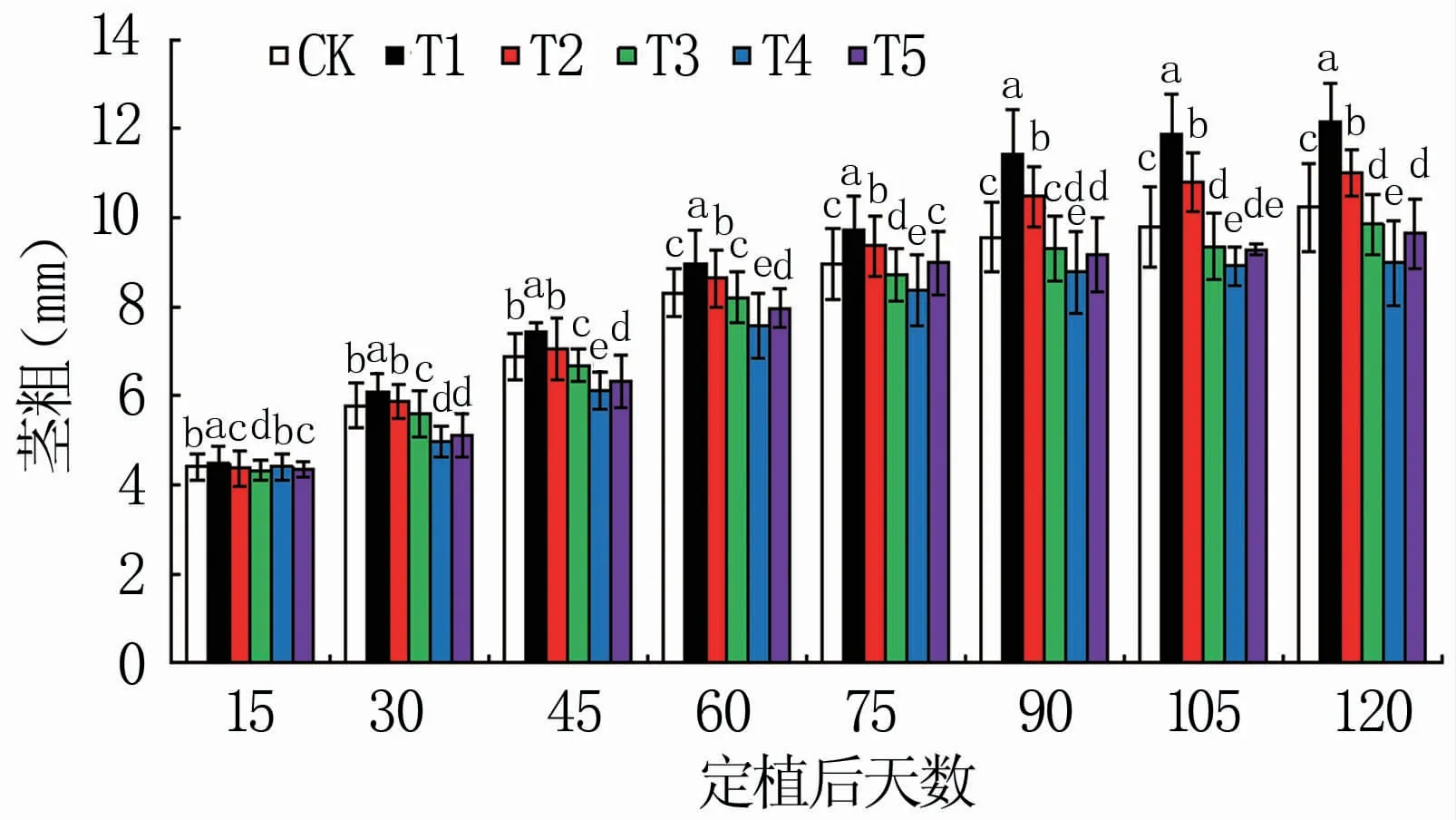
图2 不同配比基质对不同生育时期番茄茎粗的影响
2.2 不同配比基质对番茄根系活力的影响
根系是植物吸收水分和矿质元素、支持植物、合成有机物的重要器官,根系活力影响植物对水分、矿质元素的主动吸收[15]。由图3可看出,随着生育进程,6组处理番茄根系活力变化均呈双峰曲线。CK、T1、T2、T3的第一次峰值均出现在定植后45 d,第二次峰值出现在定植后105 d;T4、T5第一次峰值出现在定植后60 d,第二次峰值出现在定植后90 d。6组处理的最小值均出现在定植后120 d。6组处理根系活力的最大值依次为T1>T2>CK>T3>T5>T4,最小值依次为T1>CK>T2>T3>T4>T5。番茄整个生育过程中,T1的根系活力最强,除定植后75 d与CK差异不大,其它时间均显著强于其它5组处理。
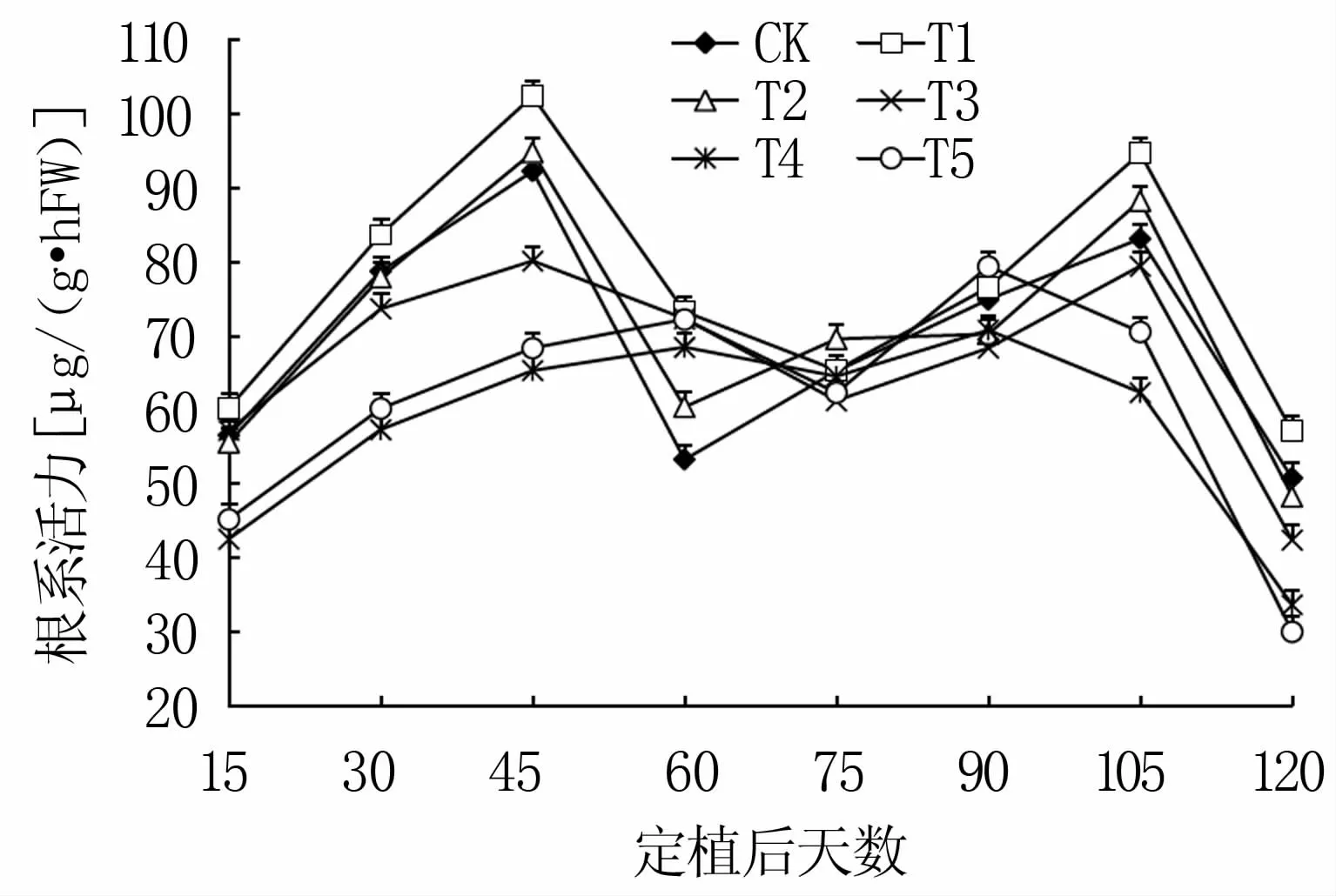
图3 不同配比基质对番茄根系活力的影响
2.3 不同配比基质对番茄单果重、果数及产量的影响
由表3可知,T1平均单果重最大,为233.56 g,显著大于CK、T3、T4、T5,但与T2差异不显著。平均单株果数T1最多,为24.24个,与CK、T2、T4差异不显著,T3、T5平均单株果数显著少于其它3组处理。平均单株产量T1最高,为5.66 kg,与CK、T2差异不显著,显著高于T3、T4、T5。平均隶属函数值为平均单果重、平均单株果数、平均单株产量3个果实性状指标的平均值,数值越大,说明该处理番茄相关果实性状越理想。由平均隶属函数值衡量6组处理番茄果实相关性状,从大到小依次为T1>T2>CK>T3>T4>T5。折合产量,T1最高,为179.53 t/hm2,显著高于其它5组处理,T2与CK产量差异不显著。
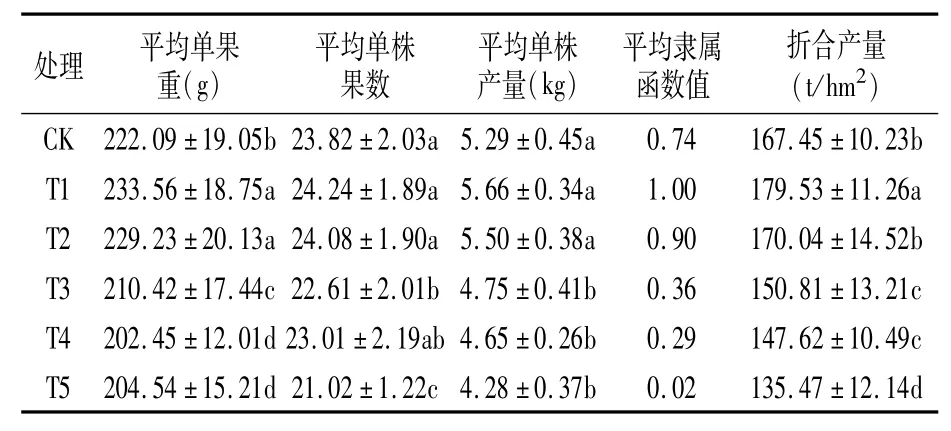
表3 不同基质对番茄单果重、单株果数、单株产量等的影响
2.4 不同配比基质对番茄根区溶液EC值的影响
由表4可看出,各处理番茄根区溶液EC值均随时间的延长而增加。定植后15 d,处理间根区溶液EC值差异不显著;定植后30 d,T4根区溶液EC值最大,与T5处理差异不显著,但显著高于其它4组处理;定植后45 d,T4根区溶液EC值最大,显著高于其它5组处理,T1处理最小,与CK、T2差异不显著;定植后60~120 d,T4、T5根区溶液EC值高于其它处理,二者差异不显著,T1、CK低于其它处理,二者差异不显著。整个生育期中,CK、T1、T2均未达到盐分胁迫水平(EC>6 mS/cm),T3在定植后120 d时达到盐分胁迫水平,T4、T5均在定植后90 d达到盐分胁迫水平。
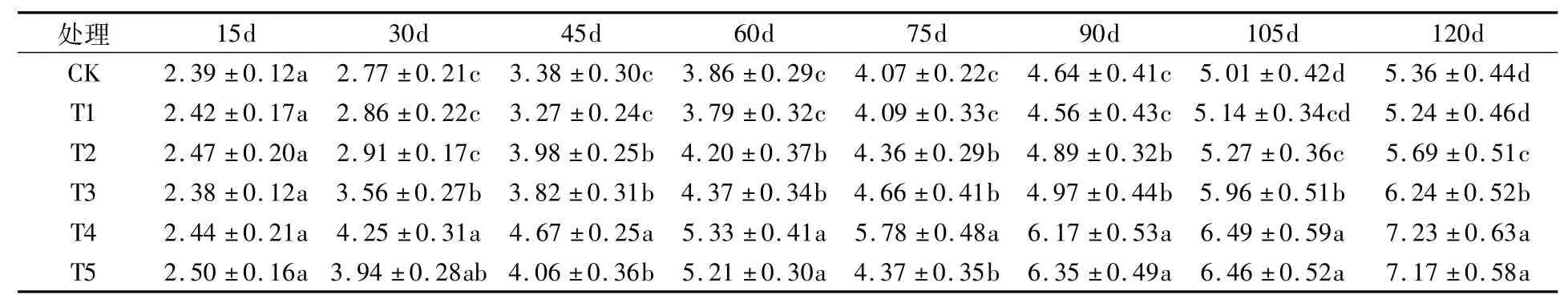
表4 不同基质对番茄根区溶液EC值的影响 (mS/cm)
2.5 番茄不同生育时期基质中微生物数量的变化
由图4看出,6组处理基质中细菌数量均随番茄生长期延长呈先升高后降低趋势。CK、T1、T2均在90 d时细菌数量达最大值,T3、T4、T5均在75 d时细菌数量达最大值;6组处理表现为:T1>T2>T3>T4>T5>CK,其中T1为CK的1.57倍。6组处理细菌数量最小值均在定植后15 d,其中CK最小,仅为1.39×107cfu/g;T4最大,为3.78×107cfu/g。

图4 番茄不同生育时期不同基质中细菌数量变化
由图5可知,番茄不同生育时期不同配比栽培基质中真菌数量的变化趋势基本一致,均随时间延长呈先增多后减少趋势。CK、T2、T3、T4真菌数量均在定植后90 d时达到最大值;T1、T5则在定植后75 d达到最大值。6组处理表现为:T1>T5>T3>T2>T4>CK,其中T1为CK的1.34倍。6组处理真菌数量最小值均在定植后15 d,其中T1最小,仅为1.02×104cfu/g;T4最大,为2.28×104cfu/g。

图5 番茄不同生育时期不同基质中真菌数量变化
由图6可知,随着时间的推移,T1、T2呈双峰曲线,二者变化趋势基本一致,在60、90 d出现峰值,90 d时峰值最大;CK、T3、T4、T5呈单峰曲线,T3处理在60 d达最大值,CK、T4、T5均在75 d达最大值;6组处理依次为T1>T4>T2>T3>T5>CK,其中T1最大值为10.56×106cfu/g,CK最大值为6.75×106cfu/g。整个试验过程中,T1处理放线菌数量变化最大,最大值是最小值的7.60倍,CK的变化最小,最大值是最小值的2.62倍。
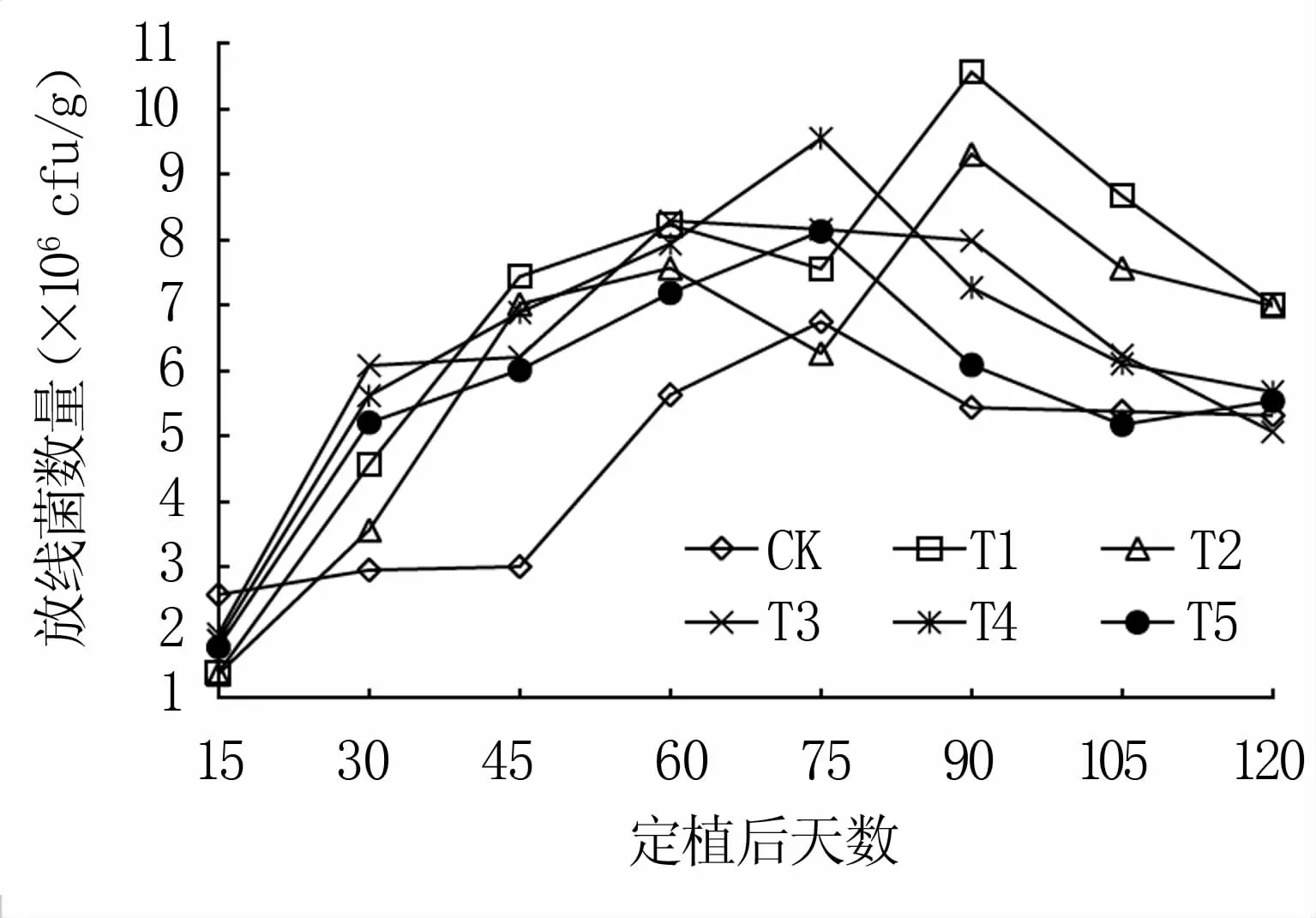
图6 番茄不同生育时期不同基质中放线菌数量变化
3 讨论与结论
随着番茄生育进程,所有处理番茄的株高和茎粗逐渐增加。定植后30~120 d T1均为最高,其次为T2。平均单果重和折合产量T1最高,分别达到233.56 g和179.53 t/hm2,显著高于CK,T4最小。表明,T1和T2基质配比营养较好,基质环境适合番茄根系和植株的生长。T3、T4、T5基质配比番茄植株生长势较弱,尤其配方T4株高最矮,不利于番茄植株生长。T3、T4、T5基质配方菇渣超过40%。
基质栽培系统中养分累积程度常用根区溶液或回流液EC值来判断,当EC值过高时易对作物形成渗透胁迫。T4、T5根区EC值在120 d时达到7.23 mS/cm和7.17 mS/cm,而T1仅为5.24 mS/cm。
良好的基质能为番茄生长发育提供好的根际微生物环境。番茄基质不仅因为原料来源和配方不同而呈现出不同的理化性状,而且还会影响基质微生物类群、数量等,使微生物分解释放的养分量不同,从而影响番茄对养分的利用情况[16-18]。本研究表明,番茄不同生育时期不同基质中细菌和真菌数量的变化呈现先升高后降低趋势,可能是由于根区EC值升高有关。基质中微生物数量中细菌高于放线菌,真菌最低,这与孟焕文等[19]在番茄上的研究一致。番茄生长中后期T1微生物中细菌、真菌、放线菌明显高于CK,与番茄的株高和茎粗相对应。单独添加菇渣的处理和复合添加菇渣和棉花秸秆处理有利于增加基质中微生物的数量,可大幅度提高油麦菜的产量[20]。
综上所述,本试验T1配方(椰糠∶菇渣∶珍珠岩=5∶4∶1)复合基质栽培番茄,植株生长、产量、光合特性、根呼吸和微生物含量都高于其它配方基质,同时T1复合基质在栽培过程中稳定性较好。基质中菇渣超过40%对番茄生长不利。T1可作为鲁西北地区设施番茄栽培基质推广应用。

