运动调节内质网未折叠蛋白反应改善衰老性肌萎缩的研究进展
柯志飞,尚画雨,王瑞元,李俊平*
(1.北京体育大学 运动人体科学学院,北京 100084;2.成都体育学院 运动医学与健康学院,四川 成都 610041)
2019年全球65岁及以上人口总数已达7.03亿,2050年人口总数将增加至15亿。研究预测,2030年我国65岁及以上人口总数将增至2.48亿,约占总人口17%。因此,衰老及其相关疾病,尤其是衰老性肌萎缩(sarcopenia)的预防/防治成为亟待解决的公共健康问题,亦是临床医学、康复领域和航天领域目前重点研究的课题之一(Landi et al.,2018;Marzetti et al.,2017)。衰老性肌萎缩也称肌少症/增龄性肌萎缩,是常见的一类慢性退行性疾病,临床主要表征为骨骼肌质量与力量下降、肌纤维横截面积下降、萎缩因子肌肉环指蛋白 1(muscle ring finger 1,MuRF1)和肌肉萎缩F盒基因(muscle atrophy F-box,MAFbx)等表达明显上调等(Marzetti et al.,2017;Landi et al.,2018)。
内质网未折叠蛋白反应(endoplasmic reticulum unfolded protein response,UPRER)是指机体为恢复内质网稳态或清除内质网应激(endoplasmic reticulum stress,ERS)的一种适应性应答反应。若机体长期处于ERS或大负荷ERS时,则极有可能使UPRER受损,进而介导c-Jun氨基末端激酶(c Jun N-terminal kinase,JNK)和核因子-κB(nuclear factor-κappa B,NF-кB)通路诱导细胞凋亡。越来越多的研究提示,衰老性肌萎缩与UPRER关联密切,但其具体机制仍不清楚(Hart et al.,2019;Jheng et al.,2018)。体内、外实验表明,在萎缩模型中发现骨骼肌MuRF1或MAFbx的过表达可导致ERS,并诱使UPRER激活,而激活的UPRER可通过抑制真核细胞翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)的磷酸化(p-eIF2α)以削弱骨骼肌肌肉蛋白质合成(muscle protein synthesis,MPS)和增强肌肉蛋白质降解(muscle protein breakdown,MPB)等途径加剧/加重萎缩进程(金海秀等,2016;王友华等,2019)。目前对衰老性肌萎缩的防治,临床以药物、电刺激、营养和/或运动为主,基因治疗、干细胞治疗和非编码mRNAs治疗为辅(张子怡 等,2020;Hart et al.,2019;Lalia et al.,2017;Memme et al.,2016)。运动作为防治衰老性肌萎缩的一种经济、有效的手段备受青睐(Landi et al.,2018),尽早给予运动干预可最大限度预防、延缓和减轻其发生发展。现有研究集中探讨了运动通过线粒体生物发生(包括线粒体自噬、线粒体融合分裂、线粒体应激)和内质网自噬等途径调控衰老性肌萎缩的机制,但运动经UPRER削弱衰老性肌萎缩的分子机制尚未完全阐明。基于此,本文就UPRER与衰老性肌萎缩及运动之间关系进行梳理,阐释急性运动和长期运动经UPRER调控衰老性肌萎缩的作用,旨在为运动延缓衰老性肌萎缩提供新思路。
1 内质网未折叠蛋白反应(UPRER)
在多细胞真核生物中,UPRER主要由1个内质网分子伴侣如免疫重链结合蛋白(binding immunoglobulin protein,BiP)/葡萄糖调节蛋白 78(gulosce regulating protein 78,GRP78)/热休克蛋白45(Hsp45)和3种ER跨膜蛋白如双链RNA依赖的蛋白激酶样ER激酶(protein kinase RNA-like ER kinase,PERK)、激活转录因子 6(activating transcription factor 6,ATF6)和肌醇必需激酶1(inositol-requiring protein 1,IRE1)组 成(Frakes et al.,2017;Gong et al.,2017;Shen et al.,2005)。正常生理状态下,PERK、ATF6和IRE1与BiP/GRP78互作为稳定复合物(Crespo et al.,2012)。异常生理状态下,错误折叠蛋白质和/或未折叠蛋白质的累积、Ca2+超载和氧化还原稳态改变等诸多因素均可诱发 ERS(Frakes et al.,2017;Gong et al.,2017)。ERS时,PERK、ATF6和IRE1与BiP解离使前述3种跨膜蛋白被招募至未折叠/错误折叠蛋白异常“聚集区”,随即激活UPRER(Gong et al.,2017;Nagasawa et al.,2007;Naidoo et al.,2008;Shen et al.,2005)。
PERK作为一类I型跨膜蛋白,正常生理状态下PERK与BiP互作后“失活”。ERS时PERK与BiP解离,随后PERK通过寡聚化和反式磷酸化使自身活化,可将eIF2α(Ser51)磷酸化,削弱内质网内的蛋白质翻译,同时增强含有micrORF/IREAS等mRNA的翻译(图1C)。一方面,pelF2α会抑制GDP与GTP转换并使eIf2α-GTP-tRNA复合物数量下降,进而削弱MPS(Hoppe et al.,2020;金海秀等,2016);另一方面,机体为恢复内质网稳态,优先激活一类包括激活转录因子4(ATF4)和C/EBP同源蛋白(C/EBP homologous protein,CHOP)等特殊蛋白的翻译(Huang et al.,2015)。
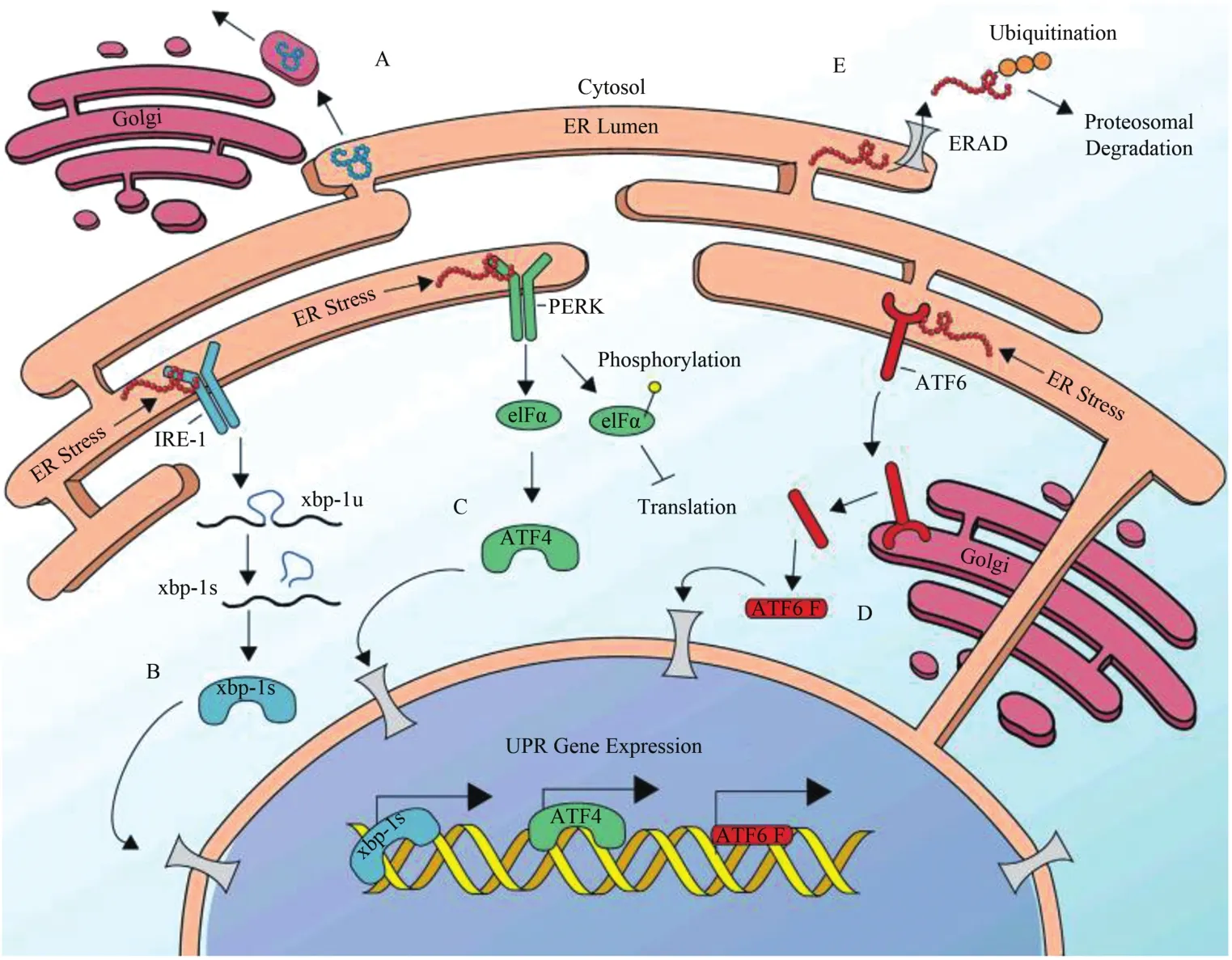
图1 内质网未折叠蛋白反应(Frakes et al.,2017)Figure 1.The Unfolded Protein Response of the Endoplasmic Reticulum(Frakes et al.,2017)
ATF6是分子量为90Kda的一类II型ER单通道跨膜蛋白,分为α和β两种亚型,且包含一个bZIP和一个应激敏感结构域(Hassler et al.,2012)。ERS时,ATF6α与BiP解离后易位高尔基体,其被S1P(site-1 proteases)和S2P(site-2 proteases)剪切后形成ATF6f(图1D)。该过程使N末端片段易位入核与ATF/cAMP和ERS反应元件结合,进而激活伴侣蛋白如BiP、GRP94、X-box结合蛋白1(X-box binding protein 1,Xbp1)和 CHOP等(Hotamisligil.,2010)。此外,ATF6α与Xbp1互作后可激活ER相关降解系统(ERAD)降解错误折叠的蛋白(图1E)。
IRE1作为一类I型跨膜蛋白,分为α与β两种亚型(Bertolotti et al.,2001),与PERK结构相似。此外,鉴于IRE1α活化后具有Ser/Thr激酶和核糖核酸内切酶的活性,故IRE1途径也被称为UPRER中最保守的信号(金海秀等,2016)。ERS时,机体感知未折叠蛋白的累积,此时IRE1α通过寡聚化和反式自磷酸化使自身活化(Sicari et al.,2020);随后IRE1α与BiP解离后与未折叠蛋白结合为二聚体。此外,鉴于IRE1α含有RNase结构,其活化后能剪接Xbp1mRNA上26位核苷酸的内含子,使后者移位后生成新的转录因子sXbp1(spliced Xbp1)促进蛋白降解(图1B)(Roy et al.,2019)。
2 衰老性肌萎缩与UPRER相互关系
衰老性肌萎缩本质特征为净蛋白平衡(net muscle protein balance,NMPB)紊乱,而NPMB取决于机体MPS和MPB之间的动态平衡。就衰老性肌萎缩而言,其机理与废用性肌萎缩和癌症恶病质肌萎缩等略有不同,主要表现为MPB异常升高或MPS急剧下降而致使机体骨骼肌“合成代谢抵抗(anabolic resistence)”相对明显。二者可能随衰老性肌萎缩同时发生,进一步加剧其发生与发展。近年来,关于衰老性肌萎缩的研究主要集中于线粒体自噬、内质网自噬等方面(Liang et al.,2020),而其与UPRER的研究尚少,二者相互关系尚不清楚。
一般而言,机体细胞对外界反应作出调整的能力随年龄增加而逐渐下降,哺乳动物的内质网蛋白质稳态亦出现相似的变化(Metcalf et al.,2020)。研究报道,衰老同时伴有机体氧化应激水平的增高和内质网相关分子伴侣表达/活性下降等,极易使细胞诱发炎症和凋亡,从而削弱内质网的蛋白修饰、加工和折叠能力,最终诱使内质网功能紊乱/障碍(Chadwick et al.,2020;Gardner et al.,2011)。内质网功能紊乱/障碍是诱导衰老性肌萎缩的重要因素之一,一旦发生可诱发骨骼肌ERS,随即机体激活UPRER缓解 ERS(Naidoo,2009;Naidoo et al.,2008)。另有报道显示,衰老使UPRER受损、UPRER相关伴侣蛋白的活性下降(Ghosh et al.,2015;Naidoo,2009;Wang et al.,2019),因此,UPRER可能无法缓解/抑制ERS,此时亦可能过度激活UPRER。过度激活的UPRER可介导PERK/ATF4、JNK/IRE1α或NF-κB通路,从而激活促凋亡因子CHOP等的表达,后者下调B细胞淋巴瘤-2(B cell lymphoma 2,BCL-2)表达,并诱导促凋亡因子BAX/BAK(Bcl-2-associated X protein/BCL2-antagonist/killer 1)转位(Metcalf et al.,2020)。近期Gallot等(2019)的一项研究还表明,UPRER伴侣蛋白活性的下降可阐释与衰老相关的蛋白稳态失衡/紊乱,包括蛋白质的折叠变化及异常聚集。此外,过度激活的UPRER也是骨骼肌质量与力量下降的潜在诱因之一。
就衰老骨骼肌的ERS而言,UPRER为缓解内质网的蛋白质折叠负荷,代偿性抑制IRS1磷酸化的水平,而其水平对PI3K/PKB/mTOR通路的激活极为关键(Liu et al.,2013;Song et al.,2016)。一方面,泛素连接酶CBI-b(ULCb)、IRS1底物磷酸化、PKB及mTOR的磷酸化使MPS受阻/抑制(Deldicque,2013);另一方面,p-eIF2α抑制蛋白质转录及翻译,从而减缓蛋白折叠负荷(Deldicque et al.,2011;Timmer et al.,2018),即机体NPMB趋于MPB,表现为骨骼肌质量与力量的显著下降、萎缩因子MuRF1和MAFbx表达明显上调(Chalil et al.,2015)。机体UPRER能力相对有限,一定程度上取决于激活程度,但适宜的UPRER仍可发挥以下作用:1)提高ER折叠蛋白能力;2)降低内质网膜的通透性及调控蛋白质进入内质网速率;3)通过抑制PI3K/PKB/mTOR通路削弱MPS,减缓蛋白质折叠负荷和减弱蛋白质翻译,从而重塑内质网稳态(Carrara et al.,2015;Chalil et al.,2015;Deldicque et al.,2011)。然而过度激活的UPRER则可能加剧衰老发展,一方面,过度激活的UPRER将介导细胞凋亡;另一方面,其抑制PI3K/PKB通路及哺乳动物雷帕霉素复合物1(mammalian target of rapamycin complex 1,mTORC1)等因子的表达,从而参与衰老过程中骨骼肌合成代谢抵抗状态,影响机体内质网的蛋白质稳态,使NPMB趋于MPB,进而影响骨骼肌的质量与力量(Deldicque,2013;Song et al.,2016)。因此推测,过度激活的UPRER可能加剧衰老性肌萎缩的发生发展。
综上,衰老性肌萎缩可触发ERS,接着激活UPRER,然而UPRER的激活一定程度上可能取决于衰老性肌萎缩的程度。就短期/小负荷的骨骼肌ERS而言,UPRER可直接发挥作用,并恢复ER稳态。就长期/大负荷的骨骼肌ERS而言,一方面,衰老骨骼肌的UPRER削弱ERS的能力相对有限;另一方面,持续的/大负荷ERS使UPRER过度激活,进而介导JNK/IRE1α或NF-κB通路等凋亡途径,致使NPMB趋向MPB,即萎缩因子MuRF1和MAFbx表达上调,加剧骨骼肌质量与力量的丢失。提示,UPRER在调控衰老性肌萎缩中可能发挥双重作用——适宜的UPRER调节衰老性肌萎缩发挥积极效益,而不适宜/过度激活的UPRER反而可能加剧衰老性肌萎缩的发生发展。此外,需指出的是,适宜的UPRER同样在细胞生存、自我更新及增值分化等方面发挥着重要作用(Mollereau et al.,2014)。
3 运动对UPRER的影响
研究表明,规律运动或体力活动可降低机体氧化应激和炎症,逆转线粒体和内质网功能障碍(Deldicque,2013;Barreiro et al.,2019;Passos et al.,2015)。据报道,ERS、骨骼肌的舒张/收缩可直接或间接激活UPRER,UPRER通过调控内质网蛋白质的折叠能力以及将“折叠负荷”趋于平衡,最终使内质网稳态恢复(Wu et al.,2011)。但也有研究表明,UPRER并不能在所有骨骼肌中均被激活,即在腓肠肌、股外侧肌及股直肌等躯干部肌肉中均被激活,而如竖脊肌、背阔肌、跖肌及比目鱼肌等肌肉中并未被激活(金海秀 等,2016;Tamura et al.,2017;Wu et al.,2011)。提示,就不同类型的骨骼肌而言,即使类型相似或相同的运动,也可能有选择性地激活UPRER。目前普遍认为,运动对UPRER的影响是机体对外界刺激作出的适应性应答。但是,运动对UPRER的影响不仅与运动类型(急性运动包括一次耐力/抗阻运动、长期耐力/抗阻运动及同期训练等)、运动方案和动物模型有关,亦与运动时间、运动频率、运动强度、肌肉类型、大鼠/小鼠健康状况及个体差异有关(金海秀 等,2016;Estebanez et al.,2019;Smiles et al.,2016;Wu et al.,2011)。现有研究集中探讨了运动与UPRER的关系,但未区分急性运动和长期运动对UPRER的异同,本文将从以上两个角度阐释其与UPRER的影响(表1)。

表1 运动与UPRERTable 1 Exercise and UPRER
3.1 急性运动对UPRER的影响
通常认为,急性运动诱导的UPRER随衰老的持续而逐渐减弱。但也有一些研究认为,急性抗阻运动和急性耐力运动对衰老骨骼肌UPRER的影响可能略有差异,这可能是衰老骨骼肌或老年人进行不同运动后的反应受损所致。就急性耐力运动而言,Kim等(2011)对8名马拉松运动员进行的一次200 km跑的研究发现,运动后3 h股外侧肌BiP和Xbp1表达显著性增加,表明极限的耐力运动可激活UPRER。一项以8周龄雄性SD大鼠为研究对象,探讨一次大负荷耐力运动(16 m/min;90 min)对不同时相(0 h、12 h、48 h、72 h)大鼠比目鱼肌UPRER的影响的研究表明,运动后各时相组大鼠较对照组比目鱼肌GRP78/BiP、p-PERK、p-elf2α、ATF4表达总体呈升高趋势,在运动后0 h、12 h或24 h持续在较高值,之后逐渐回落(丁海丽,2017;丁海丽 等,2017;孙竹昕,2018)。提示,急性运动能激活UPRER,且相关蛋白表达可能凸显“时相性”的特点。
除急性耐力运动之外,也有研究报道了急性抗阻运动对UPRER的影响。Ogborn等(2014)对18名未经训练的年轻人(untrained younger,Y)和老年人(older,O)进行急性抗阻运动,再观察其对不同时相(3 h、24 h和48 h)UPRER的影响,与对照组相比,两组GRP78、IRE-1α和PERK表达总体均呈升高趋势,其中,GRP78和PERK在48 h持续在最高值,IRE-1α在24 h/48 h持续在最高值,但上述指标的mRNA并未改变,此外,O组上述蛋白较Y组均显著性增加。同样是急性抗阻运动,Hart等(2019)对24位受试者进行运动干预后观察从基线到18 h UPRER的影响,基因集富集分析(gene set enrichment analysis,GSEA)结果显示,急性运动后年轻人和老年人之间UPRER相关蛋白PERK和ATF3 mRNA并未有差异,其中年轻人较老年人的UPRER协同效应更强,但老年人上述蛋白的水平逐渐下降。提示,急性运动激活UPRER可能与年龄有关。而Estébanez等(2019)的研究则呈现不一致的结果,他们发现,与年轻人相比,老年人p-IRE、CHOP和Xbp1等表达并未改变。以上研究表明,不同人群的骨骼肌基线UPRER相关蛋白的表达尚存争议。研究一般认为,UPRER活化的峰值通常在运动后48 h(Hentila et al.,2018);考虑到Hart等(2019)的研究对象有一定局限性,且仅观察运动后0~18 h UPRER相关指标变化,未观察24~48 h后的变化,这可能是导致两者不一致的另一客观因素。综上,推测急性运动对骨骼肌UPRER的影响可能凸显“时相性”的特征,即在运动后0~3 h作用并不明显、12~48 h作用逐渐显著、48 h后逐渐回落(丁海丽,2017;丁海丽 等,2017;孙竹昕,2018),其中尤以抗阻运动最明显。
3.2 长期运动对UPRER的影响
除上述急性耐力/抗阻运动与UPRER的研究外,也有研究探讨了长期运动对UPRER的影响。Pereira等(2016)研究发现,小鼠经8周上坡和下坡跑后,与上坡跑相比,下坡跑小鼠的趾长伸肌BiP、ATF6、p-IRE1α和p-PERK等表达均显著升高,表明8周下坡跑干预可激活UPRER,且上调UPRER相关蛋白表达和优化UPRER水平。除长期耐力运动外,Kim等(2014)对大鼠进行了5周不同强度的运动干预后发现,与低强度运动组(20 m/min)相比,高强度运动组(34 m/min)大鼠骨骼肌BiP表达明显升高。提示,高强度运动更能激活UPRER。
耐力/抗阻运动是现有研究UPRER机制的经典模型,在采用上述模型研究骨骼肌UPRER的进程中,有一些研究提示,UPRER的激活可能与线粒体生物发生标记物PGC-1α表达水平有关(Smiles et al.,2016)。同时,Kim 等(2014)的研究亦发现,与低强度运动相比,高强度运动促进大鼠骨骼肌PGC-1α的表达,同时骨骼肌ERS和凋亡信号相对减少。提示,UPRER的激活可能与运动强度有关,且相对较高的运动强度不仅能够促进线粒体生物发生,还能同时下调机体ERS状态/水平,延缓骨骼肌细胞的应激水平。此外,PGC-1α可与ATF6α相互作用后协同调控UPRER中的BiP,前者会易位线粒体外膜表面或靶向入核,后者则裂解为ATF6f移位细胞核或核膜。需要指出的是,上述研究关于UPRER相关蛋白的表达与急性/短期运动后的预期结果看似相反,而就不同类型的运动而言,高强度运动看似更能激活UPRER,但UPRER的3个信号轴存有不同的激活与失活时间,因此,UPRER相关蛋白表达的结果可能上升、下降或不变(Tampakakis et al.,2016)。基于此,急性运动对UPRER相关蛋白表达的影响在一定程度上可能无法真实反映其对肌肉组织的特异性或敏感性,需与其他指标综合评定。
除长期耐力运动外,长期抗阻运动亦能影响UPRER相关蛋白的表达。Hentilä等(2018)以未经训练的老年人和年轻人为研究对象,通过进行21周抗阻运动观察其骨骼肌UPRER的水平,结果显示,年轻人的UPRER水平较老年人明显升高。同样是长期抗阻运动,Estébanez等(2019)对40名健康老年受试者(21男,19女)进行为期8周的抗阻运动干预,运动后两组p-PREK、p-IRE1、ATF4和Xbp1表达均显著上升,但BiP和ATF6却并未改变。Deldicque(2013)和Pinto等(2016)在6周耐力运动和8周自愿跑的研究中发现了相似的结果。以上研究表明,耐力/抗阻运动均可能激活PERK/ATF4和IRE1/Xbp1信号轴,其中尤以年轻人更为显著。但运动与ATF6信号轴或ATF6水平的相互关系尚不清楚。此外,需指出的是,由于应激源不同,UPRER中的3条信号轴可能存有不同的激活与失活时间(Tampakakis et al.,2016),这可能是急性抗阻运动后24~48 h老年人骨骼肌BiP和ATF6mRNA表达显著性升高(Ogborn et al.,2014),而长期耐力或抗阻运动后上述水平未改变的原因(Mariana et al.,2015)。除对长期耐力/抗阻运动进行横向研究外,亦有学者进行了纵向研究。Hentilä等(2018)在对20名未经训练的年轻男性和老年男性分别进行急性和21周抗阻运动的横向和纵向比较干预研究发现,急性抗阻运动后0 h两组UPRER蛋白表达未改变,48 h上调,但21周抗阻运动后两组均显著上升,且两组间未见差异。这在一定程度上表明了长期运动激活UPRER的潜力,且该现象可能与年龄无关(Pereira et al.,2015)。
综上,运动可激活或优化UPRER,并改善衰老骨骼肌PERK/ATF4和IRE1/Xbp1信号通路相关蛋白的表达,从而削弱机体ERS。但ATF6信号通路相关蛋白的表达尚存争议,仍有待后续厘清。需指出的是,并非所有运动均能激活UPRER,其机制较为复杂,不仅与运动强度、方式及类型密切相关,还可能与相邻细胞之间的信息交流及功能与状态、研究对象的种类、大小及个体差异有关(金海秀等,2016;Estebanez et al.,2019;Smiles et al.,2016;Wu et al.,2011)。此外,还可能有其他通路参与了优化UPRER削弱ERS,相关机制待后续厘清。
4 小结与展望
发生衰老性肌萎缩时,机体IRS1底物磷酸化的水平下降,进而抑制PI3K/PKB/mTOR通路的相关蛋白表达,致使UPRER受损或其相关蛋白的转录和翻译下降,引起萎缩因子MuRF1和MAFbx表达上调,进而加剧萎缩的发生和发展。适宜的运动干预可激活或优化UPRER,改善衰老性肌萎缩,并改善衰老骨骼肌PERK/ATF4和IRE1/Xbp1信号通路相关蛋白的表达,从而削弱机体ERS。运动改善衰老性肌萎缩的问题一直是研究热点,且此方向研究方兴未艾,因此,探寻新机制将有助于揭示运动、衰老性肌萎缩与UPRER的分子机制。未来建议从以下几方面开展相关研究:1)从UPRER角度探寻何种运动及运动强度最为有效,以期为衰老性肌萎缩的防治提供新的依据;2)进一步厘清运动通过调控UPRER改善衰老性肌萎缩的具体分子机制;3)运动是否可经UPRER改善衰老骨骼肌细胞的胰岛素抵抗水平,从而改善衰老性肌萎缩;4)探究运动经miRNA调控衰老性肌萎缩UPRER的可能机制,以期为相关靶点在临床转化医学领域的应用提供重要的参考依据。

