小型血站核酸检测实验室HBV DNA项目室内质量控制方法分析
和向莲

【摘要】目的:对小型血站核酸检测实验室乙型肝炎病毒(HBV)DNA项目检测的室内质量控制方法进行分析和探讨。方法:以我站2018年6月1日至2021年5月31日期间收集的20464份无偿献血者血液标本,所有标本经酶联免疫吸附试验检测后均呈现为非反应性,分241批次进行乙型肝炎病毒(HBV)DNA测定。将HBV DNA阳性质控品、试剂盒阳性对照为反应性,将试剂盒阴性对照为阴性,且内标阳性为实验在控。记录前3个月20批次的检测数据,以其为依据对阳性质控品循环域值(Ct)、阳性对照Ct值、内标Ct均值以及标准差进行计算。再进一步绘制Levey-Jenning质控图,采用Westgard多规则质控方法判断。对标本总数、混样反应性、拆分反应性次数进行统计,并最终计算混检阳性率、拆分阳性率、拆出率等总体质量监控指标。结果:本次研究所有批次的实验均在控。其中,阳性质控品Ct值在第21批次、内标Ct均值在第30批次发生13s失控。共检测标本241批次,混检阳性率、拆分阳性率和拆出率分别为0.34‰、0.29‰、85.17%。结论:对于小型血站血液筛查检测而言,在使用HBV DNA阳性质控品判定作为实验在控基础的同时,还可进一步对阳性质控品、试剂盒阳性对照Ct值以及内标Ct均值的Levey-Jenning质控图和总体监控指标进行回顾性分析,以此实现更加有效的HBV DNA项目检测质量控制。
【关键词】小型血站核酸检测实验室;HBV DNA;室内质量控制
【中图分类号】R44 【文献标识码】A 【文章编号】2026-5328(2021)09--01
室内质量控制是我国医疗卫生行业对于血站核酸检测的强制性要求,是保证检测结果准确性和有效性的前提所在[1]。目前,我国血站关于血液筛查核酸检测的质量控制尚未建立起统一的质控方案[2]。本次研究结合本血站的基本情况,分析探讨了小型血站核酸检测实验室HBV DNA项目室内质量控制方法。现报告如下。
1.资料与方法
1.1一般资料
本次研究标本共计20464份,分241批次检测,均为2018年6月1日至2021年5月31日期间收集的,经酶联免疫吸附试验检测后均呈现为非反应性的无偿献血者血液标本。
1.2方法
本次研究所用试剂盒、仪器如下:
HBV DNA阳性质控品,北京康彻思坦公司生产,规格为1.0mL/支,浓度为200IU/mL;
含阴、阳性对照的HBV、丙型肝炎病毒、人类免疫缺陷病毒(I型)核酸检测试剂盒,上海科华公司生产;
ABI7500实时荧光PCR扩增仪,美国ABI公司生产;
MicrolabSTAR全自动样本处理仪,瑞士HAMILTON公司生产。
在8份标本混检模式下,严格依据试剂盒说明书的各项步骤对每批次核酸进行检测。每批实验中均包括阳性质控品、阳性对照、阴性对照各1个。若检测结果显示,HBV DNA阳性质控品、试剂盒阳性对照呈现为反应性,试剂盒阴性对照呈现为阴性,且内标显示为阳性,则认为该批实验在控。
1.3观察指标
统计每批次实验的阳性质控品Ct值、阳性对照Ct值、内标Ct均值,以前20次数据为基准,用Excel软件繪制Levey-Jenning质控图。
使用Westgard多规则质控方法根据Levey-Jenning质控图进行判断,得到回顾性分析结果。
对3年内所有检测标本的混检阳性率、拆分阳性率以及拆出率进行计算。
2.结果
2.1实验在控判定结果
在3年的检测中,所得到的各个批次检测数据显示,所有实验HBV DNA阳性质控品、试剂盒阳性对照以及阴性对照均满足反应性或者阴性的判定规则,且内标显示为阳性,据此认为本次研究中的各个批次实验均在控。
2.2回顾性分析结果
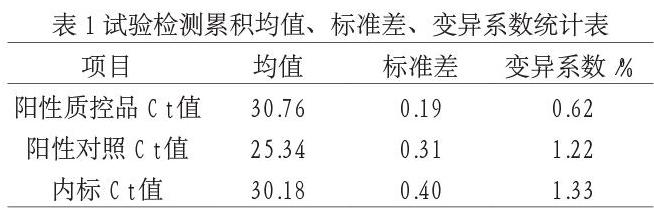
所有结果均服从正态分布,计算得到的实验累积均值、标准差、变异系数如表1所示。
整合前20次实验批次数据,绘制Levey-Jenning质控图,使用Westgard多规则质控方法进行质量控制判断。数据显示,阳性质控品在第1、10、20批次发生了12s警告,第21批次发生13s失控,第23批次违背41s规则。阳性对照在第15、20、24、29批次发生12s警告。内标Ct均值在第25批次发生12s警告,第30批次发生13s失控。
2.3总体监控指标分析结果
在3年的检测时间内,累及检测20464份标本,HBV DNA混样反应性共7次,拆分反应性6次。20464份标本的总体监控指标分析结果如表2所示。
3.讨论
在本次研究中,我们选择了浓度为200IU/mL的质控品,并设立了质控品和阳性对照,目的在于排除假阴性和假阳性[3]。本次研究数据显示,各项结果均服从正态分布,遂进一步绘制Levey-Jenning质控图进行质量控制,并用Westgard多规则质控方法进行判断,将12s作为警告规则。研究数据显示,实验中发生的12s警告,按Westgard规则依次检验,均未发生失控。阳性质控品、内标Ct均值分别在第21批次、30批次违背13s规则,分析其原因,考虑与质控品复融时间不够、上样前混匀不充分有关[4],但同时该批实验结果的阴、阳性对照和质控品有效,因此检测结果可接受。在总体监控指标方面,研究数据显示混检阳性率为0.34‰、拆分阳性率为0.29‰、拆出率为85.71%%,表明整个核酸检测过程具有较高的稳定性、污染风险低[5]。
综上所述,在小型血站血液筛查检测中,通过计算分析阳性质控品循环域值(Ct)、阳性对照Ct值、内标Ct均值绘制Levey-Jenning质控图,再进一步进行总体监控指标统计分析观察实验的有效性和稳定性的方式,可实现对小型血站HBV DNA检测的有效质量控制、保证检测效果与效率。
参考文献:
[1] 刘春兰,姜敏娜,宋雷. 血站核酸检测实验室质量监测指标分析[J]. 国际检验医学杂志,2021,42(15):1902-1905.
[2] 胡红梅. 血站核酸检测工作如何控制质量[J]. 东方药膳,2021(5):3.
[3] 张龙穆,袁欣,杨忠思. 核酸混样检测中假反应性的原因分析和质量控制[J]. 世界最新医学信息文摘(连续型电子期刊),2021,21(6):38-40.
[4] 刘锋,孙昂,吴晓晋,等. 酶免联合核酸检测技术对岳阳地区近4年无偿献血人群检测结果分析[J]. 现代医药卫生,2021,37(10):1705-1708.
[5] 张燕,方建华,葛文超,等. 河南省18家血站2017~2019年HIV/HBV/HCV核酸单独阳性结果趋势性分析[J]. 中国输血杂志,2021,34(1):68-72.

