阴虚质骨质疏松症患者血清中差异蛋白筛选研究
黄睿,谢兴文,李鼎鹏,徐世红,林德民,钟建春
1.甘肃中医药大学,甘肃 兰州 730000;2.西北民族大学附属医院,甘肃 兰州 730000;3.甘肃省第二人民医院,甘肃 兰州 730000;4.甘肃省中医院,甘肃 兰州 730050
骨质疏松症(osteoporosis,OP)已成为严重威胁我国老年人健康的主要疾病[1]。我国OP 总患病率约为13%,推测至2050 年患病人数可能上升至5.33 亿[2]。骨质疏松性骨折是OP 严重并发症,尤其是髋部骨折,其病死率高,患者多在骨折后1 年内死亡[3]。中医体质学说源于《黄帝内经》,主要表现在形态结构、生理机能及心理状态等方面。个体存在体质差异,影响一些特定疾病罹患率[4]。近年来,越来越多的研究开始关注中医体质与OP 相关性。有研究对广州某医院OP患者进行分析,发现阴虚质患者最多(28.7%)[5]。阴虚质发生骨质疏松性骨折的风险较高[6],对该体质进行研究具有较高临床价值。
蛋白质组学是研究蛋白质位置、功能、生物学过程及其相互作用的一门科学,在功能水平上研究基因表达[7],是生命科学研究领域的重要工具,用于寻找疾病生物学标志物,探究疾病发生机制。差异蛋白质组学TMT 技术属于串联质谱标签技术的一种,较凝胶定量技术可以检测更多类型的蛋白质分子[8],现已广泛应用于中医药研究领域。本研究采用TMT 技术筛选阴虚质OP 患者血清中的差异蛋白,旨在筛选阴虚质OP 潜在的血清生物蛋白标志物,现报道如下。
1 资料与方法
1.1 一般资料
受试者来自兰州市五泉、西固福二路2 个社区,共3 000 人。于2019 年12 月对受试者进行问卷调查,检测骨密度并采集血清。将受试者血清贮存于甘肃省中医院生物样本库-80 ℃冰箱内,按腰椎(L2~L4)骨密度水平分为OP 患者和非OP 者。通过问卷调查收集基本资料并判定中医体质。OP 患者961 例,其中阴虚质52 例(男性11 例、女性41 例)。采用随机数字表法从阴虚质OP 患者中选取32 例为阴虚质OP组,包括男性7 例、女性25 例,年龄52~80 岁,平均年龄(66.10±7.60)岁。经匹配年龄、性别后,选择平和质OP 组32 例,包括男性7 例、女性25 例,年龄52~81 岁,平均年龄(65.59±7.49)岁;平和质非OP 组32 例,包括男性7 例、女性25 例,年龄46~75 岁,平均(61.00±8.00)岁。3 组一般资料比较差异无统计学意义(P>0.05)。本研究经甘肃省中医院伦理委员会审查批准(2018-027-01)。
1.2 西医诊断标准
参照《原发性骨质疏松症诊疗指南(2017)》[9],以双能X 线吸收法(DXA)测量腰椎骨密度(L2~L4)。正常值:T 值≥-1;骨量减少:-2.5<T 值<-1;骨质疏松:T 值≤-2.5。
1.3 中医体质判定
按照《中医体质分类与判定》量表[10],每个问题按1~5 分划分为5 级评分,计算原始分和转化分,判定体质类型。平和质转化分≥60 分且其他偏颇体质转化分均<30 分时判定为平和质,阴虚质转化分≥40分且余体质转化分<30 分时判定为单一阴虚质。
1.4 纳入标准
①女性年龄≥45 岁,男性年龄≥50 岁;②阴虚质OP 组:临床诊断为原发性OP 且判定为单一阴虚质;③平和质OP 组:临床诊断为原发性OP 且判定为平和质;④平和质非OP 组:临床未诊断OP,判定为平和质的健康受试者;⑤所有受试者均对本研究知情,并签署知情同意书。
1.5 排除标准
①因内分泌代谢疾病、肿瘤、肝肾疾病、风湿免疫性疾病等导致的继发性OP;②伴重症心脑血管疾病及神经精神系统疾病;③伴恶性骨肿瘤、骨结核、骨髓炎等其他骨科疾病;④四肢及脊柱有内固定或心脏安装起搏器;⑤近2 年接受过抗骨质疏松治疗,使用过影响骨代谢的药物及接受过雌激素治疗;⑥不配合研究,资料不全。
1.6 血清样本处理
血清样本解冻,4 ℃、2 500 r/min 离心10 min,取上清液分装于Eppendorf 管,每组8 例做一混样,阴虚质OP 组、平和质OP 组、平和质非OP 组各4 个样本。
1.7 蛋白质提取
取冻存血清,各组每个样本血清取10 μL,分别混合均匀,运用SDT 裂解法,在待测血清样本中加入适量4%SDT 裂解液,沸水中水浴15 min。使用-20 ℃低温高速离心机14 000 r/min 离心15 min 取上清液。分装样品,-20 ℃保存。鉴定每个样本中蛋白,进行SDS-PAGE 电泳并定量各蛋白的浓度及总量。
1.8 辅助滤剂样品制备裂解
样品取150 μg 蛋白质溶液,分别加入DTT 至终浓度为100 mmol/L,于沸水浴后冷却至室温。加入200 μL UA buffer 混匀并离心,弃滤液,重复该步骤1次。加入100 μL IAA buffer,振荡避光反应后离心。加入100 μL UA buffer 再次离心,重复2 次。加入NH4HCO3溶液离心,重复2 次。加入40 μL Trypsin buffer,振荡后37 ℃放置16~18 h。换新收集管,离心15 min;再加入NH4HCO3溶液,离心15 min,收集滤液。采用C18Cartridge 对肽段进行脱盐,肽段冻干后加入甲酸溶液复溶,肽段定量(OD280)。
1.9 TMT 标记
用三乙基碳酸氢铵复溶样品,将TMT 试剂分别注入各样品中,常温放置1 h,分别注入5%氨水终止反应,室温静置10 min。在样品中加入10%三氟乙酸,pH值保持2.0 以下,可使样品与柱结合更充分。经脱盐、洗脱后,将0.1%甲酸溶液加入冻干后肽段中,备用。
1.10 质谱分析及鉴定
每份样品采用纳升流速Easy nLC 系统进行分离。缓冲液A 液为0.1%甲酸水溶液,B 液为0.1%甲酸乙腈水溶液。色谱柱以100%A 液平衡,样品由自动进样器上样到分析柱分离。样品经色谱分离后用Q Exactive plus 质谱仪进行质谱分析。分析时长120 min,检测方式为正离子,母离子扫描范围350~1 800 m/z,一级质谱分辨率为70 000,AGC target 为3×106,一级Maximum IT 为50 ms。多肽和多肽碎片的质量电荷比按以下流程采集:每次全扫描后采集10 个碎片图谱(MS2 scan),MS2 Activation Type 为HCD,Isolation window 为1.6 m/z,二级质谱分辨率为35 000,Microscans 为1,二级Maximum IT 为120 ms,Normalized Collision Energy 为30 eV。
1.11 分析方法
1.11.1 蛋白质定量分析
采用高分辨质谱仪 Q Exactive plus(Thermo Fisher Scientific)进行TMT 定量蛋白质组学分析。Q Exactive plus 是Orbitrap 类型质谱仪,使用快速HCD模式(higher energy collisional dissociation)获得MS2图谱,使用Proteome Discoverer 2.1(Thermo Fisher Scientific)[11]将Q Exactive plus 产生的原始图谱文件进行转化,通过软件内置工具提交至MASCOT2.6 服务器进行检索。再通过Proteome Discoverer 2.1 将MASCOT 服务器上形成的查库文件传回软件,根据FDR<0.01 标准筛选数据。
1.11.2 主成分分析
主成分分析(PCA)用于观察各组样本的自然聚集、离散及离群点,提取筛选到的各组样本差异蛋白对应的表达值,采用Excel2016 整合数据,并运用R4.0.2 软件将数据投射至二维空间,每个样本用二维空间的一个点表示,相同组分样本形成的点彼此靠近。
1.11.3 生物信息学分析
采用上述方法筛选出的蛋白,比较阴虚质OP 组、平和质OP 组和平和质非OP 组表达水平。当差异表达差异倍数>1.2(上调)或<0.83(下调),且P<0.05,则视为差异表达的蛋白。将筛选到的阴虚质OP组与平和质非OP 组的差异蛋白与阴虚质OP 组与平和质OP 组、平和质OP 组与平和质非OP 组所鉴定的蛋白进行对比,判断其是否为阴虚质及OP 共同作用下的特异性差异蛋白。对阴虚质OP 组与平和质非OP 组的特异性差异蛋白,通过UniProt 数据库和Blast2GO[12]和InterProScan[13]进行基因功能注释。对其生物过程、细胞组分和分子功能进行分析,利用KEGG 数据库对目标蛋白质集合进行通路注释。
1.12 统计学方法
采用SPSS23.0 统计软件进行分析。计量资料以表示,组间比较采用单因素方差分析和LSD检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 蛋白质定量和鉴定结果
经SDS-PAGE 电泳后,阴虚质OP 组、平和质非OP 组和平和质OP 组样本抽提效率高,样本中蛋白质含量丰富,各组样本蛋白质定量结果见表1。蛋白质相对分子量主要分布在10~90 kD(见图1),蛋白质主要等电分布点在5~10(见图2);肽段序列长度分布见图3;肽段序列覆盖度显示,鉴定到的蛋白质覆盖率比例较高(见图4);蛋白质丰度比分布显示,3 组样品定量结果中大部分蛋白质丰度比值接近1(见图5)。

图1 鉴定蛋白质相对分子量分布
图2 鉴定蛋白质等电分布点
图3 肽段序列长度分布

图4 蛋白质序列覆盖度分布

图5 蛋白质丰度比分布
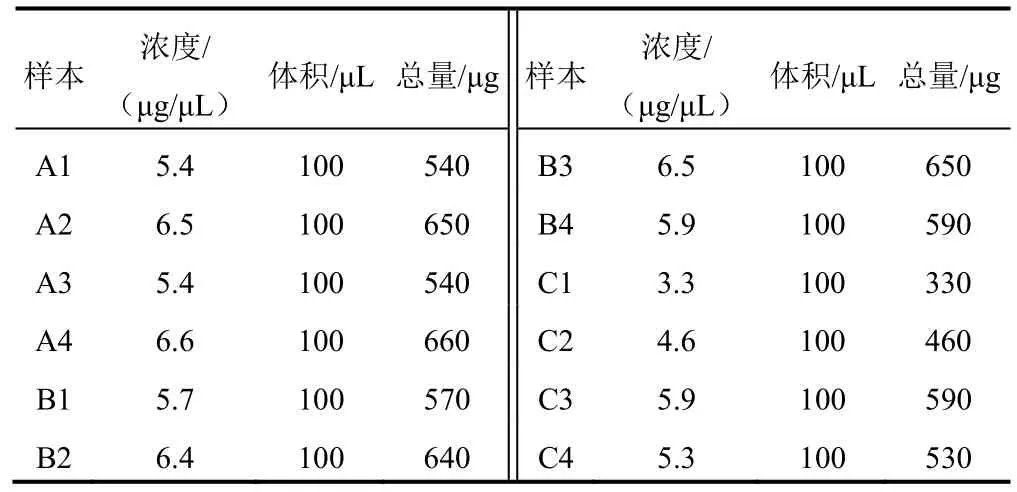
表1 各组样本蛋白质定量结果
2.2 血清差异表达蛋白筛选结果
根据质谱分析结果,阴虚质OP 组与平和质非OP组共鉴定了734 种蛋白,其中差异表达蛋白5 种。阴虚质OP 组较平和质非OP 组上调蛋白5 种,包括RAB7A、PON1 及3 种炎症免疫反应相关蛋白,无蛋白显著下调(见表2)。

表2 阴虚质OP 组与平和质非OP 组差异蛋白
将5 种差异蛋白与阴虚质OP 组与平和质OP 组、平和质OP 组与平和质非OP 组鉴定到的蛋白进行对比。阴虚质OP 组与平和质OP 组鉴定到其中的4 种(IGLV3-21、IGHV-α-2、RAB7A、PON1),4 种蛋白阴虚质OP 组与平和质OP 组比较差异无统计学意义(P>0.05),蛋白IGHV1-69-2 在阴虚质OP 组与平和质OP 组比较中未被鉴定及定量(见表3)。

表3 阴虚质OP 组与平和质OP 组差异蛋白表达比较
平和质OP 与平和质非OP 组鉴定出5 种差异蛋白中的4 种(IGLV3-21、IGHV-α-2、RAB7A、PON1),4 种蛋白平和质OP 组与非OP 组比较差异无统计学意义(P>0.05),蛋白IGHV1-69-2 在平和质OP 组与非OP 组的比较中未被鉴定及定量(见表4)。

表4 平和质OP 组与非OP 组差异蛋白表达比较
2.3 主成分分析结果
PCA 结果显示,平面图上阴虚质OP 组主成分与平和质非OP 组、平和质OP 组聚类的区域区分度明显(见图6)。
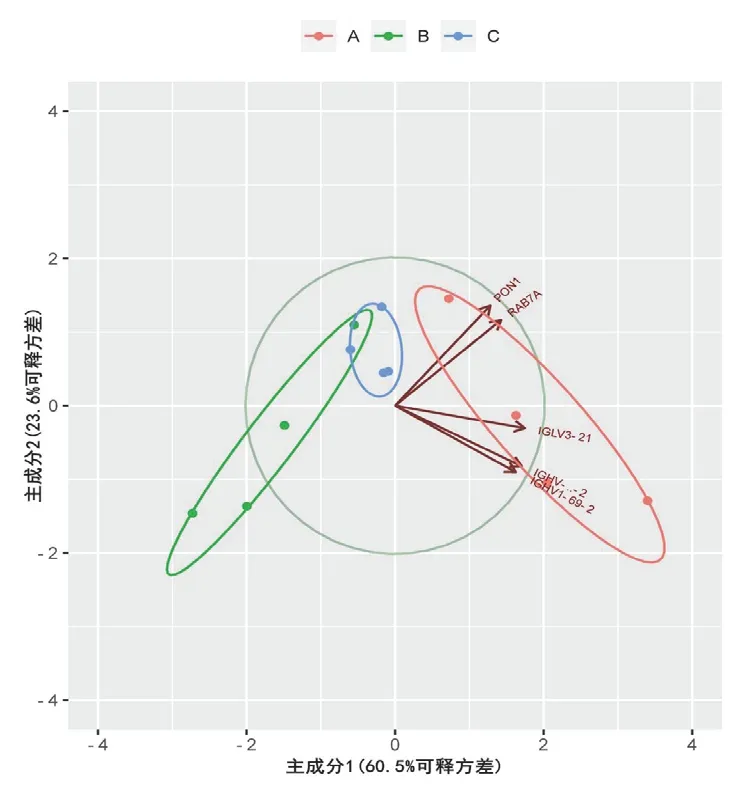
图6 差异蛋白各组样本PCA 图
2.4 阴虚质骨质疏松症患者差异蛋白功能及通路注释分析
对鉴定和定量到的阴虚质OP 组的5 种差异蛋白行功能注释和富集分析:按细胞组分归为11 类,这些蛋白都是细胞成分和蛋白质复合体,4 个蛋白胞外区组分,各有2 个是细胞膜成分和细胞器成分,1 个是突触成分,1 个是超分子化合物,5 个蛋白都分布于细胞膜、胞外区,3 个分布于细胞器,1 个位于细胞连接;按分子功能划分,5 个蛋白都有结合功能及催化功能;生物过程方面,存在差异的5 个蛋白都参与了代谢过程、免疫过程、生物调节过程和应激反应,4 个蛋白参与细胞定位,3 个蛋白参与多组织生物过程,2 个蛋白参与了多细胞生物过程和细胞结构的组成和发生过程,各有1 个蛋白参与转运过程和解毒过程(见图7)。

图7 阴虚质OP 组差异蛋白GO 富集分析
对主要富集的蛋白功能进行逐一分析发现,细胞组分主要富集在自噬体膜、溶酶体膜外成分、黑素体膜、反转录复合物、IgA 免疫球蛋白复合物,分子功能主要富集在抗原结合、催化芳二烷基磷酸酶、催化二氢香豆素水解酶、依赖GTP 的蛋白结合、芳基酯酶的催化,参与的生物过程主要富集在Fc-epsilon receptor信号通路、蛋白质靶向溶酶体、表皮生长因子分解代谢、内体向溶酶体转运、初级内体向次级内体转运等过程(见图8)。对鉴定到的差异蛋白进行KEGG 通路注释分析,发现差异蛋白主要富集于自噬通路及动物线粒体自噬信号通路。主要富集的自噬通路注释见图9。

图8 阴虚质OP 组差异表达蛋白GO 富集分析(前10 位)
图9 阴虚质OP 组差异表达蛋白主要富集的自噬通路注释
3 讨论
中医体质学说重视个体差异,体质影响疾病发生与预后[14-15]。近年来随着蛋白质组学、基因组学等学科的发展,越来越多的研究开始从微观角度探究中医病证本质。针对阴虚质OP 患者血清中差异蛋白的研究,可以探索阴虚质OP 的发病机制,有助于开发早期诊断试剂盒,并为阴虚质OP 靶向药物开发提供靶点。本研究筛选出的差异蛋白有3 个属于免疫球蛋白范畴,即IGHV1-69-2、IGLV3-21、IGHV-α-2。其中,IGHV1-69-2 和IGHV-α-2 属于重链免疫球蛋白,由免疫球蛋白重链位点(IGH)编码可变基因并经过转录、加工和翻译而形成[16],IGLV3-21 属轻链免疫球蛋白,由B 淋巴细胞分化而来的浆细胞产生[17]。这些蛋白参与炎症反应、疾病急性期反应及免疫调节[18]。董伟[19]研究发现,阴虚质人群血清中白细胞介素(IL)-2、干扰素-γ 的表达水平较平和质人群升高,提示阴虚质人群存在免疫功能减弱情况,免疫功能下降使阴虚质较平和质人群更易发生感染,从而引发炎症反应。孙淑娴[20]研究发现,阴虚质人群免疫炎症相关蛋白存在差异表达,表明阴虚人群免疫功能存在紊乱。研究显示,骨骼系统和免疫系统存在相互作用,因为骨骼系统和免疫系统有共同起源,破骨细胞、单核细胞和巨噬细胞均由造血干细胞分化而来[21]。2 个系统存在共同的细胞因子、受体和转录因子,免疫细胞接受传导信息能对成骨细胞和破骨细胞产生调节作用。当免疫系统发生紊乱时,骨重建受到影响,引发OP[22]。如活化的T 细胞能分泌Th17 细胞提高IL-17 水平,在骨破坏进程中,IL-17 可通过调节IL-1、肿瘤坏死因子合成更多的促炎性介质,加速骨破坏[23]。本研究显示,阴虚质OP 组血清中存在3 个免疫球蛋白上调,提示阴虚质OP 患者可能存在免疫功能紊乱,其发生OP 的原因可能是免疫系统紊乱导致骨流失增加。
RAB 蛋白属GTP 酶家族,主要参与膜转运过程。RAB7 是RAB 家族中的一种小G 蛋白,哺乳动物有RAB7A 和RAB7B 亚型,二者在膜转运不同阶段起作用。RAB7A 含有208 个氨基酸,主要位于晚期核内体,调节早期核内体向晚期核内体及晚期内体向溶酶体的转运[24]。RAB7A 的功能与自噬密切相关。有研究认为,自噬活动亢进是阴虚特征之一[25]。自噬水平平衡与中医阴阳自和及阴阳平衡思想具有相似性。阴阳自和指阴阳具有自我调整平衡的能力,生理状态下阴阳二气自我协调,病理状态下二者自我平衡,形成动态平衡。细胞自噬亦属于微环境中的动态平衡,当外界环境变化时,细胞通过自噬对其作出反应[26]。中医理论中的阴阳依据事物特性进行划分,自噬过程中清除的细胞内废旧代谢物质属阴,新合成的物质及能力属阳[25],当阴阳偏衰时,内外界因素变化和刺激可能使阴阳平衡被打破,随之导致自噬紊乱。过度自噬使阴虚质人群在代谢过程中清除细胞的功能亢进,存在分解骨代谢产物过快情况,成骨细胞-破骨细胞平衡被打破,导致骨流失增加[27-28]。自噬在OP 发病过程中被认为是骨细胞存活的重要机制之一。骨丢失进程也可能与骨细胞自噬有关[29]。成骨细胞稳态依靠自噬活动来维持,还能调节成骨细胞活性,保持骨髓间充质干细胞性状[30-31]。结合本研究中阴虚质OP 患者血清中RAB7A 表达显著高于平和质非OP 者,且阴虚质OP 组与平和质OP 组、平和质OP 组和平和质非OP 组间RAB7A 的表达水平无显著差异,推测RAB7A可能是阴虚质OP 特异性的血清蛋白生物标志物。
对氧磷酶(PON)是一种由肝脏合成的水解酶,PON1 是其3 种亚型之一,具有强烈亲酯性的高密度脂蛋白相关酯酶。PON1 的表达和活性主要受基因遗传多态性影响,与氧化应激相关多种疾病有关,包括冠状动脉硬化性心脏病、糖尿病、肿瘤及黄斑变性等[32]。氧化应激主要表现为人体内氧化和抗氧化平衡被打破,该过程会产生大量氧自由基,导致损伤部位中性粒细胞浸润,产生慢性炎症效应[33]。动物实验显示,阴虚大鼠模型由于细胞免疫功能及抗感染功能被抑制而产生炎症效应[34],临床研究亦显示阴虚患者体内炎症因子水平上升[35],同样表现为炎症效应,我们推测阴虚质的产生可能与氧化应激的致炎作用有关。氧化应激对破骨细胞的分化及激活有促进作用,提高骨吸收能力[36],是OP 潜在的危险因素。PON1 与骨代谢及OP 相关,其作用机制是PON1 的抗氧化能力可保护骨骼免受氧化应激反应。人体在新陈代谢过程中会持续产生自由基,如果抗氧化和氧化作用失去平衡,活性氧不能及时清除而发生累积。累积的活性氧损伤了成骨细胞及骨细胞,导致骨形成减少,骨破坏增加,从而引发OP[37]。本研究显示,PON1 表达水平在阴虚质OP 患者血清呈现高表达,阴虚质与平和质及OP 与非OP 间的表达水平差异无统计学意义,其可能是阴虚质OP 患者血清中特有的差异蛋白。
本研究尚存在一定局限性:如筛选出阴虚质OP 患者血清中的差异显著的蛋白5 个,其中3 个是功能未知蛋白,随着蛋白质组学发展,其功能会逐渐被认知。生物信息学分析结果仍需进一步的实验研究来阐明其具体机制。今后我们将对相关蛋白进行多中心、大样本验证,以确定其是否为阴虚质OP 可靠的血清蛋白生物学标志物。
综上所述,本研究通过TMT 技术筛选了阴虚质OP 患者血清中的差异蛋白,发现5 个蛋白表达存在显著差异。其中RAB7A 与自噬密切相关,PON1 与氧化应激反应存在关联。体现出阴虚质OP 的发生发展可能与自噬和氧化应激反应存在重要联系,它们可能是阴虚质OP 潜在的血清生物学标志物。本研究结果可为OP 微观诊断及药物精准干预提供新方法,也为阴虚质OP 发生发展的机制探索提供思路。

