非酒精性脂肪性肝病患者血清趋化素水平变化及其与胰岛素抵抗、炎症的关系研究
邢冬杰 孙英红 于龙广 宿世震 张豪英
近年非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)呈全球流行趋势,其发病率逐年上升,是发病率逐年增高的肝硬化和肝癌的致病原因之一,目前已成为全球公认的第一大慢性肝病,亚洲男性患病率高于女性,在肥胖人群中NAFLD 的 患病 率可 高达52.65%[1,2]。NAFLD 是 一种除酒精和其他明确的肝损伤因素所导致的、以弥漫性肝细胞大泡性脂肪病变为主要特征的肝脏病变,其发病机制尚不明确,经典学说是“二次打击”学说,其第一次打击主要是胰岛素抵抗,通过促使外周脂肪分解和高胰岛素血症引起肝细胞脂肪堆积,并诱导其对损害因子的敏感性增高,导致肝的结构和功能受损;第二次打击主要是氧化应激导致脂质过氧化,继而使脂肪变性的肝细胞发生炎症、坏死以及纤维化,最后进展为肝硬化,甚至肝细胞癌。血清趋化素(Chemerin)是近年来新发现的脂肪细胞因子[3],其表达水平与糖代谢异常、肥胖及心血管疾病的发生密切相关,尤其在脂肪细胞分化和胰岛素信号通路中起重要作用[4,5]。本研究通过测定不同程度肝损伤NAFLD 患者血清Chemerin 水平、胰岛素抵抗指数(HOMA-IR)、超敏C 反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)的水平,探讨NAFLD 患者Chemerin 水平变化及其与HOMA-IR、hs-CRP、TNF-α 的相关性。
1 材料与方法
1.1 一般资料选取2016年9月~2017年12月在滨州医学院烟台附属医院就诊的符合NAFLD 诊断标准的患者共60 例,年龄36~60 岁,平均(48.28± 10.05)岁,其中男40 例,女20 例。选择同期正常健康体检者22 例作为健康对照组(A 组),年龄30~70 岁,平均(46.18±7.32)岁,其中男14 例,女8例。两组患者的性别、年龄、血压及体质指数(BMI)等基本资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准符合中华医学会肝病学分会脂肪肝和酒精性肝病学组《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[6]:无饮酒史或饮酒折合乙醇量小于140g/周(女性小于70g/周);肝脏超声符合弥漫性脂肪肝的特点且无其他原因可供解释;签署知情同意书。
1.3 排除标准排除酒精性肝炎、病毒性肝炎、药物性肝病、自身免疫性肝病等;糖尿病、心脑血管疾病、肿瘤、应激状态、其他慢性疾病,以及各种急性感染;妊娠期、哺乳期妇女。
1.4 方法
1.4.1 一般检查 测量身高、体重、血压并计算BMI。
1.4.2 肝脏超声检查 由1 名经验丰富的副主任医师进行肝脏超声检查,参照2010年中华医学会肝病学会的NAFLD 诊断标准选择患者。
1.4.3 患者分组 根据患者肝脏脂肪浸润程度进行分级[7],轻度:图像显示光点细密,近场回声轻度增强,远场回声衰减1/3,肝内管状结构较为清晰;中度: 图像显示肝脏部位光点细密,近场回声增强,远场回声衰减1/2,肝内管状结构模糊不清;重度:图像显示肝脏部位光点细密,近场回声显著增强,远场回声衰减3/4,肝内管状结构模糊无法辨认。按以上标准将患者分为三组,分别为轻度损害(B 组,20 例,其中男13 例,女7 例)、中度损害(C 组,18例,其中男12 例,女6 例)、重度损害(D 组,22 例,其中男15 例,女7 例)。
1.4.4 实验室指标检测 受试者隔夜空腹(禁食、禁饮8~10h),次日清晨空腹抽取肘静脉血5ml,全自动生化分析仪测定血脂指标甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)、血清胰岛素(FINS)、丙氨酸氨基转移酶(ALT)、hs-CRP;另取5ml血液,离心后取血清置-80℃存储备检,采用酶联免疫吸附法(ELISA)检测血清Chemerin、TNF-α 水平;HOMA-IR 计算公式为FBG×FINS/22.5。
1.5 统计学方法采用SPSS 13.0 统计软件分析数据。符合正态分布的计量资料用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,相关性分析采用Pearson 分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组实验室指标比较NAFLD 各亚组(B、C、D组)BMI、FBG、FINS、HOMA-IR、TG、TC、LDL-C、ALT、hs-CRP、TNF-α、Chemerin 水平均显著高于A 组(P<0.05),HDL-C 水平低于A 组(P<0.05);D组FBG、FINS、HOMA-IR、TG、TC、LDL-C、ALT、hs-CRP、TNF-α、Chemerin 水平均高于B、C 组(P<0.05)。见表1。
表1 各组间相关指标比较(s)
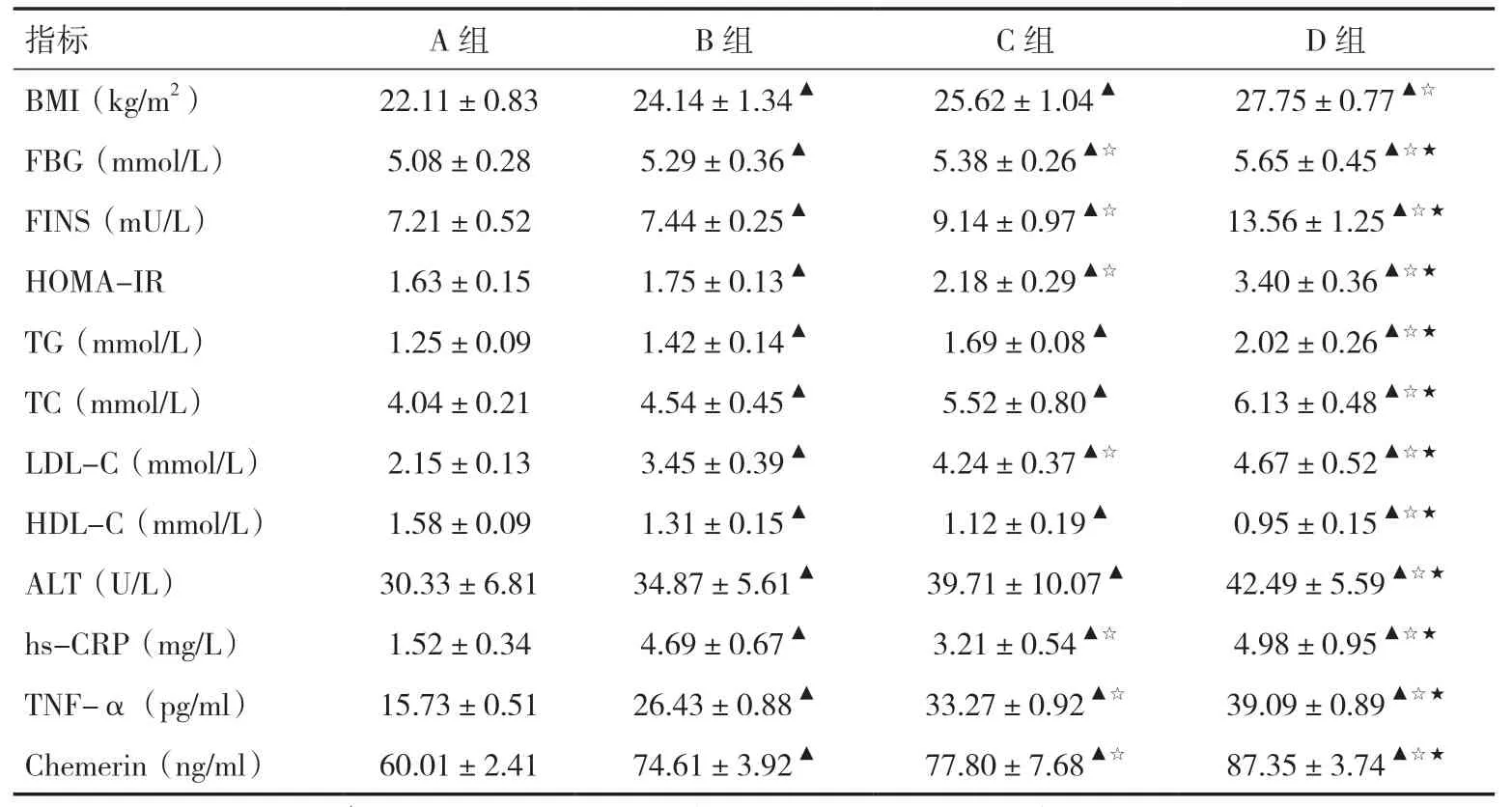
表1 各组间相关指标比较(s)
注:与A 组比较,▲P<0.05;与B 组比较,☆P<0.05;与C 组比较,★P<0.05
指标 A 组 B 组 C 组 D 组BMI(kg/m2) 22.11±0.83 24.14±1.34▲ 25.62±1.04▲ 27.75±0.77▲☆FBG(mmol/L) 5.08±0.28 5.29±0.36▲ 5.38±0.26▲☆ 5.65±0.45▲☆★FINS(mU/L) 7.21±0.52 7.44±0.25▲ 9.14±0.97▲☆ 13.56±1.25▲☆★HOMA-IR 1.63±0.15 1.75±0.13▲ 2.18±0.29▲☆ 3.40±0.36▲☆★TG(mmol/L) 1.25±0.09 1.42±0.14▲ 1.69±0.08▲ 2.02±0.26▲☆★TC(mmol/L) 4.04±0.21 4.54±0.45▲ 5.52±0.80▲ 6.13±0.48▲☆★LDL-C(mmol/L) 2.15±0.13 3.45±0.39▲ 4.24±0.37▲☆ 4.67±0.52▲☆★HDL-C(mmol/L) 1.58±0.09 1.31±0.15▲ 1.12±0.19▲ 0.95±0.15▲☆★ALT(U/L) 30.33±6.81 34.87±5.61▲ 39.71±10.07▲ 42.49±5.59▲☆★hs-CRP(mg/L) 1.52±0.34 4.69±0.67▲ 3.21±0.54▲☆ 4.98±0.95▲☆★TNF-α(pg/ml) 15.73±0.51 26.43±0.88▲ 33.27±0.92▲☆ 39.09±0.89▲☆★Chemerin(ng/ml) 60.01±2.41 74.61±3.92▲ 77.80±7.68▲☆ 87.35±3.74▲☆★
2.2 血清Chemerin 水平与各项指标的相关性分析NAFLD 各亚组中,血清Chemerin 水平与BMI、TG、FBG、HOMA-IR、hs-CRP、TNF-α 呈正相关(r分别为0.699、0.454、0.409、0.434、0.589、0.561,P<0.05),与 HDL-C 呈负相关(r=-0.357,P<0.05),与TC、LDL-C、FINS、ALT 无相关性。
3 讨论
NAFLD 是指除酒精外由其他明确的肝损伤因素所致的、以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,包括肝细胞从单纯性脂肪变性到进展性脂肪变性,进而进展为肝炎、肝硬化、肝细胞癌[6,8]。目前认为,胰岛素抵抗和炎症反应在NAFLD 发生、发展中起至关重要的作用[8]。本研究结果显示,NAFLD 患者BMI、FBG、FINS、HOMAIR、TG、TC、LDL-C、ALT、hs-CRP、TNF-α、Chemerin 水平均高于正常对照组,提示NAFLD 患者体内存在糖脂代谢紊乱、胰岛素抵抗和炎症反应,且以上因子水平随着肝脏损伤程度的加重而逐渐升高。肝脏是人体最大的内分泌腺,肝细胞内含有多种酶,当肝细胞受到损伤时,就会将细胞内的酶释放入血液中,ALT 对评价肝细胞功能及受损程度具有重要意义,NAFLD 患者的肝细胞受到胰岛素抵抗、炎症及脂质过氧化损伤,继而释放出ALT,血液中其含量升高。本研究显示,NAFLD 各亚组患者血清中的ALT 均较A 组升高,提示NAFLD 患者存在肝细胞受损。
Chemerin 是2007年由Bozaoglu 等[3]用信号序列捕获技术首次确定的一种脂肪因子,也称为他扎罗汀诱导基因2(Tazarotene-induced gene 2,TIG2)或视磺酸受体反应蛋白2(Retinoic acid receptor responder 2,RARRES2),在肝脏、肺脏、胰腺、皮肤和脂肪中都有表达,在肝脏和脂肪中高表达[9]。Sell 等[10]利用体外分化的人脂肪细胞研究Chemerin 与胰岛素信号传导、葡萄糖摄取的关系,结果显示,血清Chemerin水平与胰岛素抵抗和胰岛素诱导的脂肪细胞抗脂分解有关。Chemerin 在胰岛素受体底物1、蛋白激酶(Akt)和糖原合成酶激酶3 磷酸化及葡萄糖摄取水平诱导人骨骼肌细胞胰岛素抵抗,同时Chemerin激活p38 丝裂原活化蛋白激酶、核因子kappaB 和细胞外信号调节激酶(ERK)-1/2,引起胰岛素及其受体信号转导通路障碍,导致葡萄糖的摄取减少,促进胰岛素抵抗的发生。Ministrini 等[11]对54 例重度肥胖患者进行腹腔镜袖状胃切除术,干预治疗1年后,评估腰围、BMI、FBG、FINS、HbA1c、血脂(TG、TC、LDL-C、HDL-C)、血清Chemerin 水平和颈动脉内膜中层厚度等指标,分析显示,Chemerin 水平与腰围、胰岛素抵抗、HbA1c 和颈动脉内膜中层厚度相关,Chemerin 水平较腰围和HbA1c 能更好地预测颈动脉内膜中层增厚,Chemerin 水平的降低与颈动脉内膜中层厚度降低和袖状胃切除术后胰岛素敏感性的改善独立相关,提出Chemerin 参与了严重肥胖患者早期血管损伤和胰岛素抵抗的发生和进展,以及胃切除减肥手术后的愈合过程。以上均提示Chemerin 在脂肪细胞分化和胰岛素信号通路中起重要作用。本研究结果显示,NAFLD 患者的血清Chemerin 水平与BMI、TG、FBG、HOMAIR、hs-CRP、TNT-α 呈正相关,与HDL-C 呈负相关,进一步验证了血清Chemerin 在NAFLD 患者糖脂代谢中的重要作用。
近期研究表明,血清Chemerin 作为脂肪因子还能促进表达G 蛋白偶联受体趋化因子样受体 1 的多种免疫细胞,如巨噬细胞、未成熟的树突状细胞和自然杀伤细胞,可趋化细胞向炎症部位聚集,促进分泌多种炎症因子,如IL-6、TNF-α等,还能促进肝脏产生大量的C 反应蛋白,加重机体的炎症反应,而这些炎症因子又可以通过正反馈机制进一步促进体内血清Chemerin 的分泌,继而加剧了肝脏损伤[12,13]。本研究结果显示,NAFLD 患者的hs-CRP、TNF-α 水平高于对照组,且随着肝脏损伤加重呈逐渐升高的趋势。相关分析结果显示,血清Chemerin 水平与hs-CRP、TNF-α 呈正相关,提示血清Chemerin 可能通过炎症反应在NAFLD 发病过程中起重要作用。
综上所述,NAFLD 患者体内的血清Chemerin水平升高,且随着肝脏损伤程度的加重而升高,提示血清Chemerin 可能是NAFLD 发病的危险因素之一,且其作用与胰岛素抵抗和炎症相关,但具体发生、发展机制有待进一步研究证实。随着血清Chemerin 相关研究的不断深入,有可能为NAFLD的临床诊治提供依据和新的治疗靶点。

