毛竹不同组织总RNA提取质量的比较
方 婷,徐 倩,金爱武,,邓 莹,骆争荣,朱强根
(1.浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300;2.丽水学院 生态学院,浙江 丽水 323000)
毛竹Phyllostachys edulis为禾本科刚竹属,单轴散生型常绿乔木状竹类植物,地下由鞭根相连,属于大型克隆植物,兼具笋、材两用,是我国南方重要的森林资源之一,也是我国竹类资源中分布最广的竹种[1]。以往对竹类植物的研究主要集中在生态功能、生理结构形态、理化性质和竹材的分类、生长繁殖以及生产加工利用等方面,并且已经取得了一定的成果,同时竹类的遗传改良研究也取得了一定进展[2-4]。但是,竹类植物作为禾本科中木质化程度高的乔木状植物,其分子生物学研究严重滞后于同科的其他农作物如水稻、小麦等。
植物组织中含有的酚类、糖类及其它次级代谢产物会造成提取出的RNA 降解、提取效率低或抑制后续操作的酶促反应等[16]。目前虽已建立了许多较为成熟的分离RNA 的方法[17-18],但由于不同植物或者同种植物不同部位组织中蛋白质、多糖、酚类、脂类等成分含量的差异,不同部位组织的幼嫩程度不同,即使使用相同方法所得的结果也会大相径庭[19]。毛竹不同组织中主要内含物差异较大,例如毛竹叶片富含多糖物质[20],竹笋的主要成分为木质素和纤维素[21],种子中含有大量淀粉[22]。目前采用Trizol 法或者试剂盒方法提取毛竹叶片、花、笋等地上部分组织RNA 的技术已趋成熟,操作也相对简易[8,23],而针对毛竹地下部分生长、代谢异常活跃的细根RNA 的提取方法以及毛竹种子RNA 的提取方法却鲜有报道。因此,本研究以毛竹多个地上、地下组织及种子为材料,分别采用柱式Trizol法、Trizol 法、SDS 法、改良CTAB 法提取各组织的RNA,比较4 种方法提取的RNA 的质量,筛选出不同组织最适的提取方法,为进一步深入研究毛竹功能基因的作用机制、基因工程等奠定理论基础。
1 材料与方法
1.1 材料器皿
本试验所用的毛竹细根(2年生)、冬笋于2019年10月—2020年1月采自丽水市遂昌县,成熟叶、幼叶、枝采自丽水学院生态园林基地的毛竹2年生实生苗,气雾根来自气雾栽培的实生苗,种子购于四川眉山毛竹栽植基地。各个组织材料收集后立即放入液氮速冻,并保存于-70℃超低温冰箱,备用。
RNA 提取中所用的溶液均用0.1%DEPC 处理过的水配制并高压灭菌。研钵、玻璃器皿在使用之前180℃烘4~6 h,离心管、枪头等塑料器材使用121℃高压蒸汽灭菌40 min。RNA 电泳检测均使用RNA 专用的电泳槽、梳子等,避免RNase的污染。
1.2 实验方法
本研究采用了4 种RNA 提取方法,分别为柱式Trizol 法(上海生工公司)、Trizol 法、SDS 法、改良CTAB 法。
1.2.1 柱式Trizol 法
所用试剂盒为柱式Trizol 总RNA 抽提试剂盒(生工生物工程,上海),提取步骤按照试剂盒说明书进行。1 mL Trizol 溶液中加入0.2 g 样品粉末,充分混匀后,室温放置5~10 min;加入0.2 mL 氯仿,剧烈震荡30 s,室温放置3 min;4℃,12 000 r/min 离心10 min;吸取上清液到新的离心管中,加入1/2 体积无水乙醇,混匀;将吸附柱放入收集管中,用移液器将上述混匀溶液转移至吸附柱中,静置2 min,12 000 r/min 离心3 min,倒掉收集管中废液;将吸附柱放回收集管中,加入500 µL RPE solution,静置2 min,12 000 r/min 离心30 s,倒掉收集管中废液,重复该步骤一次;将吸附柱放回收集管中,10 000 r/min 离心2 min;之后吸附柱放入干净的1.5 mL 离心管中,在吸附膜中央加入30 µL DEPC-treated 水,静置5 min 后,12 000 r/min 离心2 min,所得到的RNA 溶液置于-70℃保存。
1.2.2 Trizol 法
1 g 样品粉末中加入3 mL Trizol 裂解液(生工生物工程,上海),充分混匀,室温放置5~10 min;加入0.6 mL 氯仿,剧烈震荡15 s,室温放置3 min。4℃,12 000 r/min 离心10 min;取上清液到新的离心管中,加入等体积异丙醇,混匀,室温放置20 min;4℃,12 000 r/min 离心10 min,弃上清液;加入1 mL 75%乙醇洗涤沉淀。4℃,12 000 r/min 离心3 min 后,弃上清液。室温干燥5~10 min;加入30 µL RNase-free ddH2O,充分溶解RNA,将所得到的RNA 溶液置于-70℃保存。
相对一般图书,儿童绘本图书价格偏高,如果不能对家长宣讲绘本阅读的重要性,有的家长会望而却步,导致一部分家庭难以踏入儿童绘本馆的门槛。目前,老约翰将关注点放在儿童阅读、绘本阅读上,却忽略了与家长的有效沟通,而绘本阅读自身的特性需要家长的理解和积极参与才能架起儿童阅读绘本的桥梁。
1.2.3 SDS 法
参考Vineeta 等[24]用于提取毛竹节间RNA 的方法。样品用液氮研磨,取1 g 样品至4 mL 提取缓冲液和80 μL 巯基乙醇中,常温孵育30 min,每5 min 涡旋一次;加入4 mL 混合液(V氯仿∶V异戊醇=24∶1)后涡旋5 min;室温11 000~12 000 g 离心10 min,上清液转移到新的10 mL 离心管中;添加等体积的混合液(V苯酚∶V氯仿∶V异戊醇=25∶24∶1),涡旋5 min;室温12 000 g 离心10 min 后,吸取上清液转移到新的10 mL 离心管中,重复此步骤直到观察到干净的界面(大约2 次);加入等体积的混合液(V氯仿∶V异戊醇=24∶1)涡旋5 min;室温12 000 g 离心10 min 后,转移上清液到新的10 mL 离心管中,加入1/10 体积的3 mol NaOAc(pH 值5.2)和2.5 体积预冷的无水乙醇,混匀后4℃放置2~3 h;4℃,12 000 g 离心30 min,弃上清液,重新加入750 μL DEPC 水,转移到1.5 mL 离心管中,加入250 µL 8 mol 的LiCl,4℃过夜;次日,4℃,12 000 g 离心30 min,弃上清液;加入1 mL 2 mol 的LiCl,4℃,17 000 g 离心10 min,弃上清液,重复一次该步骤;用1 mL 70%乙醇洗涤沉淀后4℃12 000 g 离心5 min,弃上清液,再用1 mL 无水乙醇4℃ 12 000 g 离心5 min,弃上清液,室温干燥5~10 min,最后加入30 µL DEPC 水溶解,所得到的RNA 溶液置于-70℃保存。
1.2.4 改良CTAB 法
在CTAB 方法的基础上进行改进,适用于提取富含多糖、多酚、色素以及单宁等次级代谢物的木本植物的改良CTAB 法,参照Chang 等[18]的方法,具体步骤如下:4 mL 的CTAB 提取液中加入80 µL 巯基乙醇,65℃水浴加热;样品用液氮研磨成粉末后,取1 g 加入到上述预热的提取混合液中,涡旋混匀,65℃水浴10 min;冷却后,加入4 mL 氯仿,涡旋混匀后室温6 000 r/min 离心15 min;吸取上清液至新管中,再加入4 mL 氯仿,涡旋之后6 000 r/min 离心15 min;取上清液至新管中,加入600 µL LiCl(8 mol)4℃过夜;次日,4℃,6 000 r/min 离心30 min,倒掉液体后,加入65℃预热的SSTE 溶液400 µL,反复吸打,将液体转移到1.5 mL 离心管里,加入等体积氯仿,混匀后10 000 r/min 离心10 min;取上清液并加入2 倍体积预冷的无水乙醇,混匀后在-70℃中放置30 min;之后在4℃下10 000 r/min 离心20 min;弃上清液,吸出残余液体后室温放置10 min,每管加30 µL DEPC 水溶解沉淀。
1.2.5 RNA 样品质量及纯度检测
取1 µL RNA 样品,使用NanoDrop 2000 微量分光光度计检测RNA 样品的纯度,分别记录OD260/OD280以及OD260/OD230比值,如果OD260/OD280在1.8~2.0范围内,说明RNA 质量良好,杂质污染少。同时用1.5%的琼脂糖凝胶进行电泳检测,通过28 S、18 S rRNA 条带亮度判断RNA 的完整性。1.2.6 DNA 的去除和cDNA 的合成
各方法提取的RNA 通过PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒(Takara)去除基因组DNA 和反转录。去除DNA 的10 µL 反应体系包括2 µL 的5×g DNA Eraser Buffer、1 µL的gDNA Eraser 以及1 µg 的RNA 样品,用RNase free ddH2O 定容至10 µL。混合反应液置于42℃放置2 min 或者室温5 min,得到的RNA 样品用来进行反转录。20 µL cDNA 合成反应体系包括10 µL上述RNA溶液、1 µL PrimeScript RT Enzyme Mix I、1 µL RT Primer Mix、4 µL 5×PrimeScript Buffer 2和4 µL RNase Free ddH2O,于37℃放置15 min,85℃反应5 s,最后保存于4℃。
1.2.7 定量PCR 检测
获得的cDNA 经过稀释进行内参基因PhPP2A的检测,使用TB GreenPremix Ex TaqtTMⅡ(Tli RnaseH Plus)进行Real Time PCR 反应。25 µL 反应体系包括12.5 µL 2×TB GreenPremix Ex TaqⅡ(Tli RnaseH Plus)、1 µL 的PCR Forward Primer(10 µmol)、1 µL PCR Reverse Primer(10 µmol)、2 µL cDNA 作为模板和8.5 µL 灭菌水。反应程序为:95℃预变性30 s;95℃变性5 s,60℃延伸30 s,读板,循环40 次;95 ℃ 10 s,熔解曲线分析65 ℃到95 ℃,每5 s 升高1 ℃。其中内参基因PhPP2A的选择参考文献[25](FP:TGTTGGCGAGTCAGTTAGGTGTTG,RP:TCAAGTTGTTAGCGGCAGCATCTC)。
2 结果与分析
2.1 不同方法对时间和试剂的消耗
运用不同的方法对毛竹主要的组织进行RNA提取,其中细根是指毛竹地下鞭节上的细根,是吸收营养的主要部分,气雾根为气雾栽培实生苗的根系,种子为去除种皮后的部分(图1)。从操作难度、耗时、成本、RNA 质量和产量5 个方面对4 种提取方法进行比较,结果见表1。由表1可知,每种方法各有优势,SDS 法所需试剂较为复杂繁多。试剂盒法耗时短且试剂准备简单,但与其他方法相比成本较高,尤其是当样品量大时所需要Trizol 试剂用量也相应增加。

表1 4 种提取毛竹组织总RNA 方法的比较Table 1 Comparison of 4 methods for extracting RNA from moso bamboo

图1 毛竹的不同组织Fig.1 Different tissues of moso bamboo
2.2 RNA 样品的凝胶电泳分析
RNA 的凝胶电泳是判断其质量高低的一种重要方法,从18 S 和28 S rRNA 的完整性可以判断RNA 有无降解及降解程度,同时还可以判断有无DNA 污染。改良CTAB 法适用于提取毛竹各种组织的RNA,柱状Trizol 法、Trizol 法和SDS法能从毛竹细根、叶片、枝以及笋等组织中提取出质量相对较好的RNA,28 S rRNA 的亮度约是18 S rRNA 的2 倍,但对于种子、细根则提取效果不佳(图2)。SDS 法提取成熟叶、种子的RNA 发生了不同程度的降解,条带拖带较为严重,其他组织18 S 和28 S rRNA 条带较为清晰,部分样品5 S rRNA 条带不明显。SDS 法包括一个额外的有机溶剂精制步骤,可去除内源性酚类化合物和酸性酚(pH 值4.2),以稳定提取缓冲液中的RNA。除此之外,还引入了2 次2 mol 氯化锂的洗涤步骤,可以消除DNA 和多糖污染。因此,SDS 法提取的RNA 中的DNA 污染少,且A260/A280大多大于2,但SDS 法耗时较长,所需试剂较多,并易发生降解(图2)。不同方法对于DNA 的去除程度不一样,电泳图显示改良CTAB 法提取出来的RNA 中的DNA 污染较为明显(图2),而其余3 种方法可以较好地除去大部分的DNA,增加RNA 的纯度。
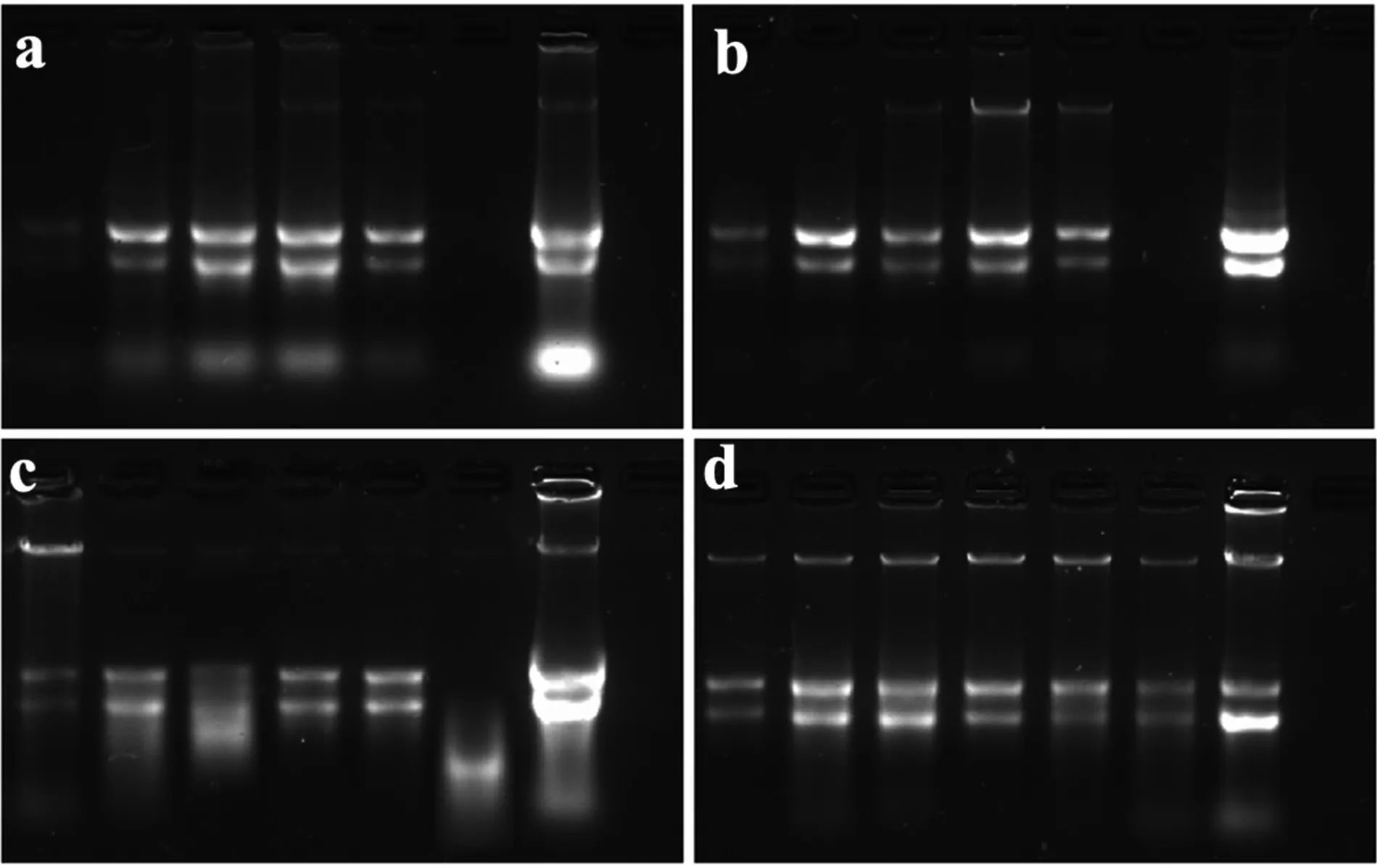
图2 各组织RNA 凝胶电泳Fig.2 RNA Gel electrophoresis of different tissues
2.3 RNA 浓度与纯度分析
进一步测定RNA 浓度,比较4 种方法提取的RNA 的质量和纯度。不同方法得到的RNA 浓度因材料而异,幼嫩的组织如幼叶、气雾根、笋等浓度较高。Trizol法中的样品受到5 S rRNA的影响,浓度偏大,尤其是在笋、气雾根、成熟叶和幼叶中。SDS 方法中RNA 浓度虽然与其他3 种方法相比有显著差异,但由于样品发生降解,短片段增多导致浓度增大,其RNA 质量不适合用于后续的分子生物学试验。对于细根和种子样品,改良CTAB法提取的RNA 浓度优于其他方法,尤其是种子,与其他3 种方法相比均有显著性差异(表2)。
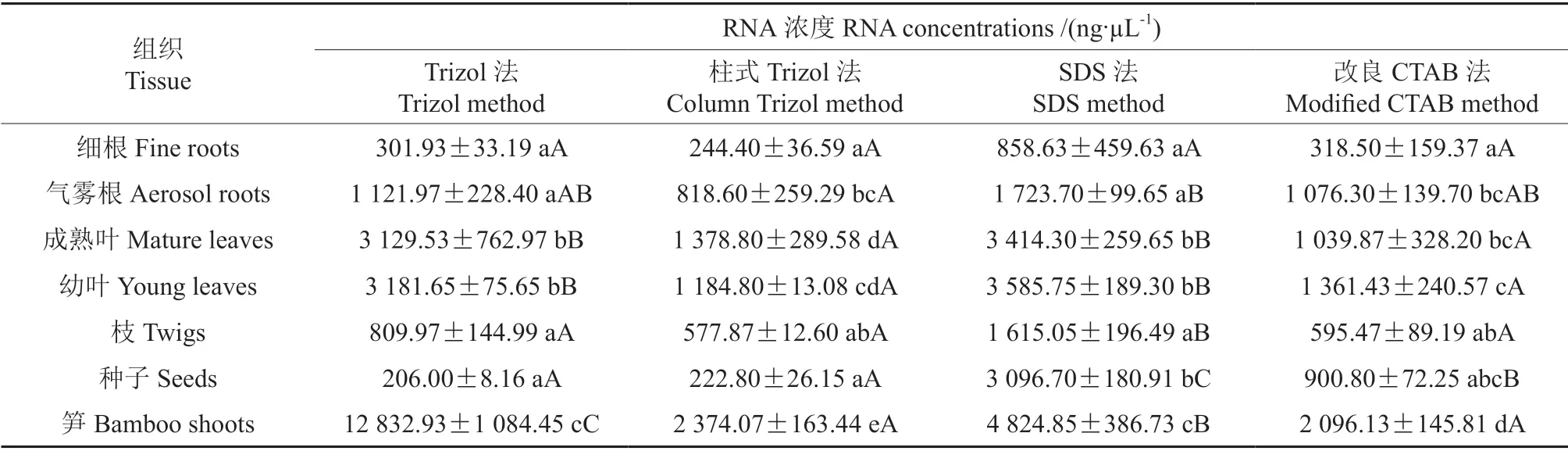
表2 不同方法提取毛竹组织RNA 的浓度†Table 2 RNA concentrations by using different methods from tissue of moso bamboo
RNA 的纯度可以通过A260/A280、A260/A230的比值判断,一般情况下,A260/A280越接近2 则越纯,低于1.8 可能存在蛋白质或者酚类物质污染。柱式Trizol 法和Trizol 法提取细根和种子总RNA 的A260/A280低于1.8,其余均大于1.8,其中SDS 法和改良CTAB 法的A260/A280大多数在2~2.11 之间,表明RNA 纯度较高,样品中不含蛋白质及苯酚的残留或残留少(图3)。样品中存在碳水化合物、盐(胍盐)、小分子物质等污染物时,A230值会随之增加,使用柱式Trizol 法和Trizol 法提取的RNA 中A260/A230均在2 以下,说明可能存在盐(胍盐)等残留,其余两种方法则大多在2 以上,进一步说明RNA 纯度较好(图3)。
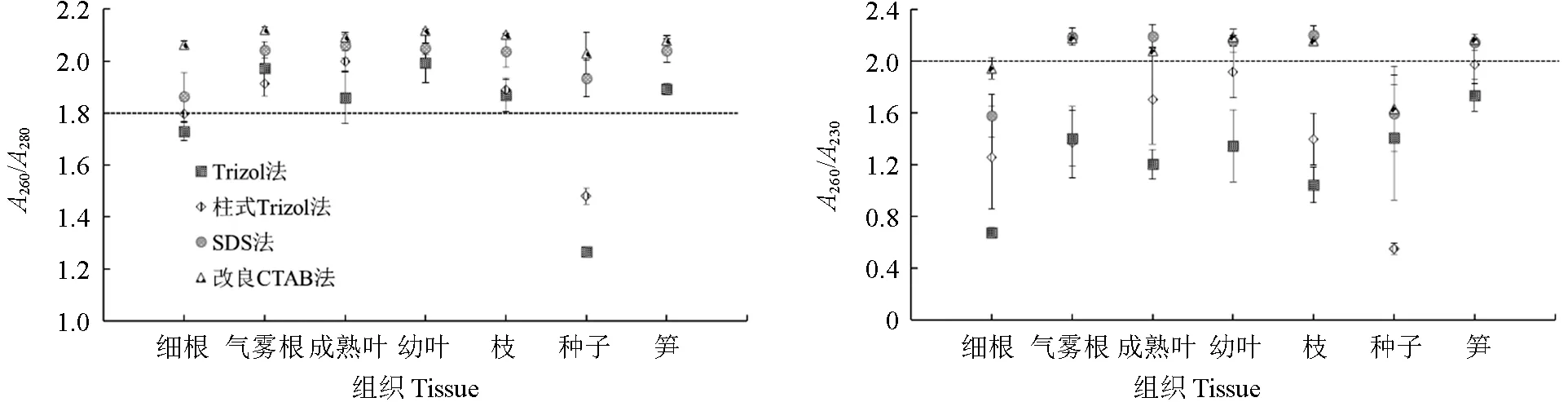
图3 不同组织RNA 的质量Fig.3 Quality of RNA in different tissues
综合比较4 种总RNA 提取方法,柱式Trizol法和Trizol 试剂盒法所需样品量少,提取总RNA的浓度相对较高,但不适用于对毛竹种子、细根的提取;SDS 法提取RNA 中DNA 污染少,但易降解且步骤繁琐;改良CTAB 法适用于各组织,包括细根和种子,并且提取的总RNA 纯度较好,但存在DNA 的污染。改良CTAB 法与其他3 种方法相比能更有效地提取RNA,且纯度高,但DNA 杂质较为明显,表明DNA 处理不充分,后续通过对DNA 杂质进行适当处理后可以达到其他试验的要求。
2.4 QRT-PCR 分析
样品经过去除DNA、反转录为cDNA 后,将得到的cDNA 样品分别进行2 倍、5 倍、10 倍稀释,以PhPP2A为内参基因进行定量PCR,再以标准品拷贝数的对数值为横坐标、以测得的Cq值为纵坐标绘制标准曲线,从稀释曲线上计算扩增效率,其计算公式见文献[26],经计算,扩增效率约为102%,表明cDNA 样品质量较好(图4a)。PCR扩增产物用1.5%琼脂糖凝胶电泳检测,每种方法所用组织样品顺序依次是细根、气雾根、成熟叶、幼叶、枝、种子、笋,除了发生降解的样品和部分种子样品外,其他样品的cDNA 均能扩增出内参基因PhPP2A片段,条带单一清晰,长度约150 bp(图4)。
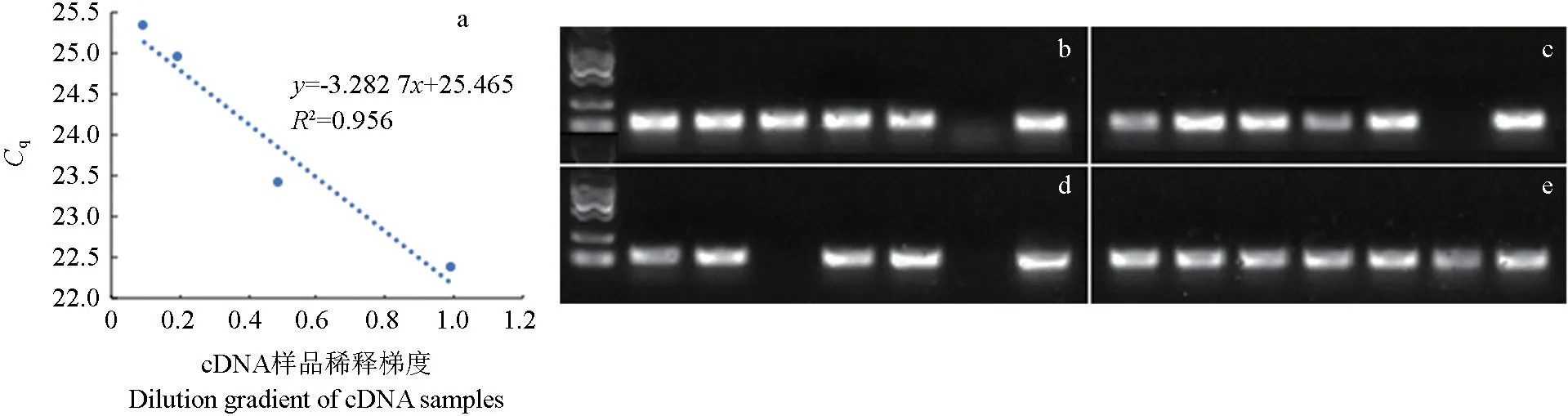
图4 内参基因的凝胶成像Fig.4 Gelation of internal reference genes
反转录效率受到不同样品中杂质的影响,内参基因的本底表达量也有所差异。气雾根、成熟叶、幼叶、枝、笋等样品的反转效率较高,大多数的Cq值在21~22 之间。相比改良CTAB 法,其他3 种方法提取的细根样品由于A260/A280比值均低于1.8,可能有蛋白等杂质的影响,并且本身的浓度低,反转录效率较低,Cq值在25~28 之间,采用改良CTAB 法提取的细根RNA 在反转录相同量后,它的Cq值达到了23.07(表3)。毛竹种子淀粉含量多,RNA 提取难度较大,4 种方法中仅有改良CTAB 法适合提取,但纯度不高,杂质的影响使反转录后的Cq值为28.32,可用于一些常规的分子生物学实验。
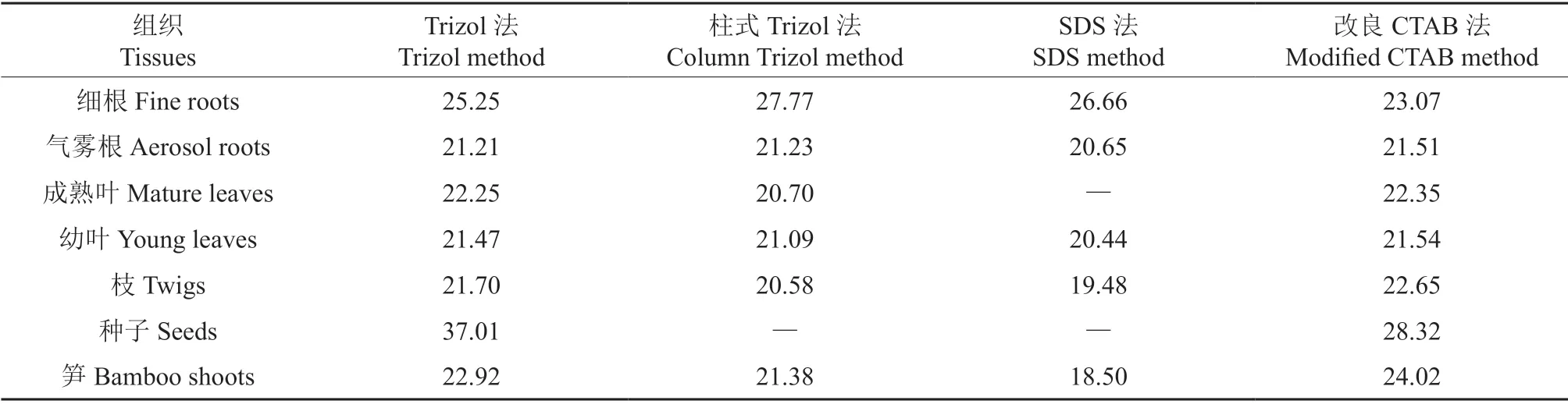
表3 不同提取方法各组织cDNA 内参基因的Cq 值†Table 3 Cq value of internal reference gene in different methods and tissues
3 结论与讨论
不同RNA 提取方法各有优缺点,在物种或组织上的可适用性存在差异,选择合适的方法是获得高质量RNA 的前提[27-29]。目前已经总结出了很多科学高效的RNA 提取方法,基本原理是将植物组织细胞破碎以后,把RNA 与蛋白质、糖类以及DNA 等杂质分离出来,在实际操作中,可以根据实际情况,包括时间成本、所需试剂量以及不同组织的特点等进行选择。
Trizol 法是最常用的RNA 提取方法之一,柱式Trizol 法是在Trizol 的基础上加入了吸附柱,利用裂解液促使细胞破碎,使细胞中的核酸释放出来,把释放出的核酸特异地吸附在特定的硅载体上,这种载体只对核酸有较强的亲和力和吸附力,对其他生化成分如蛋白质、多糖、脂类则基本不吸附,最终把吸附在特异载体上的核酸洗脱下来,分离得到纯化的核酸,使提取过程更加简单易操作,这两种方法耗时短,但可能会有胍盐残留,使A260/A230下降。同时这两种方法有一定的局限性,不适用于一些多酚、糖类物质比较高的组织,例如檀香心材、野生香蕉叶片等[30-31],对毛竹木质化程度较高的细根以及富含淀粉的种子等组织的提取效果也不好。本研究中两种试剂盒法所提取的总RNA 产率低于另外两种方法,与在菠萝蜜中的研究结果一致[32]。SDS 法和改良CTAB 法适用于一些难提取的植物或组织,如木本植物的组织等[33]。本研究中的SDS 法参考毛竹节间RNA 提取方法,提取的RNA 浓度较高,但步骤繁琐,耗时长,增加了RNase 污染机会,易发生RNA 降解。改良CTAB 法步骤较为简单,对毛竹不同组织材料RNA 的提取均有不错的效果,包括了细根和种子。从毛竹各组织的提取结果来看,改良CTAB法对各组织具有很好的适用性。
目前,关于毛竹的研究主要集中在叶片、花、笋等组织中,而一些木质化程度较高的枝、根及淀粉含量高、坚硬的种子等还较少涉及,RNA 提取难度大可能是限制相关研究开展的一个重要因素。本研究中的4 种方法能够提取出细根的RNA,但产率低,其中改良CTAB 法提取的RNA 反转效率最高,Trizol 法次之。对于种子,改良CTAB 法提出的RNA 质量最好,但反转录效率不高,可用于一般的分子生物学实验。本研究可以为后续开展针对根系、叶片、种子等方面的研究提供一定的技术支持,但局限在于仅涉及到了较为常用的4种提取方法,对于试剂盒法不同公司产品的提取效率也会有所差异,因此在下一步研究中,可以通过多次优化、合理组合等方式,进一步地探索出提取毛竹各组织RNA 的最适方案,为加快竹类植物分子生物学研究提供理论参考。

