藻菌混合结皮对土壤水肥保持及玉米幼苗生长的影响
陆贺港, 任梦楠, 黄海东
(天津农学院 农学与资源环境学院, 天津 300392)
由于人们对部分自然资源的不合理利用,或自然环境变动等种种原因,导致了土壤性质与土壤结构改变,土壤中的微生物数量与土壤酶活性降低,水土保持能力急剧下降[1],并严重影响了农作物的种植[2]。因此,寻求绿色有效的土壤生态与结构修复方法,成为治理土壤的关键。大量分布于荒漠地区的土壤生物结皮,在土壤生态修复方面具有广阔的应用前景,受到了科学家们的广泛关注。作为干旱或半干旱地区常见地表景观,生物结皮是由土壤中的细菌、藻类、地衣及苔藓等生物,其通过菌丝体、假根以及分泌物与土壤颗粒结合,共同形成生物土壤层[3]。具有生物结皮的土壤可以增强土壤的水肥保持效果,使土壤结构更加稳定,并表现出明显的抗风雨侵蚀能力[4]。目前,在制备生物结皮的研究中,大多数研究者关注于藻类、苔藓以及真菌等一种或几种形成的生物结皮,而对于细菌介入的藻类生物结皮讨论较少[5]。研究[6]表明,藻类所构成的土壤结皮,属于结皮发育的早期形态,其形成及维持的制约因素较多,水肥保持的稳定性不强,土壤生态环境恢复慢。据报道,微生物产生的胞外多糖(exopolysaccharides, EPS)可以加快土壤结皮形成,提升土壤保水效果[7],而藻类产生EPS限制因素多,产生量少,对土壤凝集效果弱[8]。针对这一现象,本文将能够大量产生EPS的细菌[9-10]引入土壤并与藻类形成混合生物结皮,并通过研究藻菌混合结皮的水肥保持效果,及其对土壤微生物数量、酶活性和盆栽玉米幼苗的影响,为藻菌混合结皮的土壤治理策略提供理论依据。
1 材料与方法
1.1 供试菌株与玉米种子
供试细菌Sphingomonassp. D3-1与Massiliaarmeniacasp. ZMN-3,供试藻类CladophoraaegagrophilaD3-a与NostocsphaeroidesD3-25,于2016年6月12日分离自内蒙古翁牛特荒漠化地区(东经119°01′16″,北纬43°01′19″)。供试玉米为先玉335,由自选系PH6 WC为母本,PH4 CV为父本组配而成。
1.2 培养基与培养条件
牛肉膏蛋白胨培养基;高氏1号培养基,使用时每300 ml培养基加入3%重铬酸钾1 ml;马丁氏培养基,加入1%孟加拉红水溶液,使用时每100 ml培养基加入1%链霉素0.3 ml;BG11培养基[11],恒温20 ℃,光照强度4 000~6 000 lx(日光灯),光照周期16 h∶8 h;EPS合成菌筛选培养基(g/L):酵母膏5.0 g,蛋白胨5.0 g,酸水解酵素5.0 g,葡萄糖5.0 g,可溶性淀粉5.0 g,丙酮酸钠3.0 g,磷酸氢二钾3.0 g,硫酸镁0.5 g,琼脂粉15.0 g,pH值7.0~7.5,30 ℃恒温;供试发酵培养基(g/L):蔗糖40 g,磷酸氢二钾1.8 g,硫酸镁0.4 g,硫酸亚铁0.008 g,硫酸铵2.6 g,酵母粉1.5 g,pH值7.0~7.5。
1.3 供试土壤
供试土壤于2017年8月采自天津市武清区王庆坨(东经116°91′07″,北纬39°19′27″),砂质潮土,自然风干,全氮0.59 g/kg,有效磷5.28 mg/kg,速效钾37.25 mg/kg,有机质10.73 g/kg,pH值8.13。
1.4 试验方法
1.4.1 微生物制剂的制备及结皮形成 试验开展于2017年9月,采用室内盆栽模拟的方法。250 ml三角瓶装100 ml发酵培养基,分别接入2种供试菌,置于旋转式摇床180 r/min,30 ℃震荡培养72 h,取其发酵液进行1∶1混合后稀释至7.0亿 CFU/ml作为菌剂;将2种供试藻分别于光照培养箱培养30 d,经富集、冷冻干燥得到藻粉进行1∶1混合,配制浓度为0.75%制剂作为藻剂。将菌剂与藻剂进行等比混合,得到藻菌混合剂。将各生物制剂喷洒至土壤表面,形成土壤结皮。
1.4.2 生物结皮保水性测定 将供试土壤130 g置于塑料花盆中(圆形,直径6 cm,高6.5 cm),分别加入20 ml水(CK)、菌剂、藻剂和藻菌混合剂,分别设置3次重复,室温下自然蒸发,定时称重计算土壤含水量,并观察土壤结皮的形成。待各处理水分均完全蒸发后再次分别加入水15 ml,进行第二轮保水试验。
1.4.3 生物结皮保肥性测定 将供试土壤130 g置于塑料花盆中。花盆的形状和尺寸同保水性测定试验。底端打4圆孔,孔直径0.5 cm,距中心1.5 cm,底端铺纱布两层。在花盆中分别加入30 ml水(CK)、菌剂、藻剂和藻菌混合剂,各盆中分别施加100 mg硫酸铵、硫酸钾和磷酸二氢钾,分别重复3次,室温放置,第8 d与第15 d分别加水25 ml淋溶,收集淋出液并使用Bioprofile300 A多参数生化分析仪测定淋出液中的氨离子、磷酸根离子及钾离子含量。
1.4.4 生物结皮对土壤微生物数量影响 使用经保水处理30 d后的土壤进行培养,培养方法详见表1。培养后采用平板计数法统计各微生物数量变化,并观察水肥保持试验后供试菌株在土壤中的存活情况。
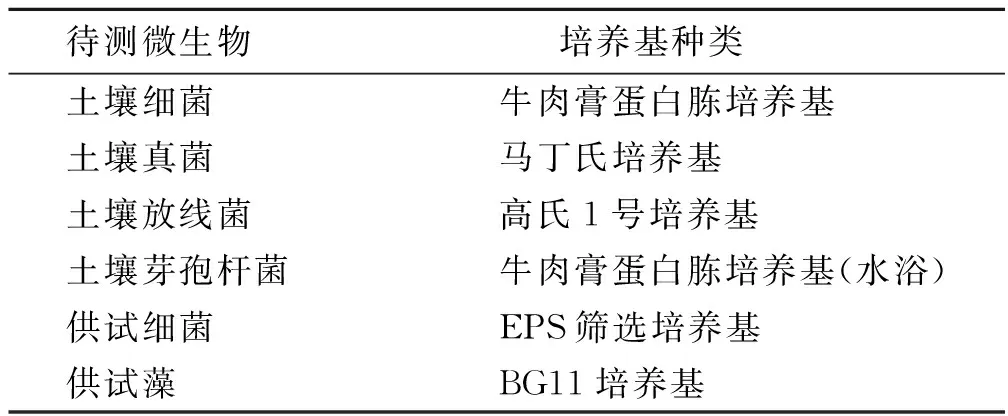
表1 微生物培养方法
1.4.5 生物结皮对土壤酶活性影响 土壤样品为保水试验处理30 d后的土壤。土壤中的脲酶采用靛酚蓝比色法测定,蔗糖酶采用3,5-二硝基水杨酸比色法测定,过氧化氢酶采用高锰酸钾滴定法测定[12]。
1.4.6 生物结皮对玉米幼苗生长影响 供试土壤5 kg中加60 ml水浸润,置入塑料栽培盆中(圆形,直径25 cm,高18 cm;底具2圆孔,孔径1 cm,距圆心5 cm),在土壤表面放入经清水浸种24 h,25 ℃光照催芽后的玉米种子5颗,覆土1 kg,每盆分别加入菌剂、藻剂、藻菌混合剂及水(CK)各40 ml,分别设置3次重复,放置于25 ℃恒温光照培养箱中光照与黑暗12 h交替培养,于第7,10,13及15 d时分别加水20,20,30和30 ml,生长至20 d时收获幼苗,测量与比较各幼苗的地上/下长(高)度、地上/下重量(鲜/干重),并使用叶绿素测定仪(SPAD,日本Konica minolta)测定叶绿素含量。
1.4.7 数据整理与分析 使用Excel 2019进行数据整理;使用Origin 2018绘图;利用SPSS 23进行数据分析,并使用LSD法进行多重比较。
2 试验结果与分析
2.1 生物的形成及保水效果
将菌剂、藻剂及藻菌混合剂喷洒于土壤表面后,第2天即可观察到土壤表面形成结皮。从图1可以看出,由于结皮保水作用,处理组水分蒸发量明显减少,在第3 d时便展现出明显差异,至第12 d时,细菌、藻类及藻菌混合结皮中土壤含水量分别比对照提高161.0%,15.0%和248.5%,第二次保水试验表明生物结皮与对照相比有着明显的持效性,至第12天时,细菌、藻及藻菌混合结皮中土壤含水量分别比对照提高56.6%,34.4%和61.2%(图1)。保水试验结果表明,藻菌混合结皮具有更稳定的水分保持效果,并且保水性以菌剂为主导,而藻剂结皮表现出的保水效果相对较弱。

图1 不同生物结皮含水量的变化
2.2 生物结皮的保肥效果
由图2可知,淋溶试验中,在藻菌混合结皮影响下,土壤中的氮、磷和钾的淋失量与CK相比分别减少了79.8%,38.8%和63.2%,在第2次淋溶试验中淋失量分别减少了74.0%,89.9%和32.3%。从图2可以看出,藻菌混合剂结皮对土壤肥料淋出降低效果更明显。在土壤中,大部分植物所需的营养元素会随着水的流失而减少[13],细菌产生的EPS对土壤颗粒有着凝集作用,形成土壤结构可以有效阻止土壤水分的蒸发或渗透,进而增强了土壤的保肥效果[14],而藻类生长与细菌相比更缓慢,但其形成结皮也具有较强的保肥效果[15]。
保水保肥试验表明,藻菌混合结皮可以使土壤的水肥保持效果明显提高。
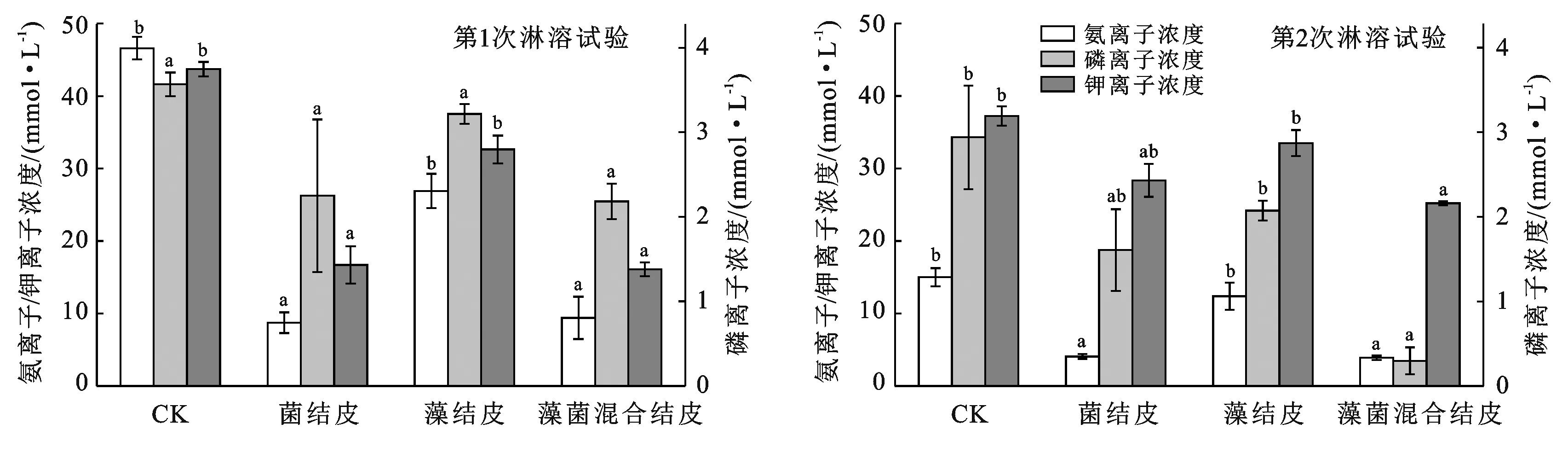
注:不同小写字母表示各处理间差异显著(α=0.05)。下同。
2.3 生物结皮对土壤微生物数量的影响
土壤微生物的数量与组成,可以在一定程度上反映出土壤的优劣程度,与土壤中的元素循环、污染修复及植物根际免疫力的调节直接相关[16]。由图3可以看出,与试验前相比,CK条件下仅使芽孢杆菌数量显著降低,而其余微生物指标变化差异不显著。与CK相比,藻菌混合剂对土壤细菌、真菌和放线菌数量增加效果显著,其数量分别增加8.3,1.8和3.1倍。除藻菌混合剂外,其余处理下的土壤芽孢杆菌数量均显著降低,与试验前相比,藻菌混合剂处理的芽孢杆菌数量降低了12.4%,菌剂与藻剂分别降低了32.6%和50%,其致死原因有待研究。刘玉冰等[17]认为生物结皮可明显提升土壤微生物数量,也与本文研究结果相符。保水保肥试验后的土壤样品经培养后,在EPS培养基及BG11培养基中可分离出大量质地黏稠菌落,通过形态学及分类学鉴定,确定为4种试验菌株。试验菌株的存活,进一步证实了藻菌混合结皮保水保肥的持效性。

图3 不同生物结皮的土壤微生物数量变化
2.4 生物结皮对土壤酶活性的影响
土壤中脲酶、蔗糖酶及过氧化氢酶的活性可以作为土壤生化反应强度的理论依据[18]。由图4可知,藻菌混合剂形成的结皮对蔗糖酶和脲酶活性的提升与其他处理差异显著,而过氧化氢酶活性的提升与菌剂和藻剂处理相比无显著性差异;藻菌混合剂处理对蔗糖酶、过氧化氢酶及脲酶活性与对照相比,分别提高1.5,1.2和4.3倍。Ghiloufi等[19]研究表明,土壤酶活性主要由土壤中的水和有机物等环境因素控制,而与微生物数量的相关性并不显著。在藻菌混合结皮形成后,土壤中的环境变得更适宜,从而提升了土壤酶活性。杨航宇等[20]也均认为土壤生物结皮会提高劣化土壤的酶活性。土壤微生物与土壤酶活性试验结果分析表明,藻菌混合结皮可以改善土壤的生态环境。
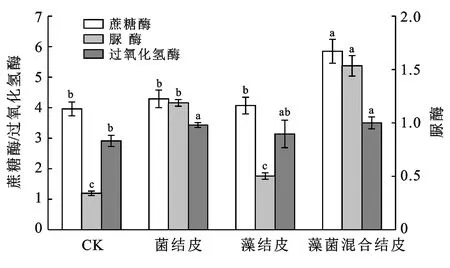
注:脲酶和蔗糖酶活性单位为mg/(g·d);过氧化氢酶活性单位为mg/(g·h)。
2.5 生物结皮对玉米幼苗生长的影响
从表2可以看出,藻菌混合剂处理在各项指标中与CK相比差异显著。其中,藻菌混合剂处理的地上部的鲜/干重与CK相比分别增加了30.0%和55.6%,根部的鲜/干重分别增加了55.4%和38.5%,地上部长度增加16.5%;而对根部长度影响中,藻结皮使玉米幼苗根长度长度增加了28.3%,藻菌混合结皮使幼苗根长度增加了18.0%;另外,藻菌混合剂使植株叶绿素含量增加了15.1%。试验数据表明,除根长度指标外,细菌在藻菌混合结皮中起主导作用。藻结皮对玉米幼苗根部长度的增加影响较大,表明藻类形成的土壤结构更有利于玉米幼苗根部发育,饶本强等[15]也认为藻类结皮会改善土壤条件,促进植物的生长繁殖。玉米盆栽试验结论,为藻菌混合结皮的进一步利用提供了参考。
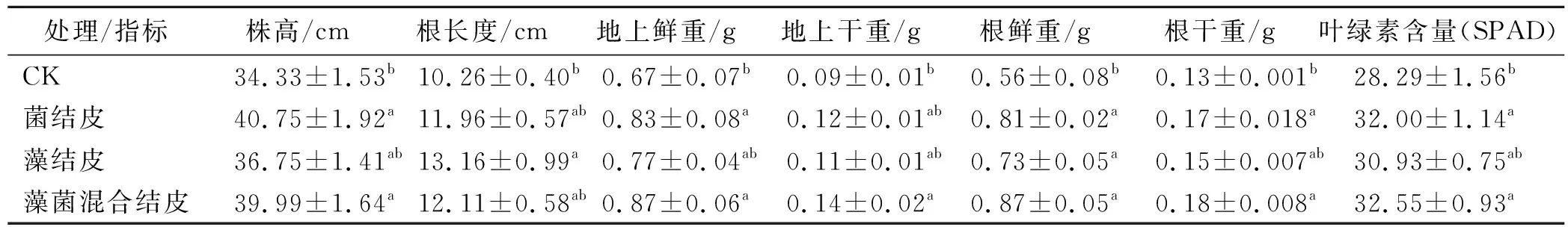
表2 不同生物结皮对玉米幼苗生长影响
3 讨 论
在土壤结皮的形成及发育过程中,藻类生物维持与稳定了土壤的生态结构,与土壤环境密切相关[21]。细菌作为土壤中的活跃组分,可以增强土壤肥力,优化土壤生态环境[22]。将藻类与细菌混合为藻菌混合剂,然后将其均匀喷洒至土壤表面形成混合生物结皮,细菌产生EPS对土壤颗粒与微生物进行固定,同时,自养型的藻类为异养型的细菌提供生长条件,细菌产生的EPS还可作为呼吸底物供土壤微生物利用[8]。在本研究中,将可以大量产生EPS的细菌加入土壤中,繁殖速度快的细菌与大量EPS,配合藻类生物,提升了土壤凝集效率,促进了土壤团粒结构形成,增强了土壤结皮早期的稳定性,提高了水资源利用率,增强了土壤微生物活动,提高了土壤酶活性以及土壤生化反应强度[23-24]。此外,在藻菌结皮影响下的土壤栽培玉米幼苗时,发现藻菌混合结皮会加快玉米幼苗的生长速度,提高植物活力。但是,细菌可能产生过多EPS,对多孔土壤团聚体的产生提供了可靠帮助的同时[25],也可能影响玉米根系的生长发育,而使藻菌混合结皮的根长度短于藻类结皮,因此细菌使用量不宜过大。藻类与细菌的共同作用,弥补了早期结皮形成及发育缓慢与水肥保持效果差的劣势。试验分析表明,藻菌混合结皮的形成,为土壤的生态的修复与改良提供了有效的帮助。
由于微生物活动易受环境影响,如应用于土地过酸过碱、地温过高或过低以及土壤水分严重不足的区域时,藻菌混合剂发挥的作用会小于受环境影响小的化学类保水剂。在利用藻菌混合结皮时,应需考虑环境因素,展开综合治理。例如,在耕地退化区域中人类活动频繁、雨水充足时[26],适合藻菌混合结皮使用;在荒漠化地区,虽降雨不足但仍有可利用的土壤水[27],也可采用藻菌混合结皮进行治理;沙漠地区严重缺水,空气湿度低,降雨稀少,土壤环境不适宜[28],应结合其他治理措施辅助进行;水土流失区往往水分充足,但因土壤沙化、制备覆盖少而使土壤被水冲刷,引起土壤养分流失和环境问题[29],也适宜利用藻菌混合结皮进行综合改良。本研究结果对藻菌混合结皮的土壤治理效果提供了理论支撑,但藻菌配比优化研究还有待下一步开展,对藻菌的相互关系是否为共生关系,还有待进一步研究。
4 结 论
本研究中,我们通过研究藻菌混合结皮的形成与土壤水肥保持及玉米幼苗生长的关系,发现藻菌混合结皮使土壤的水肥保持效果明显提高,并使土壤中的细菌、真菌和放线菌数量显著提高,还增强了土壤蔗糖酶、过氧化氢酶及脲酶的活性。此外,在玉米盆栽试验中,玉米幼苗的重量、长度及叶绿素含量也因藻菌混合结皮的影响显著增加。结果表明,藻菌混合结皮可以改善土壤生态环境,增强土壤的水肥保持效果,为以结皮法治理土壤提供了理论基础。

