广西巴马小型猪与长白猪的BMP2和FGFR3基因序列及表达差异分析
李小楷 黄全奎 奉玲丽 郭亚芬 梁晶 兰干球


摘要:【目的】明確广西巴马小型猪与长白猪的BMP2和FGFR3基因序列及表达差异,为进一步阐明大型猪与小型猪的体型形成机制提供理论依据。【方法】以1日龄的广西巴马小型猪和长白猪为研究对象,采集其四肢骨生长板软骨组织提取总RNA,反转录合成cDNA后用于扩增BMP2和FGFR3基因的编码区(CDS)序列,采用PCR-RFLP检测FGFR3基因SNP位点多态性,并通过实时荧光定量PCR分析BMP2和FGFR3基因在1日龄广西巴马小型猪和1日龄长白猪生长板软骨组织中的表达差异。【结果】1日龄广西巴马小型猪与1日龄长白猪的体型差异明显,其体重、体长和体高的差异均达极显著水平(P<0.01,下同),股骨长的差异达显著水平(P<0.05,下同)。广西巴马小型猪和长白猪的BMP2基因CDS序列全长1188 bp,且2个品种猪的CDS序列完全一致;广西巴马小型猪和长白猪的FGFR3基因CDS序列全长808 bp,与NCBI已公布的FGFR3基因序列(XM_005666479.1)比对发现存在8个碱基突变位点及1个碱基缺失位点。广西巴马小型猪和长白猪共有5个错义突变位点,分别为A124G、C190G、A204C、C205A和C245T,另外3个突变位点是广西巴马小型猪A438G和C549T的同义突变及长白猪A752C的错义突变;碱基缺失位点为长白猪第328~330个碱基(GCA)缺失。FGFR3基因A2374G和C2620T位点的基因型及基因频率在广西巴马小型猪与长白猪间的分布差异极显著,对应的等位基因分布均不符合Hardy-Weinberg平衡,且2个基因座均处于连锁平衡状态。1日龄广西巴马小型猪生长板软骨组织中的BMP2基因相对表达量显著低于1日龄长白猪,而FGFR3基因相对表达量极显著高于1日龄长白猪。【结论】BMP2和FGFR3基因在猪的软骨和骨骼形成方面具有重要意义,其中,BMP2基因对猪骨发育起促进作用,而FGFR3基因对猪骨发育起抑制作用。广西巴马小型猪体型矮小与FGFR3基因高表达及BMP2基因低表达存在直接关联。
关键词: 广西巴马小型猪;长白猪;BMP2基因;FGFR3基因;SNP位点;体型;表达差异
Abstract:【Objective】Clarify the BMP2 and FGFR3 genes sequences and expression differences between Guangxi Bama mini pig and Landrace pig, and provide theoretical basis for elucidating the formation mechanism of large and small pigs. 【Method】The growth plate cartilage tissue of appendicular skeleton from one-day-old Guangxi Bama mini pig and Landrace pig was used to extract total RNA. After that, the total RNA was reverse transcribed to synthesize cDNA and then used for PCR amplification of the coding region(CDS) sequence of BMP2 and FGFR3 genes. PCR-RFLP was used to detect the polymorphism of the SNP locus of FGFR3 gene. The expression differences of FGFR3 and BMP2 in one-day-old Guangxi Bama mini pig and Landrace pig were compared by real-time fluorescence quantitative PCR. 【Result】The results indicated that the body type of one-day-old Guangxi Bama mini pig and one-day-old Landrace pig were greatly different, and the differences in body weight, body length and body height were extremely significant(P<0.01, the same below), and the difference in femoral length reached a significant level(P<0.05, the same below). A full length of BMP2 gene CDS with 1188 bp was cloned from Guangxi Bama mini pig and Landrace pig, respectively,and the CDS sequence between the two breeds were completely consistent. The CDS sequence of FGFR3 gene with 808 bp cloned from Guangxi Bama mini pig and Landrace pig were found to have 8 base mutations and 1 base deletion when compared with the published FGFR3 sequence from NCBI(XM_005666479.1). Five mutations, which were A124G, C190G, A204C, C205A and C245T missense mutations,were detected in Bama mini pig and Landrace pig,and A438G and C549T synonymous mutations in Guangxi Bama mini-pig and A752C missense mutation in Landrace pig were found, respectively. There were 328-330 base(GCA) deletion in Landrace pig. The genotype and gene frequency of FGFR3 gene in A2374G and C2620T loci were extremely significant difference between Guangxi Bama mini pig and Landrace pig. The corresponding allele distributions were not in accordance with Hardy-Weinberg equilibrium, but the two loci were in the state of linkage disequilibrium. Compared to Landrace pig, the cartilage tissue of the growth plate of one-day-old Bama mini pig had significantly lower BMP2 expression, but the FGFR3 gene expression level was extremely significantly higher than that of Landrace pig. 【Conclusion】BMP2 gene and FGFR3 gene have important significance in the formation of cartilage and bone. Among them, BMP2 promotes the development of pig bone, and FGFR3 gene inhibits the development of pig bone. It is speculated that the short size of Guangxi Bama mini-pig is directly related to the high expression of FGFR3 and the low expression of BMP2.
Key words: Guangxi Bama mini pig; Landrace pig; BMP2 gene; FGFR3 gene; SNP site; body type; expression difference
0 引言
【研究意义】猪的品种繁多,且其体型差异明显。成年长白猪的平均体重可达100 kg(侯建君等,2006;何道领,2016),而成年广西巴马小型猪的体重仅有45 kg左右。体型性状是一类重要的表型性状,测定指标主要包括体长、体高、管围和腹线等。猪的体型与其繁殖性状、生长性状和肉质性状等存在一定关联。对母猪而言,体型特征与其使用年限高度相关,体型大的母猪能分娩出更多仔猪(李完波等,2016;宋志芳等,2017)。此外,体型能间接影响期望的育种目标,对于父系猪的选育尤其重要。因此,从基因水平阐明不同猪群间的体型差异形成机制,可为开展猪育种工作提供有利的参考依据。【前人研究进展】广西巴马小型猪呈两头乌的特点,体型小,性成熟早,是我国小型猪的主要品种之一(王爱德等,2010);具有遗传稳定和易于实验操作等优点,是研究人类异种器官或组织的优势动物模型(邹迪莎和于健,2017;田永章等,2019;江雨航等,2020)。任红艳(2014)研究发现,动物体型调控是一个复杂的过程,外界环境因素如营养和温度等能通过各种基因及信号途径作用于细胞增殖或凋亡等多个过程,最终通过影响体内细胞数量和细胞大小而控制动物体型。Wang等(2019)研究证实,动物体型及其器官一定程度上受细胞数量和大小的影响,且生长、增殖及凋亡等细胞行为是决定动物体型的主要因素。Zhang等(2020)研究表明,间充质干细胞(MSC)和卫星细胞(SC)通过调控骨组织及肌肉组织的发育而影响动物体型。骨形态发生蛋白(Bone morphogenetic proteins,BMPs)又称发育和分化因子(GDFs),属于转化生长因子-β(TGF-β)家族(Sonia,2016),积极参与肾脏发育、肢体形成、血管生成、组织纤维化及肿瘤发展等(Lin et al.,2016)。成纤维细胞生长因子受体(Fibroblast growth factor receptor,FGFR)是一类具有自身磷酸化活性的IV型跨膜糖基化受体,其家族成员属于酪氨酸激酶受体,在细胞增殖分化、血管生成、骨骼形成、伤口愈合及生长发育等进程中发挥重要作用(李潇等,2017)。FGFR3与软骨和季肋发育不全及致死性发育不全密切相关,对软骨发育起重要作用(莫奇非等,2019)。温轩(2013)研究发现,FGFR3基因和BMP2基因在软骨内骨化过程中发挥重要作用。Wang等(2021)研究发现,多西环素(DOX)介导BMP2释放的基因工程祖细胞株(C3H10T1/2)可修复感染性骨缺损。此外,Sundaresan等(2019)验证发现FGFR与胚胎发育及肿瘤的病理生理过程密切相关;Servetto等(2021)证实FGFR与乳腺癌的信号传导及内分泌抵抗相关。【本研究切入点】不同动物间或同种动物间的体型均存在明显差异(刘楠,2012),且各种因素交织影响着动物体型的调控机制。BMP2基因在骨组织的发生和修复中扮演重要角色,能提供成骨信号,是动物出生后骨骼内稳态的重要调节因子(刘艳等,2016);而人类可遗传的侏儒综合征是由FGFR3基因错义突变所引起(姜煜等,2017)。可见,BMPs与FGFR表现出完全不同的功能,二者在调节软骨发育上可能存在相互拮抗作用,但具体机制尚未明确(Mina et al.,2002)。【拟解决的关键问题】从基因及其相关信号途径调控动物体型的角度出发,分析广西巴马小型猪与长白豬的BMP2和FGFR3基因序列及表达差异,以期为进一步阐明大型猪与小型猪的体型形成机制提供理论依据。
1 材料与方法
1. 1 试验材料
采集1日龄广西巴马小型猪和1日龄长白猪的四肢骨生长板软骨组织。其中,广西巴马小型猪由广西大学广西巴马小型猪繁育中心提供,长白猪购自广西里建桂宁种猪有限公司。每个品种随机选取6头,测量其体重及体长、体高和股骨长等体尺性状,通过t检验对2个品种猪的体重和体尺性状进行差异显著性检验。pMD18-T载体和柱式软骨RNAout试剂盒购自宝生物工程(大连)有限公司;dNTPs购自生工生物工程(上海)股份有限公司;大肠杆菌Trans5α感受态细胞购自北京全式金生物技术有限公司;血液基因组DNA提取试剂盒及Marker II购自天根生化科技(北京)有限公司;胶回收试剂盒购自杭州博日科技股份有限公司;去内毒素质粒提取试剂盒(Plasmid Mini Kit I)购自OMEGA公司。
1. 2 引物设计与合成
在NCBI(https://www.ncbi.nlm.hih.gov/)检索猪的BMP2基因序列(NM_001195399.1)和FGFR3基因序列(XM_005666479.1),利用Oligo 7.0设计特异扩增引物,BMP2和FGFR3基因扩增引物如表1所示。BMP2基因扩增片段长度1188 bp,包含整个编码区(CDS)序列;FGFR3基因扩增片段长度808 bp。根据FGFR3基因CDS序列分析结果,并参考NCBI已公布FGFR3基因全序列(GenBank ID:100514115)设计扩增引物(表1),然后利用RFLP分析FGFR3基因SNP位点多态性;同时根据FGFR3基因全序列(GenBank ID:100514115)设计特异扩增引物,改变FGFR3-2374引物下游3'末端第1个碱基C→G及FGFR 3-2620引物下游3'末端第1个碱基C→T,引入Taq I酶切位点,Taq I可识别并切断序列TCGA(表1)。所有扩增引物均委托华大基因科技股份有限公司合成。
1. 3 总RNA提取及cDNA合成
采用柱式软骨RNAout试剂盒提取广西巴马小型猪和长白猪的四肢骨生长板软骨组织总RNA,检测其浓度及纯度合格后用于cDNA合成。cDNA合成步骤:7.00 μL RNA,1.00 μL gRNA Eraser,2.00 μL Buffer,42 ℃反应2 min;然后依次加入1.00 μL反转录酶RT Primer Mix、4.00 μL 5×Buffer、2.00 μL抑制剂、4.00 μL dNTP、1.00 μL随机引物及4.00 μL RNase-free Water;37 ℃ 35 min,85 ℃ 5 s。合成的cDNA置于-40 ℃冰箱保存备用。
1. 4 PCR扩增及测序分析
以广西巴马小型猪和长白猪的生长板软骨组织cDNA为模板,分别扩增BMP2和FGFR3基因的CDS序列。PCR反应体系50.00 μL:Taq DNA聚合酶(5 U/μL)0.25 μL,2×GC Buffer I(Mg+)25.00 μL,dNTPs(10 mmol/L)1.00 μL,ddH2O 19.75 μL,上、下游引物各1.00 μL,cDNA模板(500 ng/μL)2.00 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,63 ℃ 30 s,72 ℃ 60 s,进行35个循环;72 ℃延伸5 min,4 ℃保存。PCR扩增产物采用1.5%琼脂糖凝胶电泳进行检测。将回收纯化的目的片段TA克隆至pMD18-T载体上,连接体系:Solution I 4.00 μL,pMD18-T载体1.00 μL,目的片段5.00 μL,16 ℃恒温箱过夜;然后转化DH5α感受态细胞,并接种于LA培养基上(含氨苄青霉素)37 ℃培养12~16 h。挑取单克隆接种至含氨苄青霉素的LB液体培养基中,继续培养2~4 h;挑取阳性菌落进行扩大培养,经菌液PCR验证后,将阳性菌落送至生工生物工程(上海)股份有限公司测序。
1. 5 BMP2和FGFR3基因CDS序列比对分析
测序获得的广西巴马小型猪与长白猪的BMP2和FGFR3基因CDS序列采用DNAStar中的MegAlign进行比对分析,并以SeqMan对测序峰图进行分析。
1. 6 FGFR3基因PCR扩增及测序分析
对广西巴马小型猪和长白猪的FGFR3基因进行PCR扩增,反应体系50.00 μL:cDNA模板(500 ng/μL)2.00 μL,Taq DNA聚合酶(5 U/μL)0.25 μL,2×GC Buffer I(Mg+)25.00 μL,dNTPs(10 mmol/L)1.00 μL,上、下游引物各1.00 μL,ddH2O 19.75 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,63 ℃ 30 s,72 ℃ 60 s,进行35个循环;72 ℃延伸5 min,4 ℃保存。采用1.5%琼脂糖凝胶电泳检测PCR扩增产物,并送至深圳华大基因股份有限公司测序,测序结果使用DNAStar中的MegAlign进行比对分析,并以SeqMan对测序峰图进行分析。
1. 7 FGFR3基因SNP位点多态性分析
随机选取广西巴马小型猪和长白猪各30头,采用PCR-RFLP检测FGFR3基因C2620T和C2374G位点多态性。Taq I酶切产物以2.5%琼脂糖凝胶电泳进行检测,记录SNP分型;然后统计2个品种猪的基因型及基因频率,经χ2独立性检验和Hardy-Weinberg平衡χ2适合性检验后,利用Haploview进行连锁不平衡分析。
1. 8 生长板软骨组织中BMP2和FGFR3基因表达水平测定
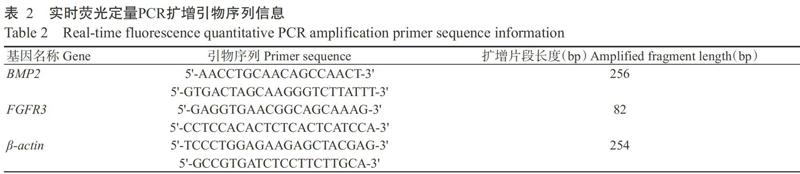
根据NCBI已公布的BMP2和FGFR3基因序列设计实时荧光定量PCR扩增引物(表2),采用SYBR Green I法对2个品种猪四肢骨生长板软骨组织中的基因表达水平进行检测。实时荧光定量PCR反应体系20.00 μL:2×SYBR? Premix Ex Taq 10.00 μL,上、下游引物各0.50 μL,cDNA模板5.00 μL,ddH2O 4.00 μL。擴增程序:95 ℃预变性3 min;95 ℃ 10 s,60 ℃ 30 s,进行39个循环;65 ℃ 5 s,95 ℃ 50 s。每个组织样品设6次生物学重复,采用2?ΔΔCt法换算目的基因相对表达量,并以运用SPSS 18.0进行单因素方差分析(One-way ANOVA)和Duncans多重比较。
2 结果与分析
2. 1 广西巴马小型猪与长白猪体重及体尺性状的比较
1日龄广西巴马小型猪与1日龄长白猪的体型差异明显,如表3和图1所示。其中,体重、体长和体高的差异均达极显著水平(P<0.01,下同),股骨长的差异达显著水平(P<0.05,下同)。
2. 2 BMP2和FGFR3基因CDS序列扩增结果
以广西巴马小型猪和长白猪四肢骨生长板软骨组织总RNA反转录合成的cDNA为模板,PCR扩增2个品种猪的BMP2和FGFR3基因CDS序列,PCR扩增产物经1.5%琼脂糖凝胶电泳检测,约在1200和800 bp处获得2条单一、清晰的目的条带,与预期结果相符。广西巴马小型猪BMP2和FGFR3基因CDS序列的PCR扩增电泳结果如图2所示。
2. 3 BMP2和FGFR3基因CDS序列的测序分析结果
广西巴马小型猪和长白猪的BMP2基因CDS序列全长1188 bp,且2个品种的CDS序列(图3)完全一致。与NCBI已公布的BMP2基因序列比对,发现存在2个错义突变位点:A298G(Arg→Gly)和T1007C(Leu→Pro)。广西巴马小型猪和长白猪的FGFR3基因CDS序列全长808 bp,与NCBI已公布的FGFR3基因序列比对,发现存在8个碱基突变位点及1个碱基缺失位点(图4),其中5个错义突变位点是广西巴马小型猪和长白猪共同所有,分别为:A124G(Asn→Asp)、C190G(Pro→Ala)、A204C(Glu→Asp)、C205A(Pro→Thr)和C245T(Ala→Vla);另外3个突变位点是广西巴马小型猪A438G和C549T的同义突变及长白猪A752C(Lys→Thr)的错义突变;碱基缺失位点为长白猪第328~330个碱基(GCA)缺失。
2. 4 广西巴马小型猪和长白猪FGFR3基因全序列扩增结果
根据NCBI已公布的FGFR3基因全序列设计引物FGFR3-SNP-Finder1和FGFR3-SNP-Finder2,以猪基因组DNA为模板进行PCR扩增。2对引物均设在FGFR3基因内含子区内,扩增范围还包含5个外显子区,覆盖FGFR3基因序列的73.5%,包含广西巴马小型猪和长白猪FGFR3基因CDS序列的4个差异位点(3个SNP位点和1个碱基缺失位点)。其中,引物FGFR3-SNP-Finder1的预期扩增片段长度为1470 bp,引物FGFR3-SNP-Finder2是预期扩增片段长度为674 bp。广西巴马小型猪的PCR扩增电泳结果(图5)显示,获得的目的条带与预期结果相符。
2. 5 FGFR3基因SNP位点筛选结果
采用MegAlign和SeqMan比对分析长白猪和广西巴马小型猪的FGFR3基因全序列,结果发现存在2个SNP位点(A2374G和C2620T)。其中,A2374G位点位于FGFR3基因第4外显子110 bp处(图6-A),C2620T位点位于FGFR3基因第5外显子48 bp处(图6-B)。此外,在2个品种猪中均存在A752C错义突变位点和第328~330个碱基(GCA)缺失现象。后续选择A2374G和C2620T位点进行分析,以推测其与猪骨骼发育的相关性。
2. 6 FGFR3基因A2374G和C2620T位点的多态性分析结果
A2374G和C2620T位点的PCR-RFLP检测电泳结果显示,A2374C位点产生3种基因型(图7-A),分别命名为AA(261 bp)、AB(261 bp+244 bp+17 bp)和BB(244 bp+17 bp);C2620T位点也产生3种基因型(图7-B),分别命名为MM(103 bp)、MN(103 bp+83 bp+20 bp)和NN(83 bp+20 bp)。由于17 bp和20 bp的片段太小,未能在2.5%琼脂糖凝胶上显示出来。
2. 7 FGFR3基因A2374G和C2620T位点在2个品种猪中的基因型及基因频率
采用PCR-RFLP检测A2374G和C2620T位点在广西巴马小型猪和长白猪中的基因型及基因频率,结果如表4和表5所示。A2374G位点在长白猪中仅存在2种纯合基因型(AA和BB),无杂合基因型(AB),优势等位基因A频率为0.633;A2374G位点在广西巴马小型猪中存在3种基因型(AA、AB和BB),以BB基因型个体较多,优势等位基因B频率为0.766。χ2适合性检验结果显示,长白猪A2374G位点等位基因A/B分布不符合Hardy-Weinberg平衡(χ2=29.98>χ20.005(2),P<0.01),广西巴马小型猪A2374G位点等位基因A/B分布也不符合Hardy-Weinberg平衡(χ2=11.76>χ20.005(2),P<0.01)。χ2独立性检验结果显示,2个品种猪的A2374G位点基因频率差异极显著(χ2=19.55>χ20.005(1),P<0.01),基因型分布差異极显著(χ2=15.258>χ20.005(2),P<0.01)。
C2620T位点在长白猪和广西巴马小型猪中均存在3种基因型(MM、MN和NN)。长白猪中NN型个体较多(频率达0.833),优势等位基因N频率为0.850;广西巴马小型猪中MN型个体较多(频率达0.833),优势等位基因M频率为0.516。χ2适合性检验结果显示,长白猪C2620T位点等位基因M/N分布不符合Hardy-Weinberg平衡(χ2=22.67>χ20.005(2),P<0.01),广西巴马小型猪C2620T位点等位基因M/N分布也不符合Hardy-Weinberg平衡(χ2=13.42>χ20.005(2), P<0.01)。χ2独立性检验结果显示,2个品种猪的C2620T位点基因频率差异极显著(χ2=18.15>χ20.005(1),P<0.01),基因型分布差异极显著(χ2=43.17>χ20.005(2),P<0.01)。通过Haploview对猪FGFR3基因A2374G和C2620T位点进行连锁不平衡分析,结果显示,连锁不平衡系数(D)=0.044,r2=0.001<0.330,即2个基因座均处于连锁平衡状态。
2. 8 BMP2和FGFR3基因在2个品种猪中的表达差异
采用实时荧光定量PCR检测BMP2和FGFR3基因在1日龄广西巴马小型猪和1日龄长白猪生长板软骨组织中的表达差异,结果(表6)发现,广西巴马小型猪生长板软骨组织中的BMP2基因相对表达量显著低于长白猪(P<0.05),而FGFR3基因相对表达量极显著高于长白猪(P<0.01)。
3 讨论
BMPs在生物医学再生疗法和组织工程中具有潜在的治疗用途(刘俊银等,2019)。BMPs是从脊椎动物和无脊椎动物中鉴定获得的多功能细胞因子,具有诱导骨骼和软骨形成的能力(Xiao et al.,2007)。BMPs还是生长和分化因子,可为骨骼发育提供发生信号,并通过与胚胎骨形成相关的一系列信号,而促进骨折愈合。其中,BMP2基因能诱导和增强骨生长与形成,还会促进细胞趋化性、增殖及向成骨途径分化(Bodern,2005;Ribeiro et al.,2015)。刘亮和王东(2007)研究发现,BMP2基因可成功用于治疗软骨和骨缺损。Karyagina等(2017)、Ma等(2019)研究表明,BMP2基因在骨损伤时可与骨膜、血管组织及周围肌肉组织共同促进骨骼愈合。FGFR是一类跨膜酪氨酸激酶受体,主要有4个家族成员(FGFR1~ FGFR4)(Ren et al.,2010)。Ornitz和Marie(2015)研究发现,FGFR3基因通过负反馈控制软骨细胞向骨细胞分化,但FGFR3基因突变会导致其功能变强,进而抑制软骨细胞分化(Tuzon et al.,2019)。Sargar等(2017)研究发现FGF/FGFR信号是调节脊椎动物骨骼发育的重要信号通路。FGF/MAPK通路和BMP信号相互拮抗(Yoon et al.,2006)。Minina等(2002)研究发现,BMPs处理可缓解软骨发育不全小鼠模型的骨骼发育不良症状,而FGFR处理可中和BMPs的作用。至今,有关BMP2和FGFR3基因与猪骨发育的研究较少,与动物体型的关联研究则更少。本研究通过克隆广西巴马小型猪和长白猪的BMP2和FGFR3基因CDS序列,利用PCR-RFLP检测FGFR3基因SNP位点(A2374G和C2620T)在广西巴马小型猪和长白猪间的分布情况,并比较2个品种猪1日龄的体型,结果发现BMP2和FGFR3基因在软骨和骨骼的形成方面具有重要意义。
本研究通过PCR-RFLP检测A2374G和C2620T位点在广西巴马小型猪和长白猪中的基因型及基因频率,结果表明,A2374G位点在长白猪中仅存在2种纯合基因型(AA和BB),无杂合基因型(AB),优势等位基因A频率为0.633;A2374G位点在广西巴马小型猪中存在3种基因型(AA、AB和BB),优势等位基因B频率为0.766;C2620T位点在2个品种猪中均存在3种基因型(MM、MN和NN),长白猪的优势等位基因N频率为0.850,广西巴马小型猪的优势等位基因M频率为0.516。A2374G和C2620T位点在2个品种猪间的分布差异均极显著,其对应的等位基因分布均不符合Hardy-Weinberg平衡,且2个位点基因座均处于连锁平衡状态,推测广西巴马小型猪的矮小性状与FGFR3基因碱基突变存在一定关联。BMP2基因和FGFR3基因在猪软骨和骨骼的形成方面具有重要意义,但其作用机制尚未明确。本研究发现,广西巴马小型猪和长白猪在1日龄时的体重、体长、体高和股骨长存在显著或极显著差异,说明以这2个品种猪为研究对象比对分析动物矮小性状的作用机制具有合理性。1日龄广西巴马小型猪生长板软骨组织中的BMP2基因相对表达量显著低于1日龄长白猪,而FGFR3基因相对表达量极显著高于1日龄长白猪,提示BMP2基因对猪骨发育起促进作用,而FGFR3基因对猪骨发育起抑制作用。即广西巴马小型猪体型矮小与FGFR3基因高表达及BMP2基因低表达有直接联系,但其作用机制有待进一步探究。
4 结论
BMP2和FGFR3基因在猪的软骨和骨骼形成方面具有重要意义,其中,BMP2基因对猪骨发育起促进作用,而FGFR3基因对猪骨发育起抑制作用。广西巴马小型猪体型矮小与FGFR3基因高表达及BMP2基因低表达存在直接关联。
参考文献:
何道领. 2016. 国外引进猪种介绍[J]. 植物医生,29(6):38-39. doi:10.13718/j.cnki.zwys.2016.06.021. [He D L. 2016. Introduction of imported pig breeds from abroad[J]. Plant Doctor,29(6):38-39.]
侯建君,施正香,李保明. 2006. 不同生长阶段长白猪体型特征的主成分分析[J]. 中国农业大学学报,11(3):56-60. doi:10.3321/j.issn:1007-4333.2006.03.010. [Hou J J,Shi Z X,Li B M. 2006. Principal component analysis of Landraces physical characteristics[J]. Journal of China Agricultural University,11(3):56-60.]
江雨航,申玉建,張其伟,高小童,张琼文,崔悦悦,夏琴,兰干球,郭亚芬,蒋钦杨. 2020. 广西巴马小型猪全身CT影像学观察[J]. 南方农业学报,51(3):677-685. doi:10.3969/j.issn.2095-1191.2020.03.026. [Jiang Y H,Shen Y J,Zhang Q W,Gao X T,Zhang Q W,Cui Y Y,Xia Q,Lan G Q,Guo Y F,Jiang Q Y. 2020. Observation of whole body CT tomography of Guangxi Bama mini-pigs[J]. Journal of Southern Agriculture,51(3):677-685.]
姜煜,郭东炜,郭奕斌. 2017. 致死性侏儒症Ⅰ型高发突变发生机制浅析[J]. 分子诊断与治疗杂志,9(4):278-283. [Jiang Y,Guo D W,Guo Y B. 2017. Analysis of the mechanism of high incidence of thanatophoric dysplasia type I[J]. Journal of Molecular Diagnostics and Therapy,9(4):278-283.]
李完波,朱亚玲,艾华水,郭添福. 2016. 猪小体型相关受选择基因位点的研究[J]. 畜牧兽医学报,47(10):1977-1985. doi:10.11843/j.issn.0366-6964.2016.10.005. [Li W B,Zhu Y L,Ai H S,Guo T F. 2016. Identifying signatures of seletion related to small body size in pigs[J]. Acta Veterinaria et Zootechnica Sinica,47(10):1977-1985.]
李潇,王昀,陈韬亮,陈建生,黄敏,池雅杰,杨远韬,柯以铨. 2017. 成纤维细胞生长因子受体抑制剂BGJ398对胶质瘤生物学特性的影响[J]. 中华神经医学杂志,16(6):541-546. doi:10.3760/cma.j.issn.1671-8925.2017.06.001. [Li X,Wang Y,Chen T L,Chen J S,Huang M,Chi Y J,Yang Y T,Ke Y Q. 2017. Influence of fibroblast growth factor receptor antagonist BGJ398 in biological characte-ristics of gliomas[J]. Chinese Journal of Neuromedicine,16(6):541-546.]
刘俊银,冯玮,谢映春,李豫皖,曾继涛,刘子铭,涂小林. 2019. 骨再生修复中的骨形态发生蛋白信号通路:精准调节与治疗靶点[J]. 中国组织工程研究,23(4):606-612. doi:10.3969/j.issn.2095-4344.1043. [Liu J Y,Feng W,Xie Y C,Li Y W,Zeng J T,Liu Z M,Tu X L. 2019. Bone morphologic protein signaling pathway in bone regeneration and repair:Accurate regulation and treatment targets[J]. Chinese Journal of Tissue Engineering Resear-ch,23(4):606-612.]
刘亮,王东. 2007. 大段同种异体骨移植复合BMP2和TGF-β2对兔桡骨中段骨缺损愈合的影响[J]. 中国矫形外科杂志,15(9):702-705. doi:10.3969/j.issn.1005-8478.2007. 09.019. [Liu L,Wang D. 2007. Effects exgenous transforming growth factor-bata 2(TGF-β2) and bone morphogenetic protein 2(BMP2) and allografts bone on radius defects healing of experimental rabbits[J]. Orthopedic Journal of China,15(9):702-705.]
刘楠. 2012. 小鼠体型控制相关miR-200s的功能研究[D]. 北京:中国农业科学院. [Liu N. 2012. Functional study of mouse miR-200s which related to body size control[D]. Beijing:Chinese Academy of Agricultural Sciences.]
刘艳,尹若峰,侯睿智. 2016. BMP-2诱导软骨细胞凋亡及增殖的研究[J]. 中华骨与关节外科杂志,9(3):251-254. doi:10.3969/j.issn.2095-9958.2016.03-17. [Liu Y,Yin R F,Hou R Z. 2016. Bone morpnogenetic protein 2 induced proliferation and apoptosis of chondrocytes[J]. Chinese Journal Bone and Joint Surgery,9(3):251-254.]
莫奇非,杨鹏,苏楠,陈林. 2019. 成纤维细胞生长因子受体在成骨细胞中的表达及作用研究[J]. 第三军医大学学报,41(24):2386-2392. doi:10.16016/j.1000-5404.201907 008. [Mo Q F,Yang P,Su N,Chen L. 2019. Expression of fibroblast growth factor receptor and its role in regula-ting osteoblasts differentiation[J]. Journal of Third Military Medical University,41(24):2386-2392.]
任红艳. 2014. 动物体型大小调控分子机制研究进展[J]. 湖北农业科学,53(20):4783-4787. doi:10.14088/j.cnki.issn0439-8114. 2014.20.003. [Ren H Y. 2014. Advances in regulation mechanisms of animal body size[J]. Hubei Agricultural Sciences,53(20):4783-4787.]
宋志芳,邢荷岩,于国升,卢春莲,曹洪战. 2017. 猪体型性状的研究进展及其重要性[J]. 猪业科学,34(7):120-122. [Song Z F,Xing H Y,Yu G S,Lu C L,Cao H Z. 2017. Research progress and importance of pig body shape traits[J]. Swine Industry Science,34(7):120-122.]
田永章,尹纪业,张天睿. 2019. 小型猪动物模型在呼吸毒理学研究中进展[C]//中国毒理学会. 2019全国呼吸毒理与卫生毒理學术研讨会. [Tian Y Z,Yin J Y,Zhang T R. 2019. Progress of miniature pig animal models in respiratory toxicology research[C]//Chinese Society of Toxico-logy. 2019 National Symposium on Respiratory Toxicology and Hygienic Toxicology.]
王爱德,兰干球,郭亚芬. 2010. 广西巴马小型猪的培育[J]. 实验动物科学,27(1):60-63. doi:10.3969/j.issn.1006-6179.2010.01.016. [Wang A D,Lan G Q,Guo Y F. 2010. Genetic breeding of Guangxi Bama mini-pig[J]. Laboratory Animal Science,27(1):60-63.]
溫轩. 2013. 软骨内FGFR3功能缺失在小鼠骨形成及骨折愈合过程中的影响及作用机制研究[D]. 重庆:第三军医大学. [Wen X. 2013. Loss function of FGFR3 in chondrocyte affect bone formation and fracture healing in mouse[D]. Chongqing:Army Medical University.]
邹迪莎,于健. 2017. 巴马小型猪动物模型在医学领域的研究进展[J]. 中国畜牧兽医,44(4):1128-1134. doi:10.16431/ j.cnki.1671-7236.2017.04.027. [Zou D S,Yu J. 2017. Research progress on animal models of Bama miniature pigs in the field of medicine[J]. China Animal Husban-dry & Veterinary Medicine,44(4):1128-1134.]
Boden S D. 2005. The ABCs of BMPs[J]. Orthopedic Nursing,24(1):49-52. doi:10.1097/00006416-200501000-00014.
Karyagina A S,Boksha I S,Grunina T M,Demidenko A V,Poponova M S,Sergienko O V,Lyashchuk A M,Galushkina Z M,Soboleva L A,Osidak E O,Bartov M S,Gromov A V,Lunin V G. 2017. Two variants of recombinant human bone morphogenetic protein-2(rhBMP-2) with additional protein domains:Synthesis in an Escherichia coli heterologous expression system[J]. Biochemistry(Moscow),82(5):613-624. doi:10.1134/S0006297917050091.
Lin S X,Soboda K K H,Feng J Q,Jiang X Q. 2016. The biological function of type I receptors of bone morphogenetic protein in bone[J]. Bone Research,4:16005. doi:10.1038/ boneres.2016.5.
Ma J Y,You D,Li W Y,Lu X L,Sun S,Li H W. 2019. Bone morphogenetic proteins and inner ear development[J]. Journal of Zhejiang University(Science B),20(2):131-145. doi:10.1631/jzus.B1800084.
Mina M,Wang Y H,Ivanisevic A M,Upholt W B,Rodgers B. 2002. Region- and stage-specific effects of FGFs and BMPs in chick mandibular morphogenesis[J]. Developmental Dynamics,223(3):333-352. doi:10.1002/dvdy.10056.
Minina E,Kreschel C,Naski M C,Ornitz D M,Vortkamp A. 2002. Interaction of FGF,Ihh/Pthlh,and BMP signaling integrates chondrocyte proliferation and hypertrophic differentiation[J]. Devlopmental Cell,3(3):439-449. doi:10.1016/s1534-5807(02)00261-7.
Ornitz D M,Marie P J. 2015. Fibroblast growth factor signa-ling in skeletal development and disease[J]. Genes & Development,29(14):1463-1486. doi:10.1101/gad.266551. 115.
Ren G P,Yin J C,Wang W F,Li L,Li D S. 2010. Fibroblast growth factor(FGF)-21 signals through both FGF receptor-1 and 2[J]. Science China. Life Sciences,53(8):1000-1008. doi:10.1007/s11427-010-4035-z.
Ribeiro F O,Gómez-Benito M J,Folgado J,Fernandes P R,García-Aznar J M. 2015. In silico mechano-chemical model of bone healing for the regeneration of critical defects:The effect of BMP-2[J]. PLoS One,10(6):e127722. doi:10.1371/journal.pone. 0127722.
Sargar K M,Singh A K,Kao S C. 2017. Imaging of skeletal disorders caused by fibroblast growth factor receptor gene mutations[J]. Radiographics,37(6):1813-1830. doi:10.1148/rg.2017170017.
Servetto A,Formisano L,Arteaga C L. 2021. FGFR signaling and endocrine resistance in breast cancer:Challenges for the clinical development of FGFR inhibitors[J]. Biochi-mica et Biophysica Acta,22:188595. doi:10.1016/j.bbcan. 2021.188595.
Sonia S. 2016. Use of bone morphogenetic proteins in mesenchymal stem cell stimulation of cartilage and bone repair[J]. World Journal of Stem Cells,8(1):1-12. doi:10.4252/ wjsc.v8.i1.1.
Sundaresan L,Kumar P,Manivannan J,Balaguru U M,Kasiviswanathan D,Veeriah V,Anishetty S,Chatterjee S. 2019. Thalidomide and its analogs differentially target fibroblast growth factor receptors:Thalidomide suppresses FGFR gene expression while pomalidomide dampens FGFR2 activity[J]. Chemical Research in Toxicology,32(4):589-602. doi:10.1021/acs.chemrestox.8b00286.
Tuzon C T,Rigueur D,Merrill A E. 2019. Nuclear fibroblast growth factor receptor signaling in skeletal development and disease[J]. Current Osteoporosis Reports,17(3):138-146. doi:10.1007/s11914-019-00512-2.
Wang M Q,Li H J,Yang Y Q,Yuan K,Zhou F,Liu H B,Zhou Q H,Yang S B,Tang T T. 2021. A3D-bioprinted scaffold with doxycycline-controlled BMP2-expressing cells for inducing bone regeneration and inhibiting bacterial infection[J]. Bioactive Materials,6(5):1318-1329. doi:10.1016/j.bioactmat.2020.10.022.
Wang Y W,Quan S J,Ma H,Liu D H,Xie F H,Chen G C,Wang B T,An M L,Ding F. 2019. A review on the protection mechanism of trehalose on plant tissues and animal cells[J]. Agricultural Biotechnology,8(4):29-34. doi:10.19759/j.cnki.2164-4993. 2019.04.006.
Xiao C C,Shim J,Klüppel M,Zhang S S M,Dong C,Flavell R A,Fu X Y,Wrana J L,Hogan B L M,Ghosh S. 2007. Ecsit is required for BMP signaling and mesoderm formation during mouse embryogenesis[J]. Genes & Development,17(23):2933-2949. doi:10.1101/gad.1145603.
Yoon B S,Pogue R,Ovchinnikov D A,Yoshii I,Mishina Y,Behringer R R,Lyons K M. 2006. BMPs regulate multiple aspects of growth-plate chondrogenesis through opposing actions on FGF pathways[J]. Development,133(23):4667-4678. doi:10.1242/dev.02680.
Zhang W,Kroscher K A,Murray R L,Gagliardi R,Guiltinan C,Rhoads R P,Stahl C H. 2020. Dietary calcium and phosphorus amounts affect development and tissue-speci-fic stem cell characteristics in neonatal pigs[J]. The Journal of Nutrition,150(5):1086-1092. doi:10.1093/jn/nxaa011.
(責任编辑 兰宗宝)

