某院PD-1免疫检查点抑制剂致不良反应的发生情况及分析
李哲,孙一琦,何超然,李新刚(首都医科大学附属北京友谊医院西药剂科,北京 100050)
免疫治疗是当前肿瘤治疗领域中最具前景的研究方向之一,研究表明,当肿瘤细胞表面过表达的程序性细胞死亡配体-1(PD-L1)与主要表达于活化T 细胞的程序性细胞死亡受体-1(PD-1)结合后,T 细胞受体信号传导通路失活,导致T 细胞的增殖和活化受抑制,从而使肿瘤细胞逃避机体正常的免疫监视[1-2]。而近年来陆续上市的PD-1 免疫检查点抑制剂可以阻断PD-1 与PD-L1结合,增强免疫应答。该类药品在多种肿瘤中疗效显著,客观缓解率通常在10%~40%[3]。但是,随着PD-1 免疫检查点抑制剂的广泛应用,临床发现这种治疗方法可能会导致诸多不良反应的发生,对患者的生活质量产生较大负面影响,从而中断肿瘤治疗[4]。虽然PD-1 免疫检查点抑制剂总不良反应发生率较高,但严重不良反应发生率约为10%~13%,低于传统化疗的35%~54%[5-6],故部分患者会选择在不良反应缓解的情况下再次接受PD-1 免疫检查点抑制剂治疗。本文就PD-1 免疫检查点抑制剂治疗恶性肿瘤期间出现的不良反应,以及不良反应缓解后的再应用情况进行分析。
1 研究对象
共收集到2015年1月1日至2021年3月31日在本院接受PD-1 免疫检查点抑制剂治疗各类恶性肿瘤的患者212 例,共接受574 次治疗。本研究涉及患者的基本信息和医疗信息,已通过医院伦理委员会审批同意,批件号:2021-P2-162-01。
2 方法
2.1 主要治疗药物及用法用量
信迪利单抗注射液(200 mg,q3w)、纳武利尤单抗注射液(3 mg·kg-1或240 mg,q2w)、帕博利珠单抗注射液(2 mg·kg-1,q3w)、注射用卡瑞利珠单抗(3 mg·kg-1或200 mg,q3w;200 mg,q2w)、特瑞普利单抗注射液(3 mg·kg-1,q2w)、替雷利珠单抗注射液(200 mg q3w),部分18 周岁以下患者酌情减少剂量。
2.2 研究方法
通过回顾性查阅患者病历记录、体温单、实验室检查结果以及影像学检查结果等,记录患者接受PD-1 免疫检查点抑制剂治疗期间发生的所有不良反应信息,以不良事件评价标准(CTCAE)5.0 版为依据进行评价,包括不良反应的类别和分级,并根据用药与不良反应/事件的出现有无合理的时间关系;反应是否符合该药已知的不良反应类型;停药或减量后,反应是否消失或减轻;再次使用可疑药品是否再次出现同样的反应/事件;反应/事件是否可用合并用药的作用、患者病情的进展、其他治疗的影响来解释五条标准进行相关性评价。评价结果分为肯定、很可能、可能、可能无关,其中可能无关以上等级的不良反应判定为有关。
2.3 分析方法
应用统计软件SPSS 22.0 对相关数据进行统计分析,计数信息的比较采用卡方检验,以P<0.05 为差异有统计学意义。
3 结果
3.1 一般资料
212 例患者共接受574 次治疗。其中男性136人(64.2%),女性76 人(35.8%),年龄范围在4~81 岁,其他详见表1。
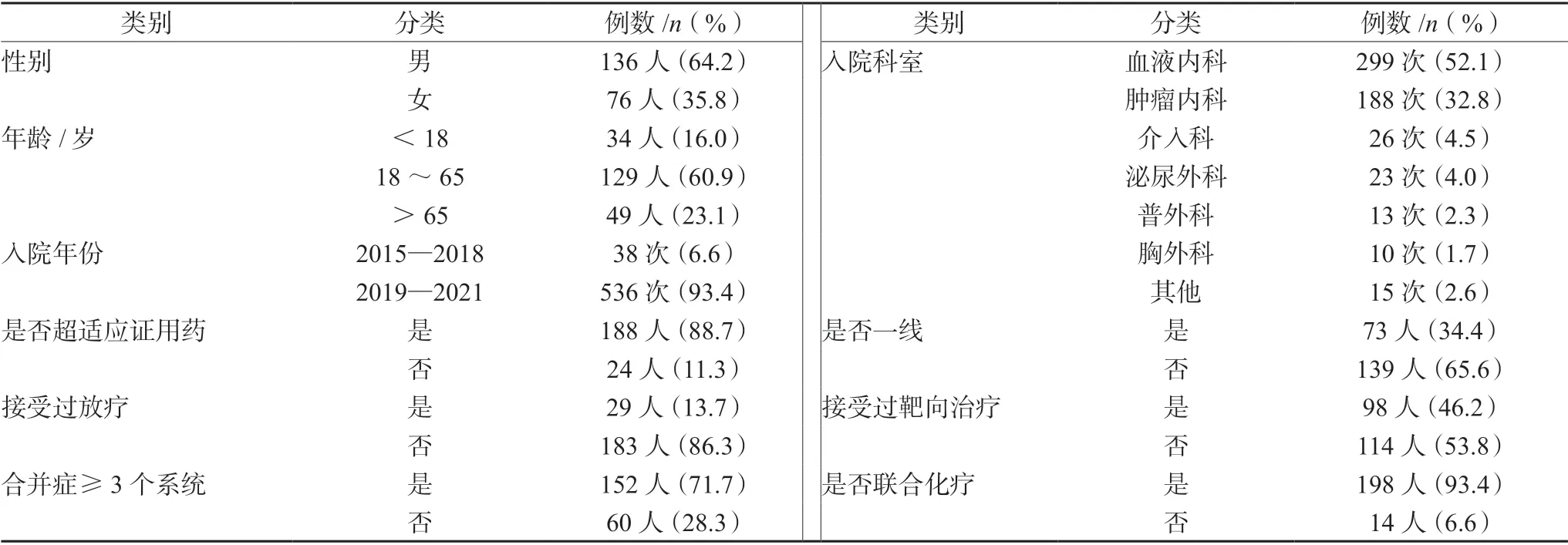
表1 212 例患者一般情况Tab 1 General conditions of 212 patients
3.2 不良反应
3.2.1 不良反应数据 212 例患者中,99 例发生不同程度的不良反应,其中35 例患者发生一种不良反应,37 例患者发生两种不良反应,24 例患者发生三种不良反应,3 例患者发生四种不良反应,最终共记录193 次不良反应,平均1.95 次/例,不良反应发生例数、严重程度分级及相关性评价见表2。
本研究共涉及6 种已上市的PD-1 免疫检查点抑制剂,使用分布及各自不良反应发生例数见表3。
3.2.2 不良反应分析 采用卡方检验,对患者的性别、年龄、是否是一线使用、是否联合其他抗肿瘤药物进行不良反应发生率的分析,结果见表4。
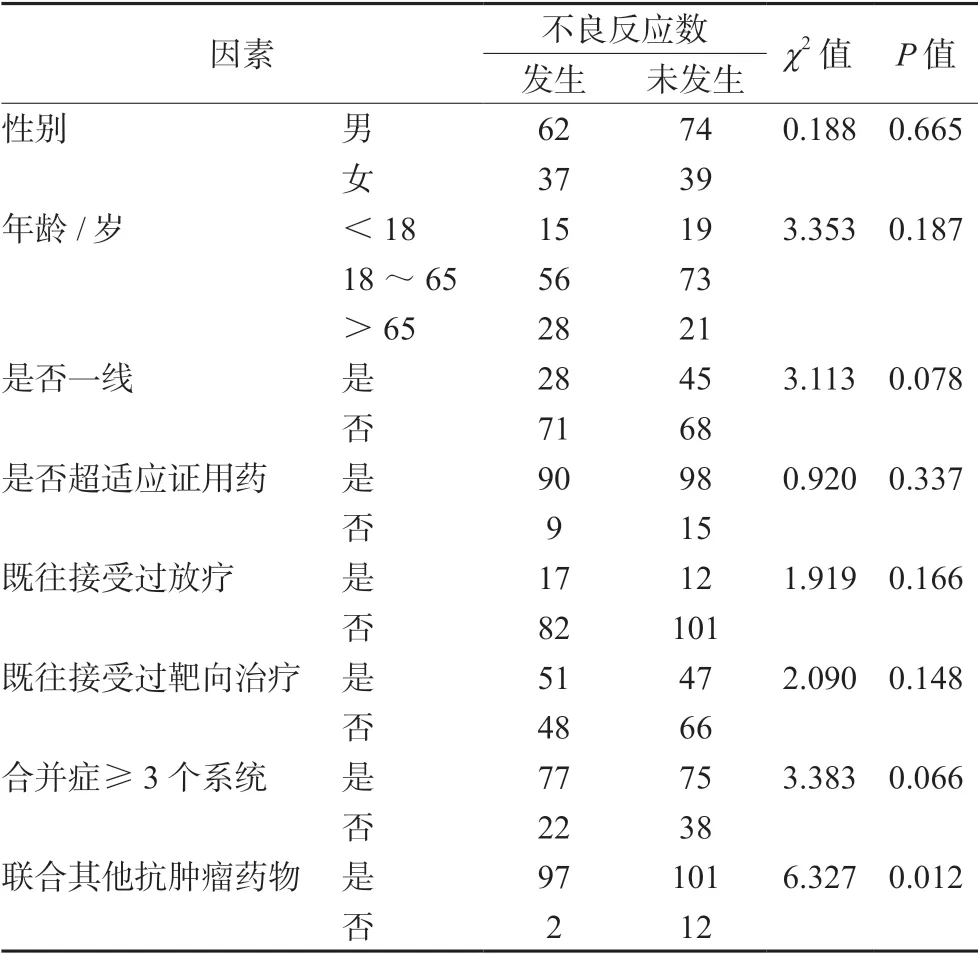
表4 不同因素对不良反应率的影响Tab 4 Influence of different factors on the adverse reaction rate
3.2.3 不良反应再激发 99 例发生不良反应的患者中,有72 例在不良反应缓解或不影响后续治疗的情况下(33 例痊愈、24 例好转、15 例未好转),再次接受PD-1 免疫检查点抑制剂治疗,这些患者中,有15 例出现了新的不良反应,而有23 例再次出现了与先前相同的不良反应,再次出现的不良反应详情见表5。

表5 不良反应再激发情况Tab 5 Re-stimulation of adverse reactions
4 讨论
PD-1 免疫检查点抑制剂治疗恶性肿瘤在诸多临床试验中已经被证实为一类安全、有效、广谱的治疗方法[3],但最早上市的纳武利尤单抗也是在2014年才在美国用于黑色素瘤,虽然近些年新药和相关研究不断,但仍是一类应用时间较短的治疗药物,且存在超说明书用药的情况,所以需要对其进行安全性的用药监护。
在本研究中,较为常见的不良反应有发热(11.3%)、白细胞降低(10.4%)、全身乏力(7.5%)、转氨酶升高(6.6%)、血小板降低(6.6%)、肺炎(6.6%)、恶心(6.6%)、皮疹(6.1%)、腹泻(6.1%)、食欲减退(4.7%)、咳嗽(4.2%)等。该不良反应数据与使用率最高的信迪利单抗注射液说明书中不良反应谱较为相似,信迪利单抗注射液发生率≥10%的不良反应包括发热、贫血、天门冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高、乏力、白细胞计数降低。其中,除贫血在本研究中的发生率较低(1.9%)外,其他常见不良反应在本研究的发生率均较高,但总体发生率与说明书相比较低,分析原因可能是回顾性研究与Ⅱ期、Ⅲ期临床试验的方法差异所致,临床试验对受试者的用药安全性更加重视,记录也更为详实。与国外有关PD-1 免疫检查点抑制剂的临床试验相比,本研究中不良反应种类也较为相似,但个别不良反应的发生率有较大不同。如Weber 等[7-13]针对纳武利尤单抗的研究显示发生率最高的不良反应为疲乏,发生率在14%~24.8%。本研究全身乏力不良反应的发生率仅为7.5%,可能的原因一方面是上述国外研究大多是前瞻性研究,对不良反应的观察更为敏锐;另一方面是国内医师和患者普遍对乏力的重视程度不足,导致记录和报告数较低,如周静文等[14]报道中,PD-1 免疫检查点抑制剂引起疲乏的不良反应发生率也仅为8.8%,与本文相似。但其不良反应发热和白细胞降低的发生率与本文相比较低,原因可能是本文纳入的病例多为血液内科患者(52.1%),而血液内科患者粒细胞缺乏伴发热的发生率较高,该现象也同样出现在其他研究中,如针对霍奇金淋巴瘤的研究中,PD-1 免疫检查点抑制剂引起发热的不良反应分别为14%和24.3%[15-16]。本研究共涉及6 种已上市的PD-1 免疫检查点抑制剂,从表3可知,由于各PD-1 免疫检查点抑制剂的使用数量参差不齐,可及性差导致观察到的不良反应发生情况也有较大差异。

表3 PD-1 免疫检查点抑制剂使用分布及不良反应发生例数Tab 3 Distribution of PD-1 immune checkpoint inhibitors and number of adverse reactions
本研究共记录了193 次不良反应,按照CTCAE 5.0 的标准对其进行分类,其中141 次的严重程度为1~2 级,52 次的严重程度为3~5级,总体而言,多数不良反应程度较轻,且在停药或对症处理后很快得到缓解,这与国内外相关研究较为类似[7-16]。本研究对每一项不良反应进行相关性评价,相关性为肯定的共4 例,很可能的共24 例,可能的共94 例,可能无关的共71例。肯定和很可能与PD-1 相关的不良反应仅占14.5%,这与多数患者的疾病情况和合并用药有关,由表4可知,是否联用其他抗肿瘤药物对不良反应的发生率有显著性影响。而212 例患者中,有198 例(93.4%)接受了PD-1 联合其他抗肿瘤药物的治疗方法,所以许多不良反应与PD-1 免疫检查点抑制剂的相关性并不强,这也正是临床会在不良反应缓解或不影响治疗的前提下,再次使用PD-1 免疫检查点抑制剂的原因。
在再次使用PD-1 免疫检查点抑制剂治疗的患者中,共有23 例(31.9%)再次出现了与之前相同的不良反应,大多为发热这类发生率高且较易控制的不良反应。而其中4 例(2 例皮疹、1 例咳嗽、1 例发热)不良反应也因为此次再激发试验阳性而将相关性评价为肯定。此外,有15 例患者出现了新的不良反应,所以在72 例再次接受PD-1 免疫检查点抑制剂治疗的患者中,再次出现不良反应的发生率为52.8%,与总发生率46.7%(99/212)相似,未明显升高的不良反应发生率也是临床考虑再次采用PD-1 治疗的原因之一。
此外,本研究探讨了不同因素对不良反应发生率的影响,除“联合其他抗肿瘤药物”对不良反应发生率有显著性影响外,患者性别、年龄、是否一线使用、是否超适应证用药、既往是否接受过放疗、既往是否接受过靶向治疗、合并疾病是否≥3 个系统没有发现显著影响。但不能因此而放弃PD-1 免疫检查点抑制剂联合其他抗肿瘤药物的治疗方案,因为根据目前的相关研究,PD-1 免疫检查点抑制剂联合其他抗肿瘤药物,尤其是分子靶向药物,往往能够产生协同抗肿瘤作用,且在一定程度上可减少用药剂量,避免耐药的产生[17-19]。所以联合用药具有较大意义,但需要进行安全性监测。
目前许多研究考察PD-1 免疫检查点抑制剂引起的特殊炎症不良反应,即免疫相关不良反应(irAEs),主要影响皮肤、消化道、内分泌腺体、肝脏和肺等重要脏器[20-22],但有专家认为,经PD-1 免疫检查点抑制剂治疗后发生的不良反应均可视作为irAEs[23]。所以,本研究未针对irAEs,而是对发生的所有不良反应进行调查和分析,以提供全面且详实的临床数据。
5 小结
PD-1 免疫检查点抑制剂具有广而强的抗肿瘤活性,为许多晚期恶性肿瘤患者带来了新的希望,但在临床应用中,应该重视其引起的不良反应尤其是严重不良反应,临床医师以及药师在患者用药后进行积极的监测,对不良反应做到早发现、早对症,在使用前沿治疗手段提高有效性的同时,兼顾患者用药的安全性[24]。

