基于环磷酰胺致小鼠损伤保护作用研究正源方前处理工艺
程晓妮,倪健,潘亚磊*,唐志书*,周瑞,苏洁,张海潮,宋忠兴(.陕西中医药大学/陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西省创新药物研究中心,陕西 咸阳7083;.北京中医药大学中药学院,北京 0488)
正源方是由西洋参、当归、南沙参、仙鹤草等组成的临床经验方,由参脉散[1]和当归补血汤[2]两个经典方剂加减化裁而成,具有扶正解表、生血止血之功效,以汤剂在临床运用于治疗恶性肿瘤放化疗引起的气血亏虚证中具有良好疗效,可有效缓解患者放化疗引起的毛发脱落,皮肤红疹、斑疹、紫癜等不良反应,并且能有效改善血虚患者白细胞、血小板总数,从而改善机体状态[3]。本文研究采用环磷酰胺(CTX)所致小鼠损伤模型,通过观察正源方不同工艺对小鼠的一般状态、体质量变化、外周血常规、血清超氧化物歧化酶(SOD)、血清丙二醛(MDA)、小鼠脏器指数及肝脏和股骨切片的病理变化,评价正源方两种工艺获得的制剂前体药物对CTX 损伤小鼠的保护作用。
1 材料
1.1 实验动物
SPF 级昆明小鼠49 只,雄性,体质量(25±5)g [成都达硕实验动物有限公司,生产许可证号:SCXK(川)2020-030];动物颗粒饲料(成都达硕实验动物有限公司);动物饲养于陕西中医药大学陕西中药资源产业化省部共建协同创新中心SPF 级动物饲养室[SYXK(陕)2017-004]。
1.2 试药
正源方由西洋参、当归、南沙参、仙鹤草、重楼组成(以上饮片由西安盛兴中药饮片有限责任公司提供)。地榆升白片(成都地奥集团天府药业股份有限公司);环磷酰胺(Sigma 公司);SOD 试剂盒和MDA 试剂盒(南京建成生物科技有限公司)。
1.3 仪器
全自动血液细胞分析(深圳迈瑞生物医疗电子有限公司);电子分析天平(赛多利斯科学仪器有限公司);5910R 高速冷冻离心机(德国Eppendorf 公司);HH-S4A 水浴锅(北京科伟永兴仪器公司);TS100-F 倒置荧光显微镜(日本Olympus 公司)。
2 方法
2.1 正源方前处理工艺
2.1.1 工艺Ⅰ制法 称取西洋参250 g、仙鹤草250 g、当归80 g、南沙参125 g 和重楼100 g,共805 g,加 16 倍量的水煎煮 2 次,每次 2 h,过滤,合并滤液后浓缩至2 L,经喷雾干燥装置制成工艺Ⅰ粉末185 g,备用。经计算工艺Ⅰ所制备的粉末每g 含生药量为4.35 g。
2.1.2 工艺Ⅱ制法 取仙鹤草250 g 和当归80 g,共330 g,用 14 倍量的 50% 乙醇回流提取,提取3次,每次1 h,浓缩成450 mL 稠膏;药渣与南沙参125 g,用 16 倍量的水提取,提取2 次,每次2 h,浓缩成600 mL 稠膏;西洋参 250 g(超微粉碎 30 min)和重楼 100 g(超微粉碎 40 min)与上述稠膏混合,65℃ 烘干粉碎制成工艺Ⅱ粉末 455 g,备用。经计算工艺Ⅱ所制备的粉末每g 含生药量为1.77 g。
2.2 动物分组及造模
将所有小鼠按照体质量随机分为空白组,模型组,地榆升白片组,工艺Ⅰ组,工艺Ⅱ低剂量组、中剂量组和高剂量组,每组7 只小鼠。工艺Ⅰ组给药剂量计算方法:以正源处方成人每日临床常用剂量97 g,除以成人体质量60 kg,乘以小鼠和人换算系数9.1,再除以工艺Ⅰ制备粉末所含的生药量4.35,计算得工艺Ⅰ组给药剂量为3.38 g/(kg·d)。同法计算地榆升白片组给药剂量为0.18 g/(kg·d),工艺Ⅱ高、中、低剂量组给药剂量分别为8.30、4.15、2.08 g/(kg·d)。
小鼠每日灌胃所需药液现用现配,根据小鼠体质量,称量每组小鼠每日灌胃所需药物粉末,按照每10 g 小鼠灌胃体积0.1 mL,加入适量蒸馏水,超声制备成溶液或混悬均匀的溶液后灌胃。正常组和模型组灌胃给予蒸馏水,其余各组灌胃给予相应剂量药液,连续给药14 d。除空白组外,其余各组小鼠于第 4、5、6、7日连续4 d 腹腔注射CTX [0.07 g/(kg·d)]进行造模。14 d 后,腹腔注射水合氯醛麻醉处死小鼠,取材测定相应指标。
2.3 观测小鼠生存情况和体质量变化
每日观察小鼠的毛色、饮食及活动等状态,并于第 1、3、7、10、14日称量小鼠体质量,并作记录。
2.4 动物外周血常规测定
小鼠末次给药 2 h 后进行眼眶取血,使用全自动血液细胞分析仪测定外周血常规白细胞(WBC)、红细胞(RBC)以及血小板(PLT)水平。
2.5 检测 SOD 和 MDA 水平
采用试剂盒检测正源方制剂对模型小鼠血清SOD 和 MDA 的影响。
2.6 脏器指数测定
解剖获取各组小鼠的心、肝、脾、肺、肾和胸腺,使用生理盐水将脏器清洗干净,再用滤纸沾干生理盐水,称重后计算脏器指数。
2.7 HE 染色
解剖获取各组小鼠的肝脏和股骨,用 10% 甲醛固定,股骨进行脱钙处理。肝脏和股骨远端石蜡包埋切片(5 μm),常规方法脱蜡,进行 HE 染色,显微镜下观察组织病理改变。
2.8 统计分析
分析采用 SPSS 19.0 统计软件(SPSS,Chicago,IL,USA)和 GraphPad Prism Version 5(GraphPad Software,CA,USA)。全部数值用±SD 表示。多组间采用单因素方差分析进行检验统计,P<0.05 差异有统计学意义。
3 结果
3.1 不同工艺对 CTX 损伤小鼠生存情况的影响
观察结果显示,造模前各组小鼠精神状态较好,毛色光泽,饮水量较多;造模后,模型组小鼠从实验第 10日开始逐渐出现精神萎靡,皮毛粗糙并存在头部显著脱毛等现象。与模型组比较,给药组小鼠精神状态较好,毛皮脱落较模型组轻。
3.2 不同工艺对 CTX 损伤小鼠体质量变化的影响
各组动物体质量变化见表1所示,在第14日,模型组小鼠的体质量较空白组降低(P<0.001),表明CTX 会影响小鼠的正常发育;工艺Ⅰ组以及工艺 Ⅱ中、高剂量组小鼠相比模型组的体质量升高(P<0.05 或P<0.01)。

表1 小鼠14 d 体质量变化Tab 1 Body mass change in mice in 14 days
3.3 不同工艺对 CTX 损伤小鼠外周血常规的保护作用
小鼠外周血常规变化见表2。与空白组比较,模型组WBC 含量显著降低(P<0.01)。与模型组比较,地榆升白片组、工艺Ⅱ低剂量组和中剂量组可提高CTX 损伤小鼠的WBC 含量(P<0.05或P<0.01),表明正源方工艺Ⅱ组可以在一定浓度范围内保护因CTX 导致的小鼠体内的WBC 降低。各组RBC 和PLT 无显著差异。

表2 不同工艺对 CTX 损伤小鼠外周血常规的保护作用Tab 2 Protective effect of different processes on the peripheral blood in mice with cyclophosphamide-induced injury
3.4 不同工艺对CTX 损伤小鼠脏器的影响
各组小鼠脏器指数见表3,结果显示,与空白组比较,模型组小鼠脾脏肿大,这可能是注射CTX 引起机体的免疫应激,促进其脾脏的亢进,引起脾脏肿大。工艺Ⅰ组和工艺Ⅱ低、中剂量组可以显著降低模型组小鼠脾脏指数(P<0.05 或P<0.01)。各组间心、肝、肺、肾和胸腺的脏器指数无显著性差异。说明地榆升白片组和正源方各组对CTX 损伤小鼠的脾脏有显著保护作用。工艺Ⅱ高剂量组小鼠胃肠道药物粉末蓄积现象严重,表现为小鼠胃肠内容物显著增多。

表3 不同工艺对 CTX 损伤小鼠脏器指数的影响Tab 3 Effect of different processes on the organ index of mice with cyclophosphamide-induced injury
3.5 不同工艺对CTX 损伤小鼠的肝组织病理形态的影响
如图1所示:与空白组相比,模型组可见组织中有较多肝细胞轻度水肿,胞质疏松淡染(绿箭头),有髓外造血灶(红箭头),胞质中可见较小的圆形空泡(蓝箭头),偶见肝细胞点状坏死,核溶解(黑箭头);地榆升白片组、工艺Ⅰ组和工艺Ⅱ各剂量组均能在一定程度上减轻上述肝组织病理学损伤,肝细胞结构完整,排列整齐。提示正源方可明显改善CTX 损伤引起的肝组织损伤。
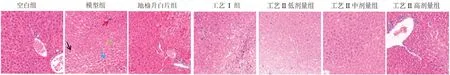
图1 肝脏HE 染色Fig 1 HE staining of liver
3.6 不同工艺对CTX 损伤小鼠的股骨组织病理形态的影响
如图2所示:模型组小鼠股骨的骨小梁数目减少,骨组织连接度降低,骨组织比例下降。工艺Ⅰ组和工艺Ⅱ各剂量组小鼠骨小梁的数目、骨组织连接度、骨组织比例都有明显的提高。提示正源方对CTX 损伤模型引起的股骨骨小梁丢失具有一定的保护作用。地榆升白片组作用不显著。

图2 股骨HE 染色Fig 2 HE staining of femur
3.7 不同工艺对CTX 损伤小鼠血清的SOD 和MDA 影响
各组小鼠血清的SOD 和MDA 含量见表4,结果显示,与空白组比较,模型组 SOD 水平降低,MDA 水平升高(P<0.01)。与模型组比较,工艺Ⅰ组和工艺Ⅱ各剂量组的SOD 水平上升(P<0.05 或P<0.01 或P<0.001),工艺Ⅰ组和工艺Ⅱ低、中剂量组 MDA 水平显著降低(P<0.05 或P<0.01)。初步表明正源方可以提高CTX 损伤小鼠血清的抗氧化作用。
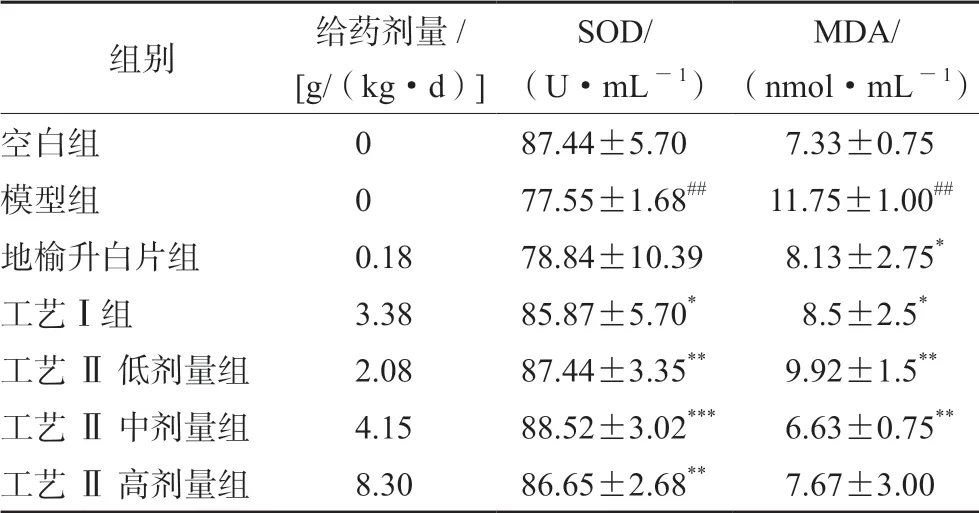
表4 不同工艺对CTX 损伤小鼠血清的SOD 和MDA 影响Tab 4 Effect of different processes on serum SOD and MDA in CTX-injured mice
4 讨论
CTX 化学损伤法是免疫抑制造模方法之一[4]。CTX 是一种烷化剂,是临床上常用的免疫抑制药物,可杀伤淋巴细胞,抑制B 细胞的特异性抗体反应,同时可损伤机体的免疫器官,抑制骨髓造血功能,从而影响免疫应答的各个阶段,导致机体免疫功能低下[4-5]。因此,研究能减少或拮抗CTX 毒副作用的药物,具有十分重要的意义。
正源方原汤剂每日一剂的临床应用生药量为97 g,由西洋参、仙鹤草、当归、南沙参等组成,日服用剂量较大,加之方剂化学成分复杂,不同的制备工艺对药物的临床疗效有很大影响[6],为了保障其与汤剂应用一致性;同时,为保证贵细药西洋参、重楼药物“全成分”充分利用,结合制剂需要,拟考虑将其部分粉碎,亦可发挥“药辅同源”之用途。本研究对比了传统水提干燥制备的工艺Ⅰ和采用新技术制备的工艺Ⅱ获得的制剂前体药物对CTX 损伤小鼠保护作用。工艺Ⅱ处理技术是根据文献资料所报道的方中各味中药有效成分、有效部位的理化特性以及正源方的功效作用,结合在前期化学成分研究和药理学活性研究的基础上[7-8],对正源方采用部分药材超微粉碎+水醇双提方法进行工艺制备。超微粉碎技术可以改变药材的均匀性,提高有效成分的溶出量、药理作用,达到提高制剂品质。刘颖等[8]发现超微七白散比普通粉末对抗黄体酮造成豚鼠皮肤损伤、氧化应激等得到更好的保护作用。
本文采用CTX 化学损伤法建立动物模型,研究了两种工艺获得的制剂前体药物对CTX 损伤小鼠的一般状态、外周血常规、组织脏器及血清中SOD 和MDA 含量变化的影响。结果显示,两种工艺获得的前体药物均可保护CTX 损伤小鼠的一般状态,但工艺Ⅱ中剂量组可增加外周血WBC 含量,工艺Ⅰ组无显著性差异;正源方各组能够有效保护CTX 损伤小鼠的脾脏、肝脏和骨组织。脾脏是体内重要的免疫器官,当感染或损伤时脾脏随之发生明显的变化,脾脏指数通常可以作为反映免疫功能变化的指标,与模型组相比,两组工艺获得制剂前体药物够降低因外界刺激导致机体免疫应激而引起的脾脏指数的增大,降低 CTX 对脏器的损伤,与前期研究结果基本一致[7]。CTX 会造成红细胞缓慢性的氧化损伤[9],通过检测小鼠血清中的 SOD 和 MDA 水平,两组工艺获得制剂前体药物均能够升高 SOD 水平,降低 MDA 水平,初步表明正源方可以保护机体免受氧化应激损伤。正源方工艺Ⅱ中剂量组较工艺Ⅰ组提高WBC 作用更优,其余观测指标两组效果相当,表明工艺Ⅱ中剂量组与工艺Ⅰ组在治疗 CTX 损伤时药效相当。实验发现,工艺Ⅱ中剂量组总体优于工艺Ⅱ高剂量组,一方面可能是因为超微粉碎使药物的有效成分较好地分散、溶解在胃液中,且与胃黏膜的接触面积变大,提高药理作用[10-11];另一方面可能是由于药材进行超微粉碎后有毒有害的成分暴露出来,或药液中水不溶性粉末过多,影响胃肠道的蠕动、黏膜吸收以及激素的分泌[12],从而导致高剂量组药材的毒理作用增加[11-12]。
综上所述,正源方两组工艺获得制剂前体药物对CTX 小鼠损伤具有一定的保护作用,工艺Ⅱ中剂量组比工艺Ⅰ的药理作用较为显著,但实验发现,工艺Ⅱ组药物吸收后可能影响胃肠道的蠕动、黏膜吸收以及激素的分泌药物,出现了部分的毒副反应,相关的药理作用和毒性副作用等均需要临床实践的检验和进一步的研究。

