白术标准汤剂质量评价方法的建立*
梁浩明,高永坚,陈盛君,区淑蕴,陈锦霞,陈伟钢,陈科成,林碧珊
(1.国药集团广东环球制药有限公司研发中心,佛山 528303;2.江阴天江药业有限公司研究院,江阴 214400)
中药标准汤剂是经标准化工艺制备而成的单味中药饮片水汤剂,用于标化临床用药,保障用药的准确性和剂量的一致性[1]。国家药典委员会在2016年发布《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》提出,中药配方颗粒以标准汤剂作为与临床汤剂疗效基本一致的标准参照物。
白术为菊科植物白术(AtractylodesmacrocephalaKoidz.)的干燥根茎,具有健脾益气、燥湿利水、止汗、安胎的功效,用于治疗脾虛食少,腹胀泄泻,痰饮眩悸,水肿,自汗,胎动不安[2]。白术主要成分为内酯、糖和有机酸等[3]。目前《中华人民共和国药典》2020版一部中仅从性状、鉴别、检查等项目对白术进行质量控制,并未规定含量测定项。脂溶性组分白术内酯Ⅲ是其主要活性物质,但由于水溶性差、转移率低,不足以表征物质基础的一致性[4]。笔者在本研究发现,水溶性成分绿原酸和果糖在白术标准汤剂的含量较白术内酯Ⅲ更高。因此,研究和探讨上述3个成分是否均可作为白术的质量标志物。实验收集6个产区共19批白术,建立白术标准汤剂中白术内酯Ⅲ、绿原酸和果糖的含量测定方法,计算出膏率和转移率,为白术饮片及其制剂的质量标准研究提供科学参考。
1 仪器与试药
1.1仪器 H-class型超高效液相色谱(UPLC)系统(包括二元泵,柱温箱,自动进样器和PDA检测器,Waters公司);ELSD-6000型蒸发光散射检测器(Alltech公司);BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm)均购自Waters公司; MS105DU型电子分析天平(梅特勒-托利多仪器公司,感量:0.01 mg);电控温煎药壶(深圳市一枚王电子商务有限公司);TRL-0.5型真空冷冻干燥机(大连双瑞科技有限公司);KQ-500DE型超声仪(昆山超声仪器有限公司);Synergy UV型超纯水仪(Millipore公司)。
1.2试药与药材 白术内酯Ⅲ对照品(批号:11978-201501,含量:99.9%)和绿原酸对照品(批号:110753-201716,含量:99.3%)均购自中国食品药品检定研究院,D-果糖对照品(批号:5964,纯度:98.8%)购自上海诗丹德标准技术服务有限公司;乙腈和磷酸均为色谱纯,超纯水由MILLIPORE纯水仪制备,其余试剂均为分析纯。
19批白术药材分别采集于浙江、安徽等不同种植产地,详细信息见表1,经国药集团广东环球制药有限公司质管部陈志荣主管中药师鉴定均为白术(AtractylodesmacrocephalaKoidz.)的干燥根茎。由本实验室按照《中华人民共和国药典》2015年版一部炮制项要求制成对应批次白术饮片。

表1 15批不同产地白术药材信息
2 方法与结果
2.1供试品的制备
2.1.1饮片供试品溶液的制备 白术内酯Ⅲ:取本品粉末(筛孔内径355 μm,过三号筛)约2 g,精密称定,置离心管中,加入70%乙醇10 mL,超声处理(500 W,40 kHz)30 min,8 000 r· min-1(离心半径r=9.8 cm)离心5 min,上清液转移至50 mL量瓶中,再重复提取2次,合并上清液,加入70%乙醇稀释至刻度,摇匀,滤过,取续滤液,即得。
绿原酸:取本品粉末(筛孔内径355 μm,过三号筛)约1.0 g,精密称定,置烧瓶中,精密加入30%乙醇20 mL,称定质量,加热回流30 min ,放冷,再称定质量,加30%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
果糖:取本品粉末(筛孔内径355 μm,过三号筛)约1.0 g,精密称定,置烧瓶中,加水50 mL,加热回流1 h,滤过,上清液转移至100 mL量瓶中,再重复提取1次,合并滤液,加水稀释至刻度,摇匀。精密量取滤液6 mL,置10 mL量瓶中,加乙腈稀释至刻度,混匀,滤过,取续滤液,即得。
2.1.2白术标准汤剂的制备 取白术药材,按《中华人民共和国药典》2015年版白术项下饮片炮制方法,去杂质,洗净,润透,切厚片,干燥,得白术饮片[2]。取白术饮片100 g,置5 L电控温煎药壶中,加 9 倍量水浸泡30 min,武火煮沸后文火煎煮30 min,趁热滤过,药渣再加7倍量水,武火煮沸后文火煎煮20 min,趁热滤过,2次滤液合并,65 ℃减压浓缩至约250 mL,-50 ℃预冷3 h后冷冻干燥24 h,得白术冻干粉,即白术标准汤剂。
2.1.3标准汤剂供试品溶液的制备 白术内酯Ⅲ:取本品适量,研细,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇25 mL,密塞,称质量,超声处理(500 W,40 kHz)30 min,取出,放冷,称定质量,用70%乙醇补足减失质量,摇匀,滤过,取续滤液,即得。
绿原酸:取本品适量,研细,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入超纯水10 mL,密塞,称定质量,超声处理(功率500 W,频率40 kHz)5 min,取出,放冷,称定质量,用超纯水补足减失质量,摇匀,滤过,取续滤液,即得。
果糖:取本品适量,研细,取约0.1 g,精密称定,置具塞锥形瓶中,精密加入40%乙腈10 mL,密塞,称定质量,超声处理(功率500 W,频率40 kHz)10 min,取出,放冷,称定质量,用40%乙腈补足减失质量,摇匀,滤过,取续滤液,即得。
2.2对照品溶液制备 ①取白术内酯Ⅲ对照品适量,精密称定,加甲醇制成每毫升含8.52 μg的对照品溶液,即得。②取绿原酸对照品适量,精密称定,加甲醇制成每毫升含0.100 mg的对照品溶液,即得。③取D-果糖对照品适量,精密称定,加40%乙腈制成每毫升含1.06 mg的对照品溶液,即得。
2.3色谱条件 白术内酯Ⅲ:色谱柱BEH C18(100 mm×2.1 mm,1.7 μm);流动相为乙腈(A)-水(B),梯度洗脱(0~7 min,50%A;>7~8 min,50%→90%A;>8~10 min,90%A);柱温30 ℃;流速0.20 mL·min-1;检测波长220 nm;进样量1 μL。
绿原酸:色谱柱BEH C18(100 mm×2.1 mm,1.7 μm);流动相为乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~4 min,1%→6%A;>4~10 min,6%→9%A;>10~20 min,9%→90%A);柱温25 ℃;流速0.25 mL·min-1;检测波长325 nm;进样量1 μL。
果糖:色谱柱BEH Amide(100 mm×2.1 mm,1.7 μm);流动相为含0.2%三乙胺的乙腈-水(80:20);柱温40 ℃;流速0.20 mL·min-1;进样量1 μL;ELSD检测器检测,漂移管温度75 ℃,气体流速1.5 L·min-1。
对照品溶液和供试品溶液的色谱图见图1—图3。

1.白术内酯Ⅲ。

1.绿原酸。
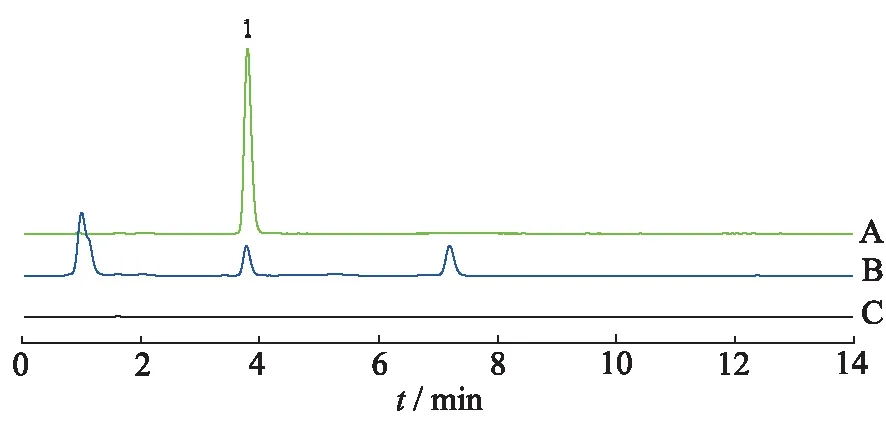
1.D-果糖。
2.4方法学考察
2.4.1线性关系考察 取白术内酯Ⅲ、绿原酸和D-果糖对照品适量,按“2.2”项下方法分别制成质量浓度分别为53.2 μg·mL-1,0.197 mg·mL-1,2.12 mg·mL-1的对照品溶液,逐步稀释成不同浓度梯度,按“2.3”项下色谱条件测定,记录峰面积。白术内酯Ⅲ和绿原酸以对照品溶液浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,回归方程分别为Y=20.389X+3.125 3(r=1.000)和Y=12 999X+1 353.1(r=1.000)。D-果糖以对照品溶液浓度对数值为横坐标(X),峰面积对数值为纵坐标(Y)进行线性回归,回归方程为Y=1.706 8X+6.793 9(r=0.999 3)。三者分别在0.266~53.2 μg·mL-1、0.004~0.197 mg·mL-1和0.021~2.12 mg·mL-1浓度范围内均呈现良好的线性关系。
2.4.2精密度实验 取白术内酯Ⅲ、绿原酸和D-果糖对照品溶液适量,分别按“2.3”项下色谱条件重复进样6次,计算得到峰面积的RSD值均小于0.60%,表明仪器精密度良好。
2.4.3稳定性实验 分别取饮片供试品溶液和标准汤剂供试品溶液,于0,4,8,12,18和24 h,按“2.3”项下色谱条件进样测定,饮片和标准汤剂供试品溶液的白术内酯Ⅲ峰面积RSD分别为1.79%和0.96%,绿原酸峰面积的RSD值分别为1.33%和0.20%,果糖峰面积的RSD值分别为0.78%和0.83%,表明供试品溶液中白术内酯Ⅲ、绿原酸和D-果糖在24 h内稳定。
2.4.4重复性实验 分别取饮片和标准汤剂,分别按“2.1”项下方法平行制备供试品溶液各6份。按“2.3”项下色谱条件进样测定,饮片和标准汤剂供试品溶液的白术内酯Ⅲ峰面积RSD分别为2.09%和1.42%,绿原酸峰面积的RSD值分别为0.60%和0.51%,果糖峰面积的RSD值分别为0.64%和1.64%,表明该方法重复性良好。
2.4.5加样回收率 精密称取已知含量的饮片和标准汤剂,各6份,按1:1分别加入白术内酯Ⅲ、绿原酸和D-果糖对照品,按“2.1”项下方法制备供试品溶液。按“2.3”项下色谱条件进样测定,饮片和标准汤剂供试品溶液的白术内酯Ⅲ平均回收率分别为96.5%和97.0%,绿原酸的平均回收率分别为99.2%和103.6%,果糖的平均回收率分别为98.7%和97.8%,RSD值均小于3.0%。
2.5含量测定 取19批白术饮片及其标准汤剂,按“2.1”项下方法制备供试品溶液,按“2.3”项下色谱条件分别测定白术内酯Ⅲ、绿原酸和果糖含量,结果见表2。结果显示19批白术饮片中,白术内酯Ⅲ含量为0.004%~0.096%,绿原酸含量为0.009%~0.120%,果糖含量为1.59%~17.3%;标准汤剂中,白术内酯Ⅲ含量为0.002%~0.059%,绿原酸含量为0.011%~0.131%,果糖含量为1.79%~30.7%。
2.6白术标准汤剂工艺参数测定
2.6.1出膏率 白术标准汤剂的出膏率以冷冻干燥所得干膏粉质量(m)与投料量(m0)的比值计算,出膏率=m/m0,结果见表2。白术19批标准汤剂的出膏率为48.5%~65.5%,平均出膏率为(56.8±5.7)%。不同批次的出膏率差异较小,范围位于均值的±30%。
2.6.2转移率 白术内酯Ⅲ、绿原酸和果糖的转移率分别以每克饮片经标准汤剂提取出该成分的量(W)与每克饮片含该成分的量(M)的比值计算,转移率(%)=W/M×100%,结果见表2。转移率以白术内酯Ⅲ计算为13.6%~54.5%,平均为(30.7±12.5)%;以绿原酸计算为36.0%~94.9%,平均为(69.2±12.0)%;以果糖计算为68.7%~99.1%,平值为(84.5±9.0)%。

表2 白术标准汤剂的出膏率和转移率
3 讨论
3.1含量分析方法考察 前期研究发现,白术内酯Ⅲ和绿原酸在白术标准汤剂指纹图谱中为主要的色谱峰,而果糖在白术水煎液中含量较高。本实验建立3种成分的含量测定方法,分别对检测器、检测波长、流动相组成、色谱柱、提取溶剂、提取方法等因素进行考察,确定本文所用色谱条件。研究期间发现,部分批次白术内酯Ⅲ和绿原酸的含量、峰响应差异较大,且极性存在一定差异,不利于同时测定两种成分的含量。另外,硅胶氨基柱分析果糖时容易产生希夫碱,造成蒸发光散射检测器的基线噪音较大[5],选用BEH Amide色谱柱可避免上述情况,提高定量准确性和兼容性。
3.2不同产地白术成分含量比较 为保证标准汤剂的代表性,本实验白术药材来源于多个主产区,包括湖南、河北、河南、重庆、安徽、浙江。计算各产区成分的平均含量,河北保定、浙江金华和重庆秀山的白术内酯Ⅲ平均含量较接近,为0.018%~0.033%,河南焦作和安徽约为0.008%,湖南隆回为0.087%。河北保定、湖南隆回和浙江金华的绿原酸平均含量为0.052%~0.065%,而河南焦作、重庆秀山和安徽为0.014%~0.019%。湖南隆回、河南焦作和安徽的果糖平均含量为2.24%~3.00%,浙江金华和重庆秀山为4.18%~5.40%,河北保定为11.3%。因此,与白术内酯Ⅲ和绿原酸相比,果糖的含量较高且不同产地之中含量差异相对较小。
3.3转移率考察 白术标准汤剂中,白术内酯Ⅲ、绿原酸和果糖的转移率分别为(30.7±12.5)%,(69.2±12.0)%和(84.5±9.0)%。果糖的含量高于白术内酯Ⅲ和绿原酸,且果糖比白术内酯Ⅲ、绿原酸的转移率高且稳定。因此,白术标准汤剂的转移率,建议选用果糖作为指标成分进行计算。
综上所述,果糖在白术标准汤剂中含量高、转移率稳定。果糖在临床上常用于机体能量补充及体液调节[6],而近年研究表明果糖等低分子糖口服后能影响人体肠道运动,调节益生菌群,调控肠道糖类摄取转运体表达,治疗慢性腹泻和腹部疼痛等胃肠道症状[7-9],其胃肠道活性或与白术益气健脾功效密切相关。因此,果糖可作为白术及其标准汤剂的质量控制标志物。

