2种茄科植物花色变化的生理生化机制
蒋朵朵,李林
(1.广西大学 林学院,广西 南宁 530004;2.广西艺术学院 建筑艺术学院,广西 南宁 530007)
茄科植物种质资源丰富,主要分布在温带、亚热带与热带地区,包含约95属2 300余种,其中我国约 有 26 属 107种[1]。鸳鸯茉莉(Brunfelsia acuminata)和大花茄(Solanum wrightii,也称双色木番茄)是广泛分布于我国华南地区的2种茄科植物,为极佳的园林绿化树种。二者花期近乎全年,花色为自然界中较少见的蓝紫色,且随着花期的推移花色均由蓝紫色逐渐褪至白色,将其运用在园林中可营造独特的一株多色的景观效果。
前人对鸳鸯茉莉和大花茄的研究大多集中在栽培管理、修剪、花色相关基因的克隆等方面[2-4]。其中,陈小红等[5]对鸳鸯茉莉花色变化过程中色素含量、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性等生理生化指标进行了初步探讨;李敏等[6]使用HPLC 色谱法对鸳鸯茉莉不同花期花色苷进行了定性和定量分析。林华[7]在针对福建省茄科植物的调查中对大花茄资源应用情况进行了一定评价;尹婷[8]研究了双色木番茄幼苗对弱光的耐受性,发现其生长的适宜条件为弱光环境(46.4%自然光照);亢亚超等[9]、郭品湘等[10]研究了不同遮光条件对大花茄幼苗生长的影响。然而,针对鸳鸯茉莉和大花茄花色变化机制的相关研究还较少,且对二者的比较研究尚未见报道。鉴于此,对鸳鸯茉莉和大花茄开花进程中6 个阶段的花色表型,pH 值,可溶性糖、可溶性蛋白、花色苷、类黄酮、类胡萝卜素含量,苯丙氨酸解氨酶(PAL)、查尔酮异构酶(CHI)活性等相关生理生化指标进行测定,并对其花色苷组分进行定性和定量分析,探究二者花色变化的机制,为植物花色育种提供一定的理论依据,同时也为今后利用基因工程技术定向培育蓝色花植物奠定理论基础。
1 材料和方法
1.1 植物材料
鸳鸯茉莉和大花茄的取样地均为广西壮族自治区南宁市花卉公园,树龄均在10 a 以上。随机选取生长健壮、植株繁茂、无病虫害的15 株鸳鸯茉莉和3 株大花茄,于2019 年4 月上旬分别在每株植物的东、西、南、北方位随机混合采样。采集开花各个阶段(花蕾初期、花蕾末期、初花期、盛花期、盛花末期、末花期,具体见图1 和图2)的花朵,去掉花梗、雄蕊和雌蕊,将花瓣装在自封袋中,迅速放入冰盒,带回实验室备用。
1.2 研究方法
1.2.1 花径测量 采用游标卡尺测量花径,选取鸳鸯茉莉与大花茄处各开花阶段的花朵,每朵花的花径测量3次,每个开花阶段测定20朵花,取平均值。
1.2.2 花色测定 选取鸳鸯茉莉与大花茄各开花阶段的新鲜花朵20 朵,采用目测法、皇家园艺协会比色卡(Royal horticultural society colour chart,RHSCC)以及精密色差仪测定植物花瓣的颜色。每朵花测3 次,最后取平均值。仪器测色主要是测定明度(L*)和2个色相值(a*、b*),并根据公式计算彩度C*和色相角h,C*=(a*2+b*2)1/2,h=arctan(b*/a*)。
1.2.3 细胞液pH值测定 参照张超等[11]的方法,略有改动。用精密天平称取各开花阶段的鸳鸯茉莉鲜样0.2 g 和大花茄鲜样0.3 g,加入2 mL 蒸馏水研磨至匀浆,用酸度计测定花瓣细胞匀浆的pH 值,使用匀浆pH 值代表花瓣细胞液的pH 值,重复5次,取平均值。
1.2.4 可溶性糖含量测定 参照李合生[12]的蒽酮比色法测定花瓣的可溶性糖含量。
1.2.5 可溶性蛋白含量测定 采用考马斯亮蓝法[12]测定花瓣的可溶性蛋白含量。
1.2.6 PAL 和CHI 活性测定 参照王惠聪等[13]的方法,并略做修改。
1.2.7 类胡萝卜素含量测定 取新鲜花瓣,擦净组织表面污物(去掉中脉),剪碎混匀。分别称取剪碎的新鲜样品大花茄0.3 g,鸳鸯茉莉0.1 g,各3 个重复,加入丙酮、乙醇各5 mL(共计10 mL)于20 mL 刻度试管中,盖塞后于室温下暗藏24 h 至组织变白。用80% 丙酮作对照。用酶标仪测定663、645、470 nm 波长的OD 值,并计算叶绿素a(Ca)、叶绿素b(Cb)、类胡萝卜素含量[12]。
1.2.8 类黄酮与花色苷含量测定 参照李彦慧[14]的方法,分别取新鲜大花茄与鸳鸯茉莉花朵,去掉雄蕊和雌蕊,擦干净表面污物,将花瓣剪碎并混合均匀,精确称取0.1 g置入研钵中,加入液氮,研磨至匀浆,加入10 mL 1%盐酸甲醇进行花瓣细胞内花色苷与类黄酮的提取,4 ℃黑暗环境下浸提24 h,重复3次。用全自动全波长酶标仪测定540 nm(花色苷)和325 nm(类黄酮)波长处的OD 值,花色苷(类黄酮)含量以每克花瓣鲜质量提取液的光密度变化值为一个单位(U)。
1.2.9 花色苷组分定性与定量分析
1.2.9.1 花色苷提取 参照李敏等[6]的方法,分别精确称取1.0 g 鸳鸯茉莉和大花茄花蕾末期的新鲜花瓣,在冰浴下将花瓣研磨至匀浆,立即将匀浆转入离心管中,并加入5 mL 1%盐酸甲醇溶液进行提取,离心管置于黑色塑料袋内,遮光置于4 ℃冰箱中萃取24 h,隔12 h振荡1~2 min。提取完成后转移色素提取液至新的离心管,-20 ℃保存。再加入5 mL 提取液重复提取1 次,将2 次萃取所得提取液合并,用离心机10 000×g离心10 min,取上清液至新的容器,分别将鸳鸯茉莉定容至15 mL,大花茄定容至10 mL。将提取液用0.22 μm 微孔滤膜过滤后置于-20 ℃冰箱保存,用于后续花色苷的定性和定量分析。
1.2.9.2 标准品制备、标准曲线制作及花色苷组分检测 分别精确称取氯化飞燕草素、氯化矢车菊素、氯化牵牛花色素、氯化天竺葵素、氯化芍药素、氯化锦葵素6种花色苷标准品1.0 mg,用1%盐酸甲醇溶解并定容至10 mL,充分摇匀,配制成100 mg/L标准储备液,-18 ℃冷冻保存。
从标准储备液中吸取一定量的6种花色苷的混标,用1%盐酸甲醇分别稀释成0.4、1、2、5、10、50、100 mg/L 7种标准溶液质量浓度,采用高效液相色谱法测定各质量浓度标准品的峰面积。以花色苷质量浓度为纵坐标,峰面积为横坐标,绘制标准曲线。分别在6个不同开花阶段鸳鸯茉莉与大花茄花色苷提取液中加入标准品上机检测,采用外标法计算各组分的含量,重复3次,取平均值。
高效液相色谱分析选用Waters 公司生产的型号为e2695 的检测器,色谱柱为Symmetry C18 反相硅胶柱(4.6 mm×250 mm,5 μm)。分析条件:柱温30 ℃,流速为0.8 mL/min,进样量20 μL,检测波长540 nm。流动相:水相A 液为7.5%甲酸水[V(甲酸)∶V(水)]=7.5∶92.5];有机相B 液为100%乙腈。其中乙腈为色谱级,水为超纯水,甲酸为分析纯,水相及有机相上机前均经过微孔滤膜过滤。洗脱程序为线性梯度洗脱模式,梯度设置为:0~10 min,10%B~15%B;10~15 min,15%B~23%B;15~25 min,23%B~40%B;25~28 min,40%B;28~30 min,10%B。
1.3 数据统计分析
用Microsoft Excel、Origin 2020 进行数据整理和作图,用SPSS 25.0 软件进行方差分析和相关性分析。
2 结果与分析
2.1 鸳鸯茉莉和大花茄开花进程中花径的变化
鸳鸯茉莉开花进程中,花径表现出递增的趋势,大花茄花径则表现出先增大再减小的趋势(表1)。进入初花期后,鸳鸯茉莉和大花茄花径显著增大,较花蕾末期分别显著增加255.6% 和511.8%,随后花径增幅变小。
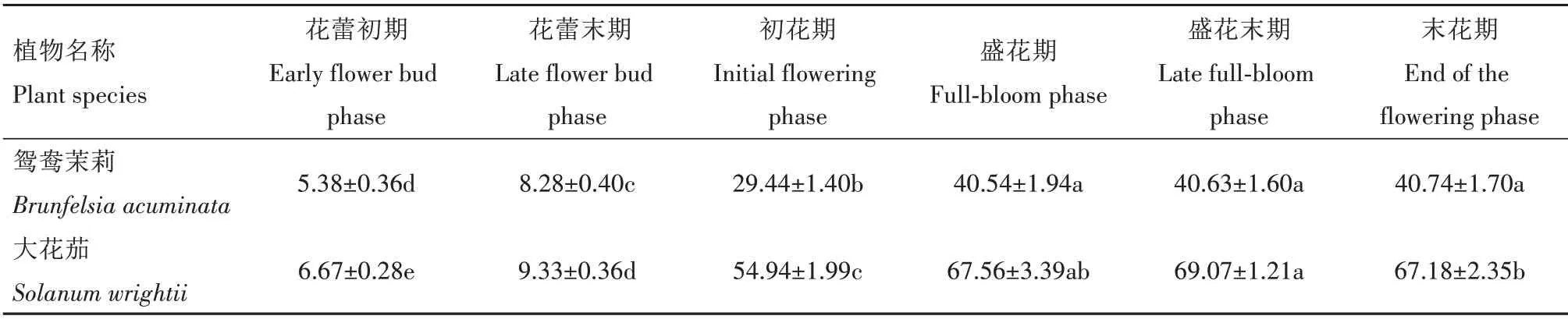
表1 鸳鸯茉莉与大花茄开花进程中花径的变化Tab.1 Changes of flower diameter of Brunfelsia acuminata and Solanum wrightii during flowering mm
各开花阶段,大花茄花径均大于鸳鸯茉莉,尤其在盛花末期,大花茄花径达到最大值(69.07 mm),显著大于鸳鸯茉莉末花期的最大值(40.74 mm,P<0.05)。
2.2 鸳鸯茉莉和大花茄开花进程中花瓣色度值的变化
如表2 所示,鸳鸯茉莉与大花茄的明度L*值随着开花进程均呈先下降后上升趋势。花蕾初期至花蕾末期鸳鸯茉莉明度L*值由31.70 降到30.64,大花茄由53.31 降至19.04,开花后,两者的明度L*值逐渐升高,分别于末花期达到最大值(分别为87.48、80.50)。

表2 鸳鸯茉莉与大花茄开花进程中的花色表型变化Tab.2 Changes of flower color phenotype of Brunfelsia acuminata and Solanum wrightii during flowering
鸳鸯茉莉和大花茄的色相值a*均呈先增大后减小的趋势,表明红度先增强后减弱。鸳鸯茉莉的a*值在花蕾末期达到最大值(39.93),而大花茄的a*值在初花期达到最大值(44.71)。开花后,红色减弱,二者的a*值在末花期均降至最小值(分别为0.96、1.91)。
2种植物的色相值b*均呈现先下降后上升的趋势,鸳鸯茉莉b*值在花蕾末期降至最小值(表示蓝色最深),为-46.19,大花茄b*值在初花期降至最小值(-51.51)。开花后,鸳鸯茉莉和大花茄的b*值逐渐增大,末花期分别升至5.18和5.21。
2种植物的花色表型变化与肉眼观察到的花色由蓝紫色褪变为白色、亮度逐渐增强的变化高度一致。各开花阶段L*、a*、b*值均呈现显著变化(P<0.05)。
2.3 鸳鸯茉莉和大花茄开花进程中花瓣细胞液pH值的变化
由图3 可知,鸳鸯茉莉和大花茄在开花进程中花瓣细胞液的pH 值均在酸性范围内。大花茄pH值变化幅度较小,且在开花各阶段均高于鸳鸯茉莉;鸳鸯茉莉pH 值介于5.40~5.94,在开花各阶段均呈现显著差异(P<0.05),变化幅度相对较大,于末花期达到最大值。
2.4 鸳鸯茉莉和大花茄开花进程中花瓣可溶性糖含量的变化
随着开花进程的推进,鸳鸯茉莉与大花茄花瓣中可溶性糖含量变化趋势相似,均呈先上升后下降的单峰曲线,在盛花期达到峰值(图4)。除末花期外,各开花阶段鸳鸯茉莉花瓣可溶性糖含量均远大于大花茄。盛花期(峰值期),鸳鸯茉莉花瓣可溶性糖含量为大花茄的2.75倍。
2种植物的可溶性糖含量变化趋势虽整体上具有一致性,但也存在一定的差异。鸳鸯茉莉花瓣可溶性糖含量在盛花期最高,达60.92 mg/g,较花蕾初期增加154.48%,盛花期后迅速降低,末花期比盛花期降低79.88%;大花茄花瓣可溶性糖含量从花蕾初期至盛花期基本呈直线上升,至盛花期达到峰值(16.26 mg/g),较花蕾初期上升了623.52%,随后缓慢下降,末花期比盛花期降低26.53%。
2.5 鸳鸯茉莉和大花茄开花进程中花瓣可溶性蛋白含量变化
鸳鸯茉莉和大花茄花瓣的可溶性蛋白含量均呈先上升后下降的趋势(图5),分别在不同开花阶段达到峰值,鸳鸯茉莉在盛花期达到峰值(3.19 mg/g),比花蕾初期提高185.63%;大花茄在花蕾末期达到峰值(2.98 mg/g),比花蕾初期提高18.02%。随后,2种植物花瓣的可溶性蛋白含量一直呈下降趋势。与峰值相比,末花期鸳鸯茉莉和大花茄花瓣的可溶性蛋白含量分别降低48.00%和78.48%。
2.6 鸳鸯茉莉和大花茄开花进程中花瓣PAL活性变化
由图6可以看出,在整个开花阶段中,鸳鸯茉莉花瓣的PAL 活性均高于大花茄,二者的PAL 活性变化趋势具有明显差异。大花茄PAL 活性表现为先上升后下降,于花蕾末期达到最大,显著高于其他开花阶段(P<0.05)。鸳鸯茉莉PAL 活性表现为先下降后缓慢上升,花雷初期最高,为28.88 U/g,显著高于其他开花阶段(P<0.05),盛花期降到最低。
2.7 鸳鸯茉莉和大花茄开花进程中花瓣CHI活性变化
如图7 所示,鸳鸯茉莉和大花茄花瓣CHI 活性变化具有相同趋势,均表现为先上升后下降,最大值均出现在花蕾末期,大花茄峰值比鸳鸯茉莉高110.24%,两者之间呈显著性差异(P<0.05)。各开花阶段,大花茄CHI 活性均显著高于鸳鸯茉莉。大花茄花瓣CHI 活性在花蕾末期取得最大值(71.51 U/g),比末花期(最低值)高92.96%,与其他各开花阶段均呈显著性差异(P<0.05)。鸳鸯茉莉花朵开放后花瓣的CHI 活性变化极为缓慢,末花期(最低值)较花蕾末期(最大值)下降48.75%。
2.8 鸳鸯茉莉和大花茄开花进程中花瓣类胡萝卜素含量变化
图8 表明,各开花阶段大花茄花瓣类胡萝卜素含量均高于鸳鸯茉莉。大花茄在开花进程中类胡萝卜素含量呈下降趋势,花蕾初期至初花期类胡萝卜素含量急剧下降,初花期后类胡萝卜素含量缓慢降低。鸳鸯茉莉各开花阶段类胡萝卜素含量之间差异相对较小,表明鸳鸯茉莉中类胡萝卜素含量极低。
2.9 鸳鸯茉莉和大花茄开花进程中花瓣类黄酮与花色苷含量变化
如图9所示,除初花期以外,其他开花阶段鸳鸯茉莉花瓣类黄酮含量均高于大花茄。鸳鸯茉莉花瓣类黄酮含量随开花进程推进呈先上升后下降再上升的趋势,于花蕾末期达到峰值(39.57 U),比初花期最低值(25.97 U)高52.40%,比大花茄花蕾末期峰值(37.49 U)高5.55%。大花茄花瓣类黄酮含量呈先升高后下降趋势,花蕾末期达到峰值,较花蕾初期显著升高54.70%,花朵开放后类黄酮含量呈显著下降趋势,于末花期达到最低值(15.28 U)。
鸳鸯茉莉和大花茄花瓣花色苷含量变化趋势一致(图10),均呈先上升后下降的趋势。除盛花末期和末花期外,各开花阶段鸳鸯茉莉花瓣花色苷含量均高于大花茄。在花蕾末期,鸳鸯茉莉花色苷含量达到峰值,为同样达到峰值的大花茄的1.67 倍。鸳鸯茉莉花色苷含量在花蕾末期较花蕾初期显著上升69.20%,其后急剧下降。大花茄的花色苷含量由花蕾初期到花蕾末期显著上升355.80%,其后也一直保持下降趋势。
鸳鸯茉莉和大花茄的类黄酮含量和花色苷含量均在花蕾末期达到峰值,说明蕾期是2种植物类黄酮和花色苷合成和积累的关键时期。
2.10 各指标间相关性分析
对鸳鸯茉莉与大花茄开花进程中花瓣可溶性糖、可溶性蛋白、类胡萝卜素、类黄酮、花色苷含量,pH 值,PAL、CHI 活性及色度值指标(L*、a*、b*、C*、h)进行相关性分析,结果显示,鸳鸯茉莉开花进程中各色度值指标均与花色苷含量呈极显著相关关系,与类黄酮含量的相关系数不显著,明度L*、色相角h 与类胡萝卜素含量呈极显著相关(表3);大花茄开花进程中色度值指标L*、a*、b*、C*与花色苷含量均呈极显著相关关系,与类黄酮含量也均呈极显著相关,而类胡萝卜素含量仅与明度L*呈极显著相关关系(表4)。
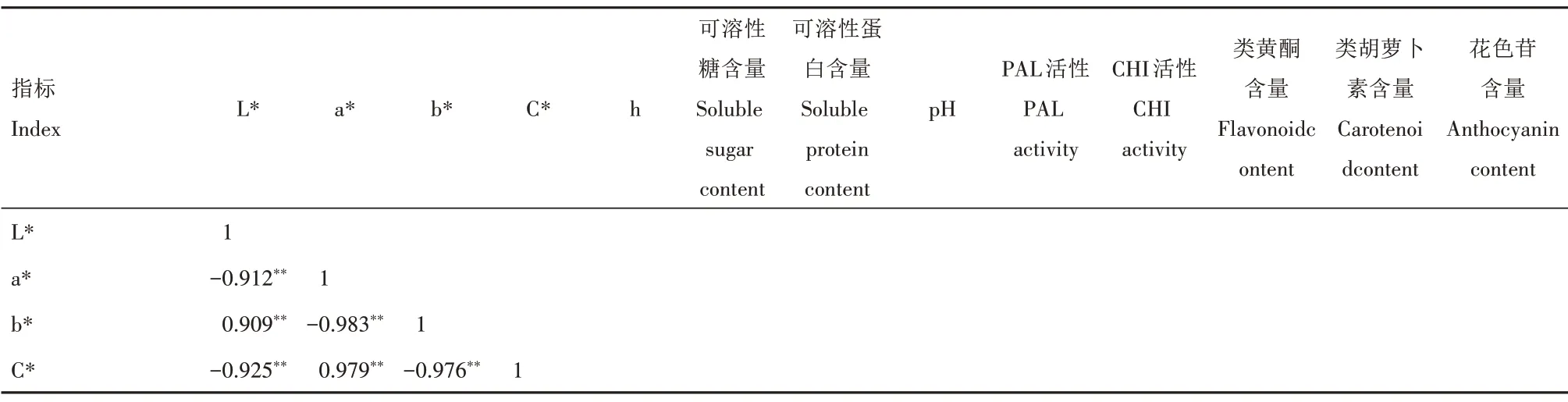
表3 鸳鸯茉莉开花进程中各指标间的相关系数Tab.3 Correlation coefficient of all indexes of Brunfelsia acuminata during flowering process
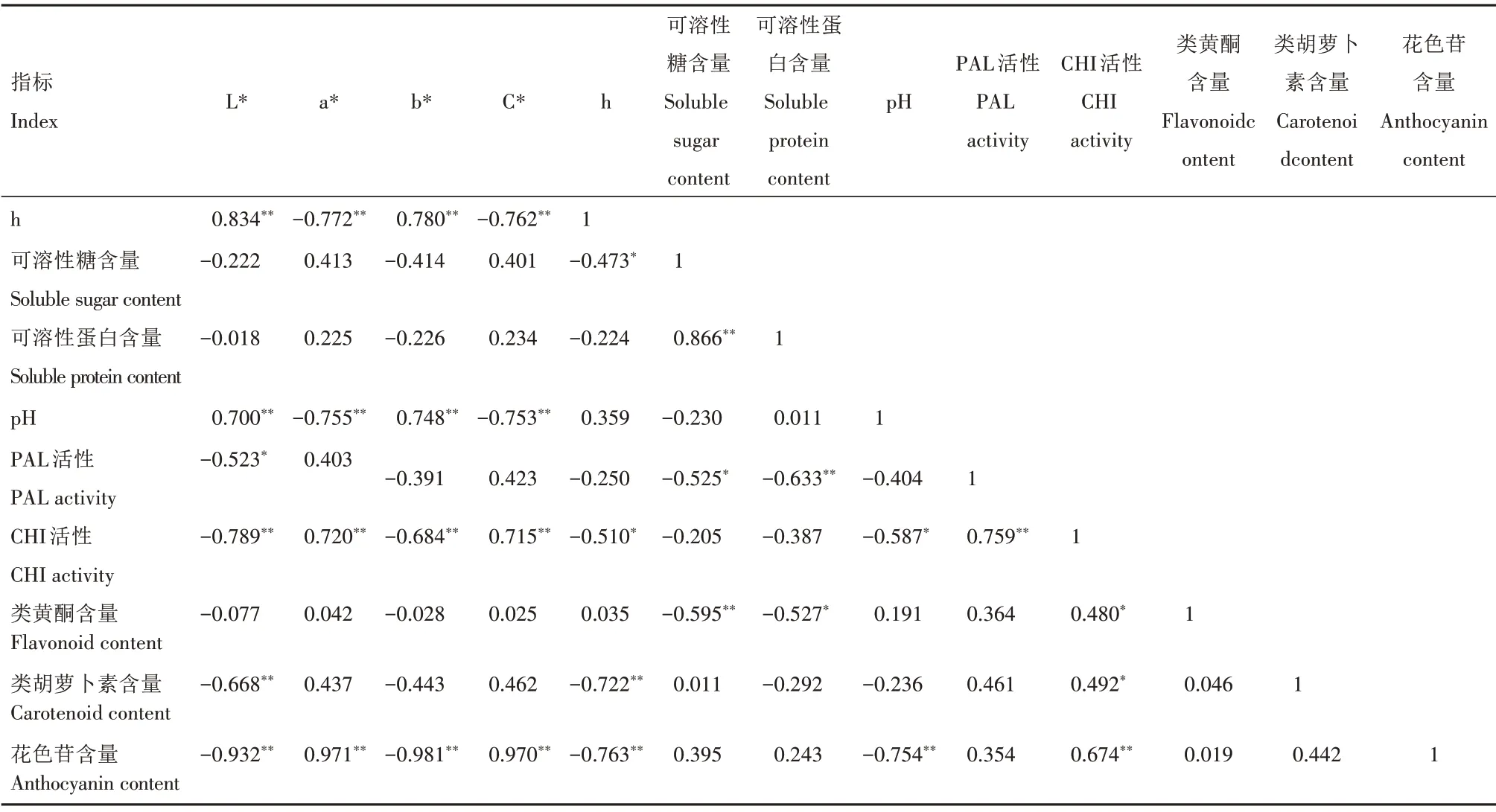
续表3 鸳鸯茉莉开花进程中各指标间的相关系数Tab.3 (Continued)Correlation coefficient of all indexes of Brunfelsia acuminata during flowering process
另外,鸳鸯茉莉开花进程中各色度值指标与可溶性蛋白含量相关性不显著,色相角h 与可溶性糖含量、明度L*与PAL 活性呈显著相关关系,大部分色度值指标与pH 值、CHI 活性呈极显著相关;大花茄开花进程中色度值指标L*、a*、b*、C*与CHI活性呈极显著相关,部分色度值指标与可溶性糖含量、可溶性蛋白含量、pH 值、PAL 活性呈显著或极显著相关。
2.11 鸳鸯茉莉和大花茄花蕾末期花色苷组分的定性与定量分析
由于大花茄与鸳鸯茉莉在花蕾末期的花色苷和类黄酮含量均最高(图9 和图10),因此选择该时期的花色苷提取液进行定性分析。由图11 可见,2种植物都检测出6个色谱峰,大花茄花色苷提取液所有峰的分离效果均较好,鸳鸯茉莉除b3 和b4 两个峰分离效果略差外,其余各组分也实现了较好的分离。根据鸳鸯茉莉与大花茄花蕾末期花色苷提取液检测到的各峰的保留时间,经过与标准品比对,确定5 min 之前出现的峰为溶剂峰,大花茄花瓣中组分a2 定性为氯化矢车菊素,组分a3 定性为氯化矮牵牛素,其余4 个组分(a1、a4、a5 和a6)未能与标准品匹配上,具体为何种物质尚不明确。鸳鸯茉莉花瓣中组分b4 定性为氯化矮牵牛素;其余组分(b1、b2、b3、b5 和b6)未与标准品保留时间匹配上,具体为何种物质还需进一步确定。但鸳鸯茉莉与大花茄花瓣中组分a1 与b2、a3 与b4(氯化矮牵牛素)、a5 与b5、a6 与b6 保留时间近乎一致,可以判定为同一种化学物质。
由表5 和表6 可见,鸳鸯茉莉与大花茄花瓣花色苷总量在不同开花阶段均表现出显著差异(P<0.05),且均随花朵开放进程呈先上升后下降的趋势,于花蕾末期达到最高值,与图10 结果一致。结合图11,由表5 可见,组分a3(氯化矮牵牛素)和组分a5 是大花茄花色苷中占比较大的2 个组分,花蕾末期组分a3 和a5 分别占总花色苷的48.89%和41.10%,其他花色苷组分含量较低。不同开花阶段2 个主要组分的占比处于动态变化之中。末花期,大花茄花色苷总量降至21.58 μg/g,比花蕾末期(699.72 μg/g)下降了96.92%。由表6 可见,组分b5是鸳鸯茉莉花色苷中的主要成分,花蕾末期组分b5约占总花色苷含量的82.86%,其他5种组分含量很低。末花期,鸳鸯茉莉花色苷总含量降至15.51 μg/g,较花蕾末期(1 321.37 μg/g)下降98.83%。总体上看,除盛花末期和末花期外,各开花阶段鸳鸯茉莉的花色苷总含量均高于大花茄。
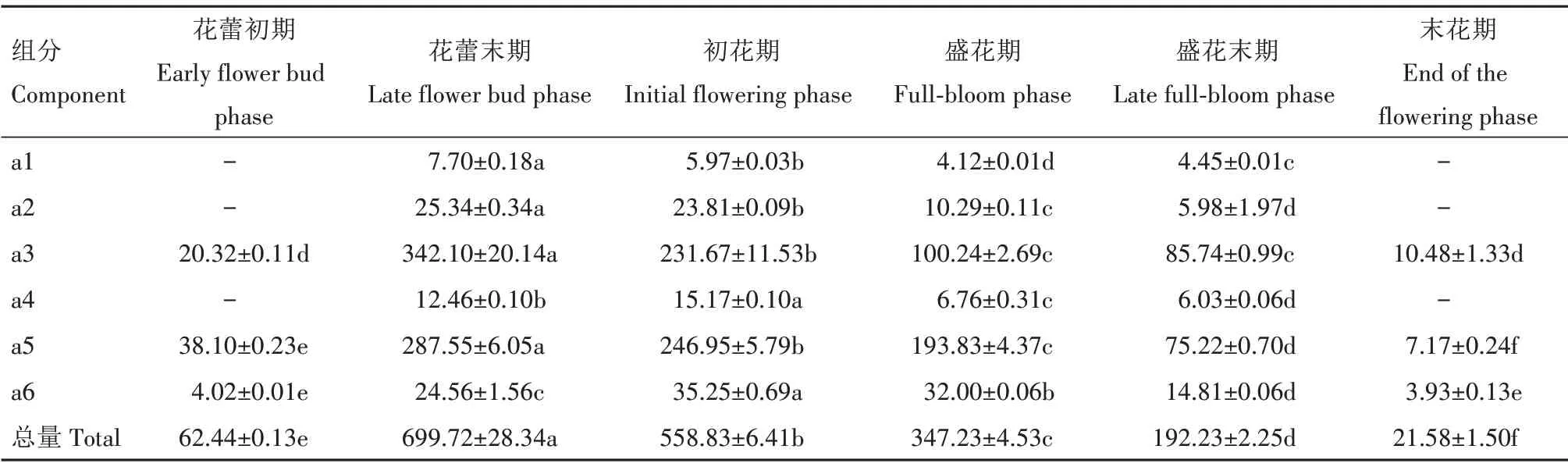
表5 大花茄不同开花阶段花瓣中花色苷含量Tab.5 Anthocyanin concent of Solanum wrightii during flowering μg/g
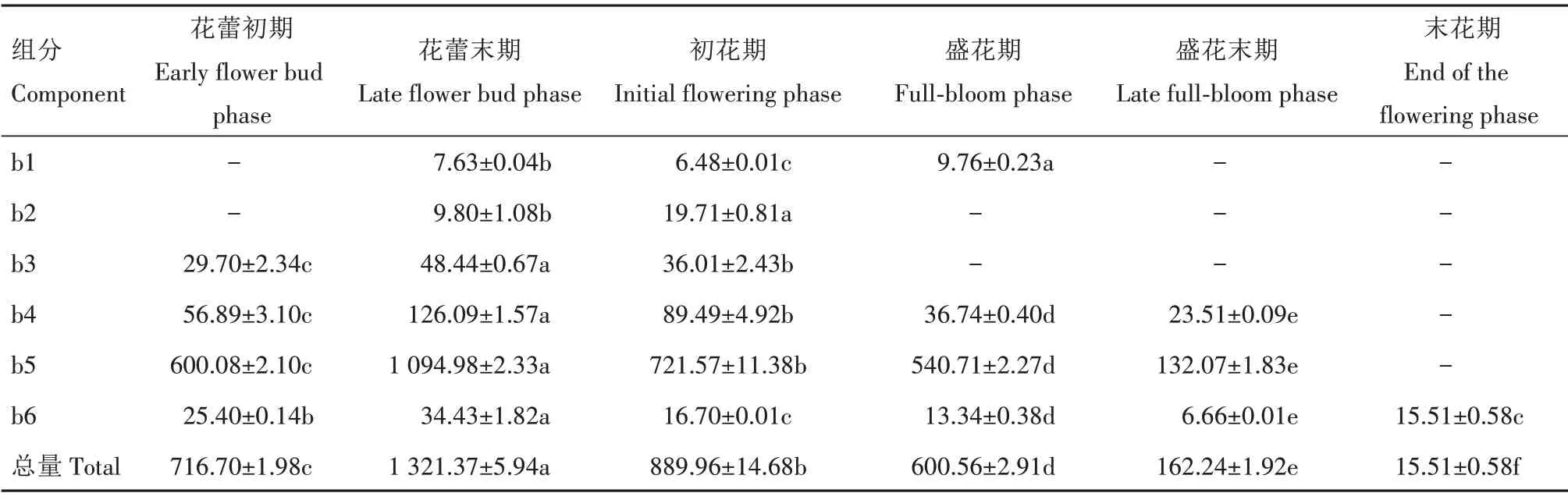
表6 鸳鸯茉莉不同开花阶段花瓣中花色苷含量Tab.6 Anthocyanin concent of Brunfelsia acuminata during flowering μg/g
3 结论与讨论
3.1 鸳鸯茉莉和大花茄花色与生理生化指标的关系
通过对不同开花阶段色度值指标的分析发现,鸳鸯茉莉与湖北海棠、西府海棠等观赏海棠不同时期的花色变化[15]趋势一致:花蕾末期花色亮度L*值最低,花色饱和度C*值最高;而末花期花色亮度L*值最高,花色饱和度C*值最低;盛花期花色不论是亮度L*值还是饱和度C*值均趋于中间值。大花茄花色变化趋势与观赏海棠略有不同。
植物花色受花瓣细胞液pH 值的影响,在酸性条件下呈红色,在碱性条件下表现为蓝色。通常花色偏紫或偏蓝的植物,其花瓣表皮的pH值偏高。本研究中,鸳鸯茉莉与大花茄在开花进程中其花瓣细胞液的pH 值均发生一定变化,但均在酸性范围内。观察发现,大花茄的蓝紫色比鸳鸯茉莉深,经检测,大花茄各开花阶段的pH值也均高于鸳鸯茉莉。
有研究表明,糖分积累有利于花色苷合成,如富士苹果果皮的花色苷含量、着色度与果肉还原糖、可溶性糖含量呈显著正相关[16],北玫葡萄果实中可溶性总糖含量与总花色苷含量也呈正相关[17],但也有研究结果相反,如苹果套袋处理后,果实糖含量降低,果实着色却加深[18]。本试验中,花蕾初期到花蕾末期,鸳鸯茉莉与大花茄的可溶性糖含量均上升,花色苷含量也快速合成并积累,2种物质含量变化趋势一致。进入初花期后,2种植物的花色苷含量一直呈下降趋势,而可溶性糖含量仍在增加,直至盛花期达到峰值。相关分析发现,花色苷含量与可溶性糖含量无明显相关性。
鸳鸯茉莉与大花茄开花进程中可溶性蛋白含量变化趋势一致,均呈先上升后下降的趋势,但二者峰值出现的时间不同,分别于盛花期和花蕾末期达到峰值。相关分析表明,鸳鸯茉莉中,可溶性蛋白含量与类黄酮含量显著相关,与类胡萝卜素和花色苷含量均无显著相关性;而大花茄中可溶性蛋白含量与类黄酮、类胡萝卜素和花色苷含量均极显著相关。可见,可溶性蛋白对2种植物花色的影响作用不一致。
PAL与CHI都是类黄酮合成的关键酶。关于花色苷合成与PAL 的关系,BAR-AKIVA 等[19]研究认为,花色苷合成与PAL 活性呈正相关,而LISTER等[20]认为,PAL 活性的上升并没有伴随花色苷的合成。本试验中,随花期的推进,大花茄花瓣中PAL与CHI 活性都表现为先升高后下降,在花蕾末期活性最高,开花后PAL 与CHI 活性呈下降趋势,花色苷与类黄酮含量也在花蕾末期最高,开花后下降,可见PAL、CHI活性变化与花色苷、类黄酮含量的变化一致。相关性分析表明,大花茄PAL、CHI活性与花色苷、类黄酮含量均呈极显著正相关。鸳鸯茉莉花瓣中花色苷和类黄酮含量与PAL 活性相关性均不显著,但与CHI 活性显著相关。因此,2种植物的CHI活性变化与花色苷、类黄酮含量变化趋势一致,呈先升高后下降趋势,花蕾末期最高,随后开始下降。可见,蕾期是鸳鸯茉莉与大花茄花色苷和类黄酮合成、积累的关键时期。
3.2 鸳鸯茉莉与大花茄开花进程中花色变化的原因
花色苷的数量效应对花色的表达影响显著。通常,当花瓣中花色苷含量较低时花的颜色较浅,红色花系通常表达成粉红色;当花色苷含量增加时,花色也逐渐加深,粉红色会加深着色,表现为红色花。贺窑青等[21]对红花玉兰花瓣的研究表明,花色苷含量增加与花瓣着色加深具有一致的变化趋势。陈晓林[22]对红花檵木的研究表明,花色苷含量的急剧下降是叶片呈现绿色的关键因素。
本研究中,根据相关性分析可知,鸳鸯茉莉开花进程中各色度值指标与花色苷含量均呈极显著相关关系,与类黄酮含量相关关系不显著。大花茄开花进程中各色度值指标(除色相角h外)与花色苷含量呈极显著相关关系,与类黄酮含量也呈极显著相关,表明鸳鸯茉莉花瓣呈色主要由花色苷含量控制,该结论与陈小红等[5]、李敏等[6]对鸳鸯茉莉花瓣主要呈色色素的研究结果一致。而大花茄花瓣呈色则由花色苷与类黄酮含量共同控制。
李敏等[6]、BAR-AKIVA 等[19]研究发现,鸳鸯茉莉中主要含有飞燕草素、矮牵牛素和锦葵素。本研究在鸳鸯茉莉花瓣中仅检测出矮牵牛素,没有发现锦葵素和飞燕草素,且氯化矮牵牛素(b4)、主要组分b5 和总花色苷含量均随花朵开放进程表现为先上升后下降,于花蕾末期达到峰值而于末花期达到最低值。因此,推测鸳鸯茉莉花色的变化是花色苷含量下降所致。在蕾期合成积累的花色苷随着花朵开放,在阳光的强烈照射下,稳定性受到影响,部分花色苷可能发生了降解,导致花色变白。
大花茄花瓣中检测出氯化矢车菊素(a2)和氯化矮牵牛素(a3),但开花各阶段a2 占比都很小,总花色苷含量变化趋势与鸳鸯茉莉一致,随着花朵开放进程表现为先上升后下降,于花蕾末期达到峰值而末花期达到最低值。花蕾初期、花蕾末期、初花期、盛花期、盛花末期、末花期,主要组分a3 在总花色苷中的占比分别为32.54%、48.89%、41.46%、28.87%、44.60%、48.56%,主要组分a5 在总花色苷中的占比分别为61.02%、41.10%、44.19%、55.82%、39.13%、33.23%,二者的比例处于动态变化中。因此,推测大花茄花色的变化除了与总花色苷含量下降有关外,还与花色苷组分比例变化有关。
3.3 鸳鸯茉莉与大花茄蓝紫色程度差异的原因
鸳鸯茉莉与大花茄花瓣中均检测出氯化矮牵牛素,这可能是2种植物花瓣呈蓝紫色的原因。但蓝紫色程度存在差异,鸳鸯茉莉b*的最小值(花蕾末期)为-46.19,大花茄b*的最小值(初花期)为-51.51,表明大花茄蓝紫色程度远高于鸳鸯茉莉。在2种植物不同开花阶段花瓣检测出的6种花色苷中有4种组分相同,仅有2种组分不同(大花茄中的a2 和a4、鸳鸯茉莉中的b1 和b3),这些不同的组分在总花色苷中占比很小。因此,推测二者蓝紫色深浅差异的原因可能与花色苷组分关系不大,而与花色苷含量密切相关。虽然总体上大花茄的总花色苷含量和类黄酮含量均低于鸳鸯茉莉,但由于各开花阶段(除花蕾初期外)大花茄中氯化矮牵牛素含量远高于鸳鸯茉莉,而矮牵牛素是飞燕草素甲基化形成的,因此大花茄的蓝紫色表现得更为明显。另外,对大花茄在紫外全波长扫描时发现,420 nm 波长处有特征吸收峰,说明花瓣中可能存在酰化花色苷,而鸳鸯茉莉在此处未检测到吸收峰。花色苷的酰化可以导致花色苷的蓝移,所以酰化花色苷的存在可能是导致大花茄花瓣蓝色度高于鸳鸯茉莉的另一个原因。
通过对鸳鸯茉莉与大花茄开花进程中相关生理生化指标和花色苷的定性与定量分析发现,蕾期是2种植物花色苷和类黄酮合成、积累的关键时期;鸳鸯茉莉花色主要与花色苷含量有关,花色的变化是花色苷含量下降所致,在蕾期合成积累的花色苷随着花朵开放,在阳光的强烈照射下,稳定性受到影响,部分花色苷发生降解,导致花色变白;而大花茄花色由花色苷与类黄酮含量共同控制,花色的变化除与总花色苷含量下降有关外,还与花色苷组分比例变化有关。2种植物花瓣中均检出氯化矮牵牛素,这可能是其花瓣呈蓝紫色的原因,但由于各开花阶段大花茄中的氯化矮牵牛素含量远高于鸳鸯茉莉,且大花茄中可能存在可以让花色苷蓝移的酰化花色苷,从而导致二者的蓝紫色程度存在差异,大花茄花瓣的蓝色度高于鸳鸯茉莉。

