2021年妊娠期糖尿病相关诊疗指南解读
杨志芬,王春洋
(河北医科大学第四医院产科,河北 石家庄 050035)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期最常见的并发症之一,发病率逐渐上升,是全球性的健康和公共卫生问题。GDM的发病涉及遗传、环境等,影响妊娠结局,血糖控制不良导致自然流产、巨大儿、新生儿低血糖等发生风险增加。通过饮食、运动等干预措施可以有效控制血糖,改善母儿结局。对于肥胖者,孕前及孕期体重管理对母儿结局有益。随着对GDM研究的不断深入,各权威指南均对GDM临床诊疗进行了更新,但围绕GDM诊断和治疗诸多细节的争论仍在继续。因此,本文拟对国内外文献及美国糖尿病协会(American Diabetes Association, ADA)更新的2021版妊娠期糖尿病诊疗标准[1],国际妇产科联合会(International Federation of Gynecology and Obstetrics, FIGO)更新的2020版妊娠期肥胖指南[2],美国妇产科学会(American College of Obstetricians and Gynecologists, ACOG)更新的2018版GDM诊疗标准[3]中有关肥胖及GDM妇女生活方式干预、血糖及体重管理等关键点进行解读,并对其中有争议的问题进行探讨,为改善GDM患者血糖筛查及管理提供参考,促进GDM患者孕期规范化管理,降低GDM患者发生妊娠不良结局的风险。
1 诊断流程概述
1.1孕前管理 2018年ACOG发布的GDM指南[3]和2020年FIGO妊娠期肥胖指南[2]均指出,对于超重和肥胖妇女或有其他糖尿病危险因素(GDM病史)妇女,建议做好孕前咨询,于早期妊娠阶段进行糖尿病筛查,最好是在产前检查时[3]。2021年ADA建议计划怀孕的超重或肥胖或有糖尿病危险因素的女性,应考虑进行糖尿病前期和(或)2型糖尿病的检测(C类证据),也可于妊娠前通过ADA指南推荐的糖尿病风险测试表进行筛查,有助于早期识别患病风险,及时给予干预措施[4]。进行孕前咨询时,应对肥胖的具体风险进行咨询,包括怀孕和生活方式的干预、预防和治疗肥胖(包括介绍营养科专家参与治疗团队),注重营养、糖尿病教育和糖尿病筛查。对于孕前糖尿病者的专门咨询应包括向母亲解释与母儿相关的妊娠风险以及降低风险的方式,包括血糖目标设置、生活方式管理和医学营养治疗。
1.2妊娠早期糖尿病筛查 2021年ADA[4]建议:①初次产前就诊时应筛查既往存在的糖尿病;②通过规范的诊断标准对有糖尿病危险因素的妇女进行测试,以筛查糖尿病。在怀孕的前3个月测量孕妇空腹血糖和负荷后血糖的价值已得到广泛证实[5]。2021年ADA[4]以及2018年ACOG[3]指南均指出用于诊断非妊娠妇女的2型糖尿病筛查方案,即口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)检测空腹血糖、随后的75 g葡萄糖负荷和2 h血浆葡萄糖测量,可用于早期妊娠糖尿病筛查。2016年国际糖尿病和妊娠研究协会指出75 g OGTT的GDM诊断标准以及两步法中使用的GDM筛查和诊断标准并非来自妊娠早期的数据,因此,通过空腹血糖或OGTT值诊断妊娠早期GDM并非基于证据,需要进一步的检查。
尽管有充分的证据表明早期识别2型糖尿病对孕妇有好处,但早期识别GDM的潜在益处仍未得到证实,并且难以量化。目前尚无关于怀孕初期是否进行糖尿病检查或如何进行糖尿病检查的共识。筛查的形式是有争议的,对于不同的筛查工具,没有统一的妊娠期特定阈值。测量孕妇空腹血糖和负荷后血糖仍有以下局限性[5]:①由于缺乏适当的诊断阈值和经过验证的干预手段,没有足够的证据支持使用空腹血糖对所有患者进行GDM的早期筛查;②尚未对负荷后血糖筛查的诊断阈值和测试策略进行早期妊娠验证,且基于早期葡萄糖负荷结果的干预措施尚未显示出对孕妇或新生儿的益处。
无症状成年人的糖尿病或糖尿病前期筛查标准[4]如下:(1)考虑对所有超重或肥胖并且具有以下一个或多个其他风险因素的女性进行筛查:①一级亲属患糖尿病;②高风险种族(例如非洲裔美国人、拉丁裔、美洲原住民、亚裔美国人,太平洋岛民);③心血管疾病病史;④曾分娩体重≥4 000 g的婴儿;⑤既往妊娠期糖尿病;⑥高血压[收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg]或正在接受降压治疗;⑦高密度脂蛋白胆固醇≤35 mg/dL(0.90 mmol/L)和(或)三酰甘油≥250 mg/dL(2.82 mmol/L)或正在接受降脂治疗;⑧多囊卵巢综合征;⑨缺乏运动;⑩其他与胰岛素抵抗相关的临床疾病(例如严重肥胖、黑棘皮病)。(2)糖尿病前期患者(糖化血红蛋白≥5.7%(39 mmol/mol),空腹血糖受损或糖耐量受损)应每年进行筛查。(3)被诊断患有GDM的女性至少应每3年进行一次筛查。
2021年ADA糖尿病指南[4]指出具有GDM高危因素者,早期糖化血红蛋白水平较高,如≥6.0%(42 mmol/mol)可预测妊娠期糖尿病,针对血红蛋白水平较高的女性可以提供咨询、并在妊娠早期提供适当的饮食和生活方式调整建议;但其敏感度比OGTT方法低,因此不适合单独使用筛查GDM。Amylidi等[6]研究显示,由于妊娠早期血糖筛查阴性者,中晚期继续发展为GDM的妇女比例很高,所以即使早期筛查结果为阴性,仍建议在妊娠24~28周时再次进行GDM筛查。
1.3妊娠中期糖尿病筛查 2021年ADA糖尿病指南[4]建议以前未发现糖尿病的孕妇在妊娠24~28周时应进行妊娠糖尿病测试(A类证据)。目前各权威指南推荐使用基于血糖水平的实验室筛查测试对所有孕妇进行GDM筛查,通常在妊娠24~28周进行。在美国GDM测试常用的两步法基于首先用50 g口服葡萄糖溶液给药,然后进行1 h静脉葡萄糖测定。1 h葡萄糖筛查阈值从130 mg/dL(7.2 mmol/L)至140 mg/dL(7.8 mmol/L)不等,多项研究报道了不同阈值的应用。但是,没有试验证明某种临界值是否比其他临界值更有效。尽管已建议标准化筛查阈值,但有关改善妊娠结局以筛査妊娠糖尿病的理想阈值的数据证据仍不充分,缺乏明确的证据支持某个临界值优于另一临界值。因此,机构工作人员可以通过考虑GDM患病率等因素,选择130 mg/dL(7.2 mmol/L)至140 mg/dL(7.8 mmol/L)中的某值作为实际工作中统一的阈值。血糖水平达到或超过该机构筛查阈值的女性则需要进行100 g、3 h的诊断性OGTT。GDM最常见于3 hOGTT有两个或两个以上异常值的女性[7]。2010年国际糖尿病和妊娠研究协会确定妊娠中晚期采取一次75 g、2 h的OGTT筛查糖尿病,并在达到或超过任何单一阈值时确定GDM的诊断:空腹血糖及服糖后1 h、2 h分别为92 mg/dL(5.1 mmol/L)、180 mg/dL(10.0 mmol/L)、153 mg/dL(8.5 mmol/L)[8],该筛查方法沿用至今,并且各指南均推荐此方法作为GDM的首要筛查措施。
2 血糖监测
2018年ACOG[7]推荐患有GDM的妇女一旦开始营养治疗(饮食咨询),就需要监测血糖水平以确认已建立血糖控制。但是,没有足够的证据来确定GDM妇女的最佳血糖监测频率。根据现有数据,一般建议每天监测四次血糖:空腹一次,每次主餐后一次。平均空腹血糖值可用于控制孕妇的糖尿病,因为它们可预测女性后代中新生儿脂肪量的增加[8]。 新生儿脂肪量已被证明与儿童肥胖和糖尿病的发展有关[9]。GDM患者和孕前糖尿患者均推荐空腹和餐后自我血糖监测,以达到最佳血糖水平。在使用胰岛素泵或基础注射疗法时,也建议进行餐前检查,以便可以调整餐前速效胰岛素剂量。
2021年ADA[1]推荐空腹或餐前血糖值在95 mg/dL(5.3 mmol/L)以下,1 h餐后血糖值在140 mg/dL(7.8 mmol/L)以下,在2 h餐后血糖值在120 mg/dL(6.7 mmol/L)以下(B类证据),2018年ACOG[7]也是同样推荐。并建议进行多学科合作(如营养科、内分泌科、产科)调控血糖,通常,每周都会对上述血糖值进行检查;但是,血糖监测时,若异常血糖出现频率较高,建议增加血糖监测频率;如果血糖稳定,波动于正常范围,则可以减少血糖监测频率[7]。一旦GDM患者通过饮食可以很好地控制血糖水平,则可以根据孕龄、依从性来调整血糖检测的频率。
由于红细胞周期增大,正常妊娠妇女的糖化血红蛋白略低于正常非妊娠者。2021年ADA[1]推荐:如果可以控制不出现明显低血糖的情况下,则孕妇的糖化血红蛋白目标可以控制为6%(42 mmol/mol),但如果有必要,可以将目标放宽至7%(53 mmol/mol)(B类证据);考虑到怀孕期间红细胞动力学的改变以及血糖参数的生理变化,可能需要比平常更频繁地监测糖化血红蛋白水平(例如,每月一次)。由于糖化血红蛋白代表了葡萄糖的综合指标,可能无法发现餐后高血糖症,因此,尽管糖化血红蛋白可能有监测作用,但应在血糖自我监测的前提下,用作妊娠期血糖监测的辅助措施。
2021年ADA[1]推荐:① 除了餐前和餐后自我血糖监测外,连续血糖监测有助于孕期糖尿病者实现糖化血红蛋白的控制目标(B类证据);② 连续血糖监测指标可以用作辅助手段,不应替代餐前和餐后自我血糖监测,以实现最佳餐前和餐后血糖控制指标(E类证据)。将智能手机应用程序应用到GDM孕妇的常规护理中,可以实现动态监测,加强体重管理,从而改善孕妇的血糖控制和新生儿综合结局[10]。
3 妊娠期体重控制目标
WHO根据孕前体重指数(body mass index,BMI)将体重分为:体重过轻(BMI<18.5)、体重正常(BMI 18.5~24.9)、超重(BMI 25.0~29.9)、肥胖(BMI≥30.0),肥胖又分为三级,一级:BMI 30.0~34.9;二级:BMI 35.0~39.9;三级:BMI ≥40.0[11]。肥胖被认为是一种全身性炎症,可能会影响胰岛素抵抗、2型糖尿病和高血压等疾病[12]。孕妇BMI增加被认为是母儿健康的重要预测指标,包括但不限于不良的新生儿神经发育性疾病风险增加,导致各种程度的认知障碍、发育迟缓、语言能力受损以及脑瘫[13]。妊娠期肥胖对母亲的风险包括心脏代谢疾病(妊娠期糖尿病,妊娠期高血压疾病)、败血症、静脉血栓栓塞、死产、早产、巨大儿和阻塞性睡眠呼吸暂停;对胎儿的风险包括先天畸形或不良出生结局(包括婴儿死亡)[14-16]。英国皇家协会妊娠期肥胖指南指出:妊娠期间减肥可以降低妊娠期死胎、高血压和巨大儿发病风险[17]。
FIGO妊娠期肥胖指南[2]建议所有孕妇在第一次产前检查时都应测量身高、体重,计算BMI,并将数据记录在病历中;所有BMI≥30的孕妇均应在妊娠早期筛查糖尿病;早期发现和治疗妊娠期并发症有助于减轻对母儿不良的近远期影响。
孕期体重增加(gestational weight gain,GWG)定义为首次产检时孕妇自述的孕前体重与分娩前最后一次体重记录的差值。GWG控制目标参考2009年美国医学研究所(Institute of Medicine,IOM)制定的指南,根据不同孕前BMI推荐不同GWG控制范围:体重过轻组为12.5~18.0 kg,体重正常组为11.5~16.0 kg,超重组为7.0~11.5 kg,肥胖组为5.0~9.0 kg[18]。已有证据表明GWG超过IOM指南所推荐的体重增加范围会增加许多妊娠并发症的风险,包括巨大儿和剖宫产[19],这在一定意义上强调了GWG监测的重要性。孕早期中到高强度生活方式干预,降低了孕早期GWG,有更好的母儿结局[20]。妊娠期生活方式的干预(包括饮食和运动建议以及行为改变支持)有助于减少妊娠期体重的过度增加、巨大儿发生率[21-23]。对于体重正常、超重或肥胖妊娠者,饮食干预可以有效实现适当的孕期增重,辅以锻炼效果更佳[24]。
4 生活方式干预
2021年ADA指南[1]推荐生活方式的改变是妊娠糖尿病管理的重要组成部分,通过调整生活方式可以实现大多数妊娠期糖尿病妇女的血糖管理目标(A类证据)。Koivusalo等[25]研究发现,生活方式干预可能会降低GDM的风险,尤其是在妊娠中期或中期开始干预时。因此,一旦诊断GDM,即应根据BMI制定详细的医学营养治疗、锻炼和体重管理计划。医学营养治疗的目标是达到正常的血糖水平,预防酮症,同时提供足够的体重增加并促进胎儿的正常发育。临床医师应基于以下三种主要营养成分为孕妇提供建议:①热量分配;②碳水化合物摄入量;③热量分布。
2018年ACOG提出的GDM诊疗标准[7]指出,由于摄入总能量中若碳水化合物达到50%~60%会导致体重增加过多和出院后血糖升高,建议将碳水化合物限制在总能量的33%~40%之间,剩余能量分别为蛋白质(20%)和脂肪(40%)。还建议除三餐外,每日可增加2~3次加餐,有助于分配碳水化合物的摄入并减少餐后血糖波动。2021年ADA 指南[1]推荐饮食计划应基于营养评估和膳食参考摄入的指导,所有孕妇能量摄入的推荐摄入量最少为175 g碳水化合物,最少71 g蛋白质,28 g纤维,并且碳水化合物的种类和数量会影响血糖水平,单一碳水化合物容易导致餐后高血糖,因此建议多种碳水化合物混合食用。
增加膳食纤维摄入量对健康有益,建议GDM孕妇每日膳食纤维摄入量为10~14 g/1 000 kcal。每日盐摄入量限制为6 g,每日钠摄入量不超过2 000 mg。GDM患者容易缺乏维生素B、维生素C、维生素D、铬、锌、硒、镁、铁、锰和其他微量营养素,可以根据营养评估结果进行补充。专业人士应根据患者的代谢目标和个人喜好(例如风俗、文化、宗教、健康观念、经济状况等)设计个体化的饮食结构[26]。
2015年Miquel-Kergoat等[27]研究显示,长时间咀嚼或增加口腔接触可能通过减少与饱腹感相关的肠道激素反应而减少饥饿感和食物摄入,基于此,建议孕妇入口食物咀嚼25~40次。2019年Seino等[28]研究表明,进餐顺序可以改善血糖情况,建议进餐时,首先吃富含膳食纤维的菜肴,然后是蛋白质和脂肪类,最后是碳水化合物类,这种有序饮食可显著改善GDM患者的餐后葡萄糖偏移、胃排空和胰岛素分泌。
对未怀孕的糖尿病成年人,运动(尤其是体重训练)会增加肌肉质量,并提高组织对胰岛素的敏感性。2020年ACOG[29]提出应当鼓励无合并症的妊娠妇女在妊娠前、妊娠期间和妊娠后进行有氧运动和力量训练,可以降低孕期患糖尿病的风险。而患有GDM的超重或肥胖妇女,运动也可以控制体重增加并改善血糖控制情况。因此,ADA建议为GDM患者制定个体化锻炼计划,每周至少5 d进行30 min或每周最少150 min的中等强度有氧运动[1]。每次进餐后步行10~15 min这样简单的运动可以改善血糖控制[30],因此提倡GDM患者坚持餐后步行。
2020年ACOG[29]提出孕妇可以进行安全运动包括:步行、固定式骑行、有氧运动、跳舞、抵抗运动(可通过重物、松紧带等进行)、伸展运动、水疗或水中有氧运动。同时指出,当出现以下警告信号时,应该停止运动:阴道出血、腹痛、出现规律子宫收缩、羊水流出、运动前呼吸困难、头晕、头痛、胸痛、肌肉无力影响平衡、小腿疼痛或肿胀。此外,ACOG还提出了孕期安全有效的运动方案(表1)。
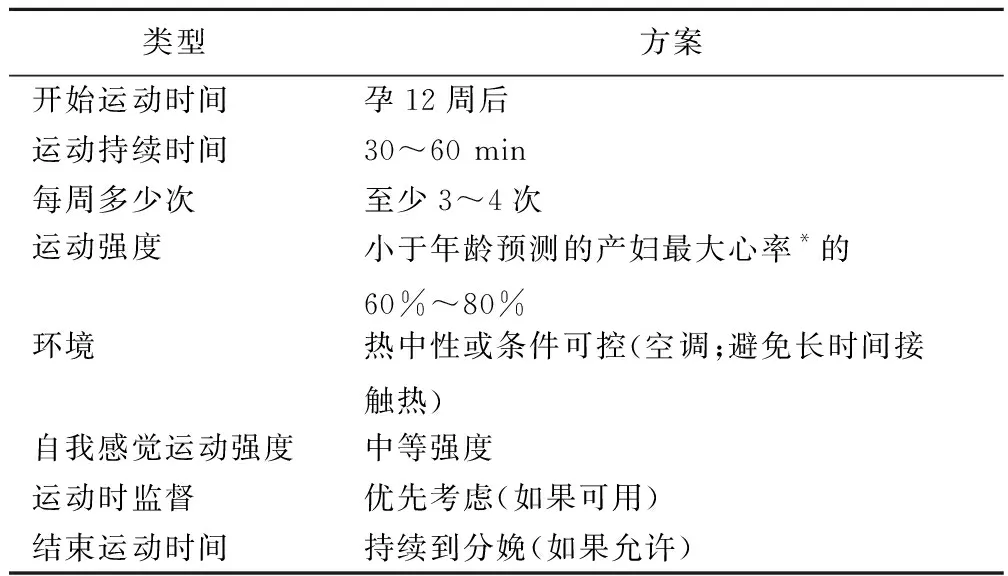
表1 孕期安全有效的运动方案[29]
5 产后血糖、体重及避孕管理
5.1产后血糖管理 2021年ADA指南[1]表明产后胰岛素抵抗会立即急剧下降,因此产后应监测血糖并调整胰岛素用量。GDM的糖耐量不佳现象在分娩后通常会缓解,但多达三分之一的妇女在产后筛查时会患有糖尿病或葡萄糖代谢受损。ADA[1]推荐:① 有妊娠糖尿病史的妇女应每1~3年进行一次筛查,以检查是否患有2型糖尿病或前驱糖尿病(B类证据)。② 使用75 g口服葡萄糖耐量试验和临床上使用的非妊娠诊断标准,对产后4~12周有GDM史的妇女进行筛查(B类证据),以鉴定是否患有糖尿病、空腹血糖水平受损或葡萄糖耐量受损。③ 有妊娠糖尿病史的妇女被发现患有前驱糖尿病病史,应加强生活方式干预和(或)二甲双胍预防糖尿病(A类证据)。④ 产后保健应包括社会心理评估和自我保健支持(E类证据)。
5.2产后体重管理 适当的生活方式干预(适度的体育锻炼和体重管理)不仅可以控制体重,还可以延迟或阻止糖耐量异常患者发展为2型糖尿病。产后体重管理,特别是在妊娠后的第一年,可能会影响妇女的长期体重状况和体重增加,影响她们在随后妊娠期间的BMI[31]。妊娠间或产后体重增加与随后妊娠中不良妊娠结局的风险增加相关[32]。对于产后肥胖的女性,无论妊娠期增重多少,都应在有指征和适当情况下鼓励减肥,并根据女性的具体情况提出建议和干预措施[33]。2021年ACOG[29]提出只要分娩方式安全且不存在医疗或外科手术并发症,就可以尽快恢复锻炼。有些妇女能够在分娩后的几天内恢复体育锻炼,产后立即开始骨盆自由操。
5.3产后避孕 肥胖女性妊娠的风险较正常女性高,预防意外妊娠对肥胖女性更重要。Britton等[34]研究表明,与体重正常或过轻的糖尿病女性相比,肥胖女性通常较少采取有效避孕措施。因此,对于患糖尿病的肥胖女性,避孕是工作的重点,应根据肥胖女性的BMI为其提供产后最恰当的避孕方式咨询。2021年ADA[1]推荐:① 与所有有生殖能力的糖尿病妇女讨论并实施避孕计划(A类证据)。② 有妊娠糖尿病史的妇女下次妊娠前应筛查糖尿病并重视孕前护理,以识别和治疗高血糖症并预防先天性畸形。
6 总结与展望
已有的研究结论提示,GDM是妊娠期常见的合并症之一,随着肥胖的全球流行,患病率也呈上升趋势,已成为严重的全球性的健康和公共卫生问题。目前各指南推荐妊娠前、妊娠期、产后肥胖均应积极科学管理体重,控制孕期体重增加,对预防GDM有着积极的影响,尤其注重孕前和孕早期的体重管理,可以明显改善近远期的母婴健康。一旦诊断GDM,应立即制定并实施个体化的医学营养治疗计划。对GDM产妇还应建立完善的产后随访跟踪系统,包括定期血糖及体重监测,还要关注产后有效避孕措施,预防肥胖女性意外妊娠,提高产妇远期生活质量。对妊娠期糖尿病疾病与母体远期疾病机制的研究、患者的追踪与管理,以及具备高危因素患者的筛查、预防和干预,都将是未来母胎医学发展中以及采取多学科团队协作、共同探索过程中的关键点。

