2021年高考化学全国甲、乙卷分析
王洪升
2021年全国卷理综化学试题保持了一贯的命题思路和命题风格,基本遵循“立足基础、稳中求变、突出能力、锐意求新”的命题指导思想。本文以全国理综化学甲卷和乙卷展开综合分析,赏析高考原味真题,品味高考专家命题思想,以期对同学们2022年的复习备考有所启发。
高考真题是备考的最好依据,因此建议2022届的考生以上表汇总的知识点作为自己复习的重点,逐一查漏补缺,构建完整的知识网络。
二、亮点扫描
(一)甲卷亮点扫描
1.选择题
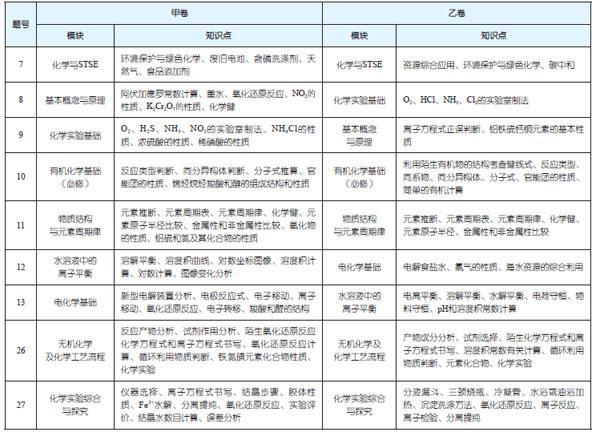
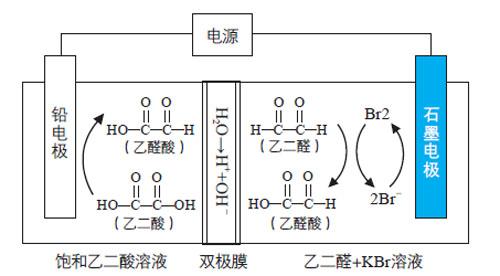
【例1】(第13题)乙醛酸是一种重要的化工中间体,可采用如下图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场的作用下分别向两极迁移。下列说法正确的是( )
A. KBr在上述电化学合成过程中只起电解质的作用
B.阳极上的反应式为:+2H++2e-→ +H2O
C.制得2 mol乙醛酸,理论上外电路迁移了1 mol电子
D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
【解析】石墨电极上发生2Br--2e-=Br2 ,所以石墨电极为阳极,则铅电极为阴极。陰极上发生反应为: HOOC-COOH + 2e-+2H+ =HOOC-CHO +H2O。
双极膜中H+移向左边的饱和乙二酸溶液,OH-移向右边的乙二醛和KBr溶液,溶液中发生的反应为:OHC-CHO + Br2 + 2OH- = HOOC-CHO + 2Br-+ H2O。
A项,KBr在上述电化学合成中首先变成Br2,然后再反应变为Br-,所以参与了反应,故A项错误;B项,所写电极方程式应为阴极反应,故B项错误;C项,转移2 mol电子左边产生1 mol乙醛酸,右边也产生1 mol乙醛酸,故制得2 mol乙醛酸,理论上外电路迁移了2 mol电子,故C项错误;D项,双极膜中H+移向铅电极,OH-移向石墨电极,故D项正确。
【亮点】此题情境新颖,考查知识点全面而深入。此题不仅考查了电解核心知识如阴阳极判断、电极反应式书写、电子守恒等,同时还考查了有机反应、氧化还原反应等知识。
2.必做非选择题
【例2】(第26题)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题。
(1)I2的一种制备方法如下图所示:
①加入铁粉进行转化反应的离子方程式为 。
②通入氯气的过程中,若氧化产物只有一种,反应的化学方程式为 。若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为 ;当n(Cl2)/n(FeI2)>1.5后,I2的收率会降低,原因是。
(2)以NaIO3为原料制备I2的方法:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2 。上述制备I2的总反应的离子方程式为 。
(3)KI溶液和CuSO4溶液混合,可生成CuI沉淀和I2,若生成1 mol I2,消耗KI至少为 mol。I2在KI溶液中可发生反应:I-+I2 I3-。实验室中使用过量的KI与CuSO4溶液反应后过滤。滤液经过蒸馏,可制得高纯碘。反应中加入过量的KI的原因是。
【解析】此题为工艺流程题,但着重考查陌生方程式书写能力。
第1问①考查AgI固体与Fe反应的方程式,分析可知有Ag沉淀生成,I-未发生变化,所以Fe变为Fe2+。离子方程式为Fe+2AgI=2Ag+Fe2++2I-。第1问②考查氧化还原反应中量的关系问题,FeI2溶液中Fe2+和I-均具有还原性,但I-还原性强于Fe2+,所以当氧化产物只有一种时,则Cl2仅将I-氧化为I2,所以离子方程式为2I-+Cl2=I2 + 2Cl-,故化学方程式为FeI2 +Cl2=FeCl2 +I2 。当反应物用量比为n(Cl2)/n(FeI2)=1.5,则Cl2刚好将溶液中Fe2+和I-全部氧化,所以氧化产物为I2和FeCl3 ,化学反应方程式为3Cl2 +2FeI2 = 2FeCl3 + I2 。当n(Cl2)/n(FeI2)>1.5,则过量的Cl2会继续将生成的I2氧化,从而导致I2的收率降低。
第2问,由题意可知,NaIO3先和NaHSO3反应,生成碘化物为NaI,然后NaI再和NaIO3反应生成I2,所以先写出分步反应: IO3-+ 3HSO3-= I-+3SO42-+ 3H+、5I-+IO3-+ 6H+=3I2+3H2O,消掉I-即可得总反应。
第3问,由题意可知:4KI+2CuSO4=2CuI+I2+2K2SO4,所以生成1mol I2消耗KI至少4 mol。最后一问更为新颖,由题意可知生成的I2可以继续反应生成KI3,所以加入过量的KI可以让平衡正向移动,防止I2析出而损耗。
【亮点】此题以碘及其化合物为载体,以氧化还原反应知识为核心来考查实验化学知识,深度考查了考生的陌生方程式书写能力及与量有关方程式分析能力。
(二)乙卷亮点扫描
1.选择题
【例3】(第13题)HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)-c(H+)为线性关系,如下图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1
B. MA的溶度积度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D. HA的电离常数Ka(HA)≈2.0×10-4
【解析】A项,由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=mol/L=× 10-4mol/L<3.0×10-4mol/L,故A项正确;
B项,由图可知,c(H+)=0时,可看作溶液中有较高浓度的OH-,此时A-的水解极大地被抑制,溶液中c(M+)=c(A-),则Ksp(MA)=c(M+)×c(A-)=c2(M+)=5.0×10-8,故B项正确;
C项,设调节pH所用的酸为HnX,则结合电荷守恒可知c(M+)+c(H+)=c(A-)+c(OH-)+nc(Xn-),题给等式右边缺阴离子部分nc(Xn-),故C项错误;
D项,Ka(HA)=,当c(A-)=c(HA)时,由物料守恒知c(A-)+c(HA)=c(M+),则c(A-)=,Ksp(MA)= c(M+)×c(A-)==5.0×10-8,则c2(M+)=10×10-8, 对应图得此时溶液中c(H+)=2.0×10-4mol/L,Ka(HA)== c(H+)≈2.0×10-4,故D项正确。
【亮点】此题在弱电解质电离平衡与沉淀溶解平衡体系中考查问题解决能力,情境新颖,略有难度。此题不可以用HA调节pH,因为随着HA加入,c(H+)增大,c(A-)也增大,而c(M+)必减小,不会出现如图所示c2(M+)与c(H+)所成的正比关系。
2.必做非选择题
【例4】(第28题节选)(1)略(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8 ℃时平衡常数K′p=1.0×104 Pa2,在一硬质玻璃烧瓶中加入过量BaPrCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8 ℃,碘蒸气初始压强为20.0 kPa。376.8 ℃平衡时,测得烧瓶中压强为32.5 kPa,则pICl= kPa,反应2ICl(g)= Cl2(g)+I2(g)的平衡常数K= (列出计算式即可)。
(3)McMorris测定和计算了在136~180 ℃范围内下列反应的平衡常数Kp。
2NO(g)+2ICl(g)2NOCl(g)+I2(g) Kp1
2NOCl(g)2NO(g)+Cl2(g) Kp2
得到lg KP1~和lg KP2~均为线性关系,如下图所示:
① 由图可知,NOCl分解为NO和Cl2反应的ΔH 0(填“大于”或“小于”)。
② 反应2ICl(g)=Cl2(g)+I2(g)的K= (用Kp1、Kp2表示),该反应的ΔH 0(填“大于”或“小于”),写出推理过程 。
【解析】(1)略(2)由题意可知376.8 ℃时玻璃烧瓶中发生两个反应:BaPtCl6(s)BaCl2(s)+Pt(s)+2Cl2(g)、Cl2(g)+I2(g)2ICl(g)。BaPtCl6(s)BaCl2(s)+Pt(s)+2Cl2(g)的平衡常数K′p=1.0×104Pa2,则平衡时p2(Cl2)=1.0×104Pa2,平衡时p(Cl2)=100 Pa,设到达平衡时I2(g)的分压减小p kPa,则:
于376.8 ℃平衡时,测得烧瓶中压强为32.5kPa,则0.1+20.0+p=32.5(kPa),解得p=12.4kPa,则平衡时pICl= 2pkPa= 2×12.4 kPa=24.8 kPa,I2(g)的分压为(20.0-p)kPa= (20×103-12.4×103)Pa,pICl=24.8 kPa=24.8×103 Pa,p(Cl2)= 0.1 kPa=100 Pa,因此反应2ICl(g)=Cl2(g)+I2(g)的平衡常数K=。
(3)①结合图可知,温度越高,越小,lg KP2越大,即KP2越大,说明升高温度平衡2NOCl(g)2NO(g)+ Cl2(g)正向移动,则NOCl分解为NO和Cl2反应的ΔH 大于0;
② Ⅰ. 2NO(g)+1ICl(g)2NOCl(g)+I2(g) KP1
Ⅱ. 2NOCl(g)2NO(g)+Cl2(g) KP2
Ⅰ+Ⅱ得2ICl(g)=Cl2(g)+I2(g),則2ICl(g)=Cl2(g)+ I2(g)的K=KP1·KP2,该反应的ΔH大于0。推理过程如下:设T′>T,即<,由图可知,lg Kp2(T′)-lg Kp2(T)> |lg Kp2(T′)-lg Kp1(T)|=lg Kp1(T)-lg Kp1(T′),则lg [Kp2(T′)·Kp1(T′)]> lg [Kp2(T)·Kp1(T)],即K(T′)>K(T),因此该反应正反应为吸热反应,即ΔH大于0。
【亮点】此题通过数形结合来考查化学反应速率与平衡知识。第2问着重考查两关联反应数学计算问题,第3问着重考查图形信息提取能力及计算转化能力。
【注意】第3问难度比较大,推导过程也很复杂,但由于高考是非常规范的考试,题中作图也是非常规范的,所以可以基于图中数据进行读数从而解决问题,这也是一种取巧的方法。
如:×103=2.3时,尽可能准确读出lg Kp1=-1.0,lg Kp2=-2.95,从而得出Kp1=10-1,Kp2=10-2.95,故K=Kp1×Kp2= 10-3.95;×103=2.4时,尽可能准确读出lg Kp1=-0.7,lg Kp2= -3.35,从而得出Kp1=10-0.7,Kp2=10-3.35,故K=Kp1×Kp2=10-4.05;通过比较数据可知,T增大时,K值减小,所以该反应为吸热反应。
3.选做题
【例5】(第36题节选)卤沙唑仑W是一种抗失眠药物,在医药工业中的一种合成方法如下(部分反应略)。
请写出该反应的化学方程式。
【解析】此空答案有两种写法,很值得同学们逐一研究。
由C物质到D物质反应可以推出X为,反应过程为X中1号碳上H取代了C物质中的Cl,从而发生取代反应生成D物质。由于从C物质到D物质需要两步,第一步为ZnCl2参与,第二步为NaOH参与,而此题又要求写出化学方程式,所以难度有些大。
第一种情况反应过程为:
第二种情况反应过程为:
第一种情况按理说称不上反应,但试卷给出参考答案中包含第一种情况,所以值得同学们注意;第二种情况则需要考虑氨基作为碱性基团,其会与HCl发生化学反应。
【亮点】C物质到D物质反应需要两步完成,书写化学方程式时需要分步来书写。切记有机物中氨基为碱性基团,会与酸发生反应。
三、备考要点全知道
在高考中,同学们在做选择题时需要快、准,切忌“小题大做”;做选考题时,由于每个考生的选择不尽相同,因此笔者在此不做过多总结。下面,笔者仅对三类必做非选择题进行归纳总结。
1.综合实验题的复习策略:夯实实验基础,提高实验探究能力
通过近年阅卷可看出部分考生实验基础知识欠缺,思维不严密。具体表现有现象描述不完整、装置选择与顺序错误、设计实验方案可操作性不强等。
备考策略:①通过归纳对比掌握常见仪器的用途,熟练掌握化学实验基本操作;②系统梳理实验知识,如实验基本操作、气体的制备、物质的检验等;③分析挖掘教材实验的内涵,找出高考实验题之根,做到既知其然,又知其所以然;④结合案例提高实验的基本操作能力以及实验方案的设计和规范表述能力,尤其是方案设计可能成为今后的重点命题方向,考生需要针对该类题加以练习。
2.反应原理题的复习策略:提高对图表、图像信息的处理、分析和运用能力
部分考生对反应原理理解不到位,数学计算、分析问题、解答问题的能力欠缺。具体表现有将化学式写错、不会分析图像,以及画图错误、计算错误等。
备考策略:①以常见无机物及其应用为载体,进行概念和原理知识的复习,突出概念和原理知识的指导作用;②做好知识融合;③用化学思想方法贯穿概念、原理的复习。
3.工艺流程题的复习策略:注重基础,强化能力,力求创新
部分考生审题能力和工艺流程分析能力欠缺。具体表现有不会分析流程图或分析错误、方程式书写错误或書写不规范等,考生普遍在后几问得分较低。
备考策略:①完成由物质观到元素观的转变,用思想方法统领常见物质性质的复习;②突出概念原理知识(如物质分类、氧化还原反应、离子反应)对元素化合物知识复习的指导作用;③从化学反应原理和规律上认识化学反应;④按“知识点→知识主线→知识网”的方式来建构知识体系;⑤将物质性质的复习与实际生产、生活现象和社会问题联系起来;⑥注意增强创新意识和能力,运用化学思想方法分析陌生问题。近年高考常考查新情境下化学方程式的书写,这就需要考生具有类推迁移能力。

