艾美尔球虫对高原鼠兔个性与生理特征的影响
钟 亮,朱红娟,余义博,曲家鹏
(1.中国科学院西北高原生物研究所,青海 西宁 810008;2.中国科学院大学,北京 100049;3.青海省动物生态基因组学重点实验室,青海西宁 810008)
寄生是自然界中普遍存在的一种行为[1-3]。寄生虫寄生于宿主体内,依赖宿主进行营养繁殖,会对宿主造成一系列的伤害[4]。例如,肝片吸虫(Fasciola hepatica)感染会导致牛羊食欲减弱、精神萎靡等[5];大熊猫(Ailuropoda melanoleuca)感染西氏贝蛔虫(Baylisascaris transfuga)后,会出现胆道蛔虫和胃肠道梗阻,最终导致胆管、胰管和肠道破裂,引发腹膜炎甚至死亡[6];粗厚鳗居线虫(Anguillicola crassus)感染日本鳗鲡(Anguilla japonica)会严重损害鱼鳔的正常功能[7]。寄生虫感染还能直接或间接影响宿主的行为[8]和生理特征[9]。玉黍螺(Littorina littorea)被吸虫寄生后,大胆性降低[10];而弯鳍若花鳉(Poeciliopsis retropinna)被吸虫寄生后,大胆性无显著变化[11];刚地弓形虫(Toxoplasma gondii)感染会导致褐家鼠(Rattus norvegicus)探索性增强[12],但小鼠探索性减弱[13]。寄生虫感染导致驯鹿(Rangifer tarandus)粪便皮质醇浓度下降[14],但红疣猴(Colobus polykomos)皮质醇浓度升高[15]。因此,寄生虫对宿主行为和生理特征的影响存在物种间差异。
寄生虫操纵假说认为,许多寄生虫进化出了操纵宿主行为的能力,使宿主行为发生改变,以增加自身的存活率[16]或传播率[17-18]。某些寄生虫使中间宿主更容易受到捕食者(最终宿主)的攻击,如被毛虫寄生的蟋蟀(Gryllus bimaculatus)会主动跳进水里从而更易被捕食[19];刚地弓形虫感染可增强小鼠的活动性,使它们更容易遭到猫的捕食[13]。个性特征是指动物个体间的行为差异,包括大胆性(boldness)、探索性(exploration)、攻击性(aggressiveness)、活跃性(activity)和社会性(sociability)等[20]。寄生影响动物的个性特征,如与未被寄生的个体相比,被裂头绦虫(Schistocephalus solidus)寄生的三刺鱼(Gasterosteus aculeatus)活动性更强,被捕食率更高[21]。寄生虫对宿主行为的改变不一定均对宿主有害[22]。例如被褐飞虱(Apanteles euphydryidis)感染后,格斑堇蛱蝶(Euphydryas phaeton)的配偶定位效率明显提高,寄生虫存活率和传播率增大[23]。因此,寄生虫对宿主行为影响的差异性与寄生虫传播策略有关。
宿主可以通过激活免疫系统来抵抗寄生虫的攻击[24],并付出相应的代价[25]。当宿主免疫系统被激活后,其皮质醇水平降低[26]、生长缓慢、体重降低[27]、能量消耗增加[28]。宿主的总体能量代谢是有限的,免疫功能与生理活动(如生长、繁殖)所需能量之间存在着一种权衡[27-29]。目前,关于寄生是否会改变宿主能量平衡的研究甚少,尤其是以小哺乳动物为宿主的研究更加少见。
高原鼠兔(Ochotona curzoniae)隶属兔形目鼠兔科鼠兔属,是青藏高原特有的小哺乳动物,也是维持高原草甸生态系统的关键物种[30]。高原鼠兔在65日龄后为成体阶段,体重生长基本停止,65日龄雌性高原鼠兔平均体重为121.72 g,雄性高原鼠兔平均体重为119.00 g[31],进入冷季后,越冬动物多为成年个体[32]。高原鼠兔为昼行性动物,在7月−10月活动高峰期为08:00−11:00和16:00−18:00[33]。艾美尔球虫(Eimeria)作为高原鼠兔的主要寄生物,具有较强的专一性,寄生于宿主肠道,其生活史分为裂殖生殖、配子生殖以及孢子生殖3个阶段[34]。目前已有学者研究艾美尔球虫对高原鼠兔生理特征的影响,如有研究发现感染艾美尔球虫后,雌性高原鼠兔的妊娠率和胚胎重量显著降低[9,34],但关于艾美尔球虫对高原鼠兔行为的影响却鲜有报道。此外,高原鼠兔种群数量暴发是制约青藏高原草牧业健康发展的关键问题之一[35]。生物控制作为防治有害生物的方式之一,能够有效降低有害生物种群的数量。艾美尔球虫对宿主的种属特异性、可调节害鼠种群动态以及对害鼠具有致死性等生物学特征为将其开发成为害鼠生物控制剂提供可能[34]。基于此,本研究选择高原鼠兔为研究对象,研究艾美尔球虫对高原鼠兔个性与生理特征的影响,旨在阐明寄生虫对宿主产生的影响,并为进一步开发高原鼠兔的生物防治技术提供科学依据。
1 材料和方法
1.1 试验动物
2020年9月,在海北高寒草地生态系统研究站附近采用绳套法捕获30只健康、体重大于130 g 的高原鼠兔(成体)。带回实验室后单笼饲养于中国科学院西北高原生物研究所动物饲养房中450 mm×289 mm×180 mm 塑料笼内,笼内铺有木屑,提供足量的水和标准鼠饲料(来源于北京科澳协力饲料有限公司),定期清理粪尿和垫料,适应7 d 后开始试验,室温和光周期均为自然环境温度和光照。
1.2 感染试验
已有研究表明,艾美尔球虫的裂殖生殖主要破坏宿主肠道组织[36],当给高原鼠兔灌喂4×106个·mL−1艾美尔球虫时,第4天出现高原鼠兔死亡,第8天时高原鼠兔死亡率达到最大值[37]。将试验动物随机分为3组,每组10只,分别灌喂2×106个·mL−1艾美尔球虫卵囊悬浊液(G 组)、生理盐水(C组)、驱虫剂(Q组)(主要成份为磺胺氯吡嗪钠,比例按照0.001 2×高原鼠兔体重,再加生理盐水至1 mL)各1 mL。根据艾美尔球虫的致病性周期,将试验划分为4个阶段,即0、5、8和18 d,在这4个阶段分别测定高原鼠兔的个性和生理特征。
试验期间,为避免试验个体自身以及感染艾美尔球虫后排出的艾美尔球虫卵囊影响试验结果,每天换洗鼠笼,并用沸水烫洗。于每个试验阶段的前一天07:00,在每个鼠笼内放置50 g 饲料;在试验测定当天收集剩余饲料,计算食物摄入量,收集每个鼠笼内粪便4 g,用于测定激素含量和艾美尔球虫卵囊数。随后测定高原鼠兔的行为和生理参数,包括探索性、体重、粪便皮质醇浓度和静止代谢率。
1.3 艾美尔球虫卵囊数量测定
采用麦克马斯特法(McMaster’s method)计数粪便中艾美尔球虫卵囊数。取2 g 粪便,加20 mL饱和盐水混匀,经0.425和0.150 mm 滤筛过滤后,取1 mL 滤液,再加入9 mL 水,将稀释液充分混匀后,用毛细吸管吸出少量液体滴入麦克马斯特氏计数板的计数室内,置于显微镜台上,静置几分钟后,用低倍镜将两个计数室内的艾美尔球虫卵囊全部计数完,取平均值后换算成每克粪便中的艾美尔球虫卵囊数。
1.4 探索性测定
采用旷场试验测定高原鼠兔的探索性,考虑到高原鼠兔的活动节律,在08:00−11:00测定探索性。旷场由不透明的亚克力板组成,底部面积为50 cm×50 cm,将底部中心40 cm×40 cm 的区域记为中心区,中心区以外的区域记为边缘区。将待测个体轻轻放入旷场,使用摄像机记录个体3 min 内的行为,使用EthoVision IX 动物运动轨迹跟踪系统(Noldus Information Technology Co.Ltd.,Holland)分析高原鼠兔的各项行为,包括在中心区停留时间和穿越频次、在边缘区停留时间和穿越频率等。动物在旷场中心区停留时间和穿越中心次数,可以代表探索性[38]。
每次测定完毕后,使用75%的酒精擦拭旷场,清理残留的粪尿、毛发等,以免影响后续测定。
1.5 生理特征测定
1.5.1 食物摄入量和体重
食物摄入量的测定是在每个试验阶段的前一天,在清洗好的鼠笼内将50 g 鼠饲料放置于饲料盒中,24 h 后收集剩余饲料,放入烘干箱内去除水分后称重。使用电子称(精度0.01 g)称量高原鼠兔体重。
1.5.2 静止代谢率的测定
使用功能性运动测试携式动物呼吸代谢测量系统(Sable Systems International,Las Vegas, NV, USA)测量高原鼠兔的静止代谢率(resting metabolic rate,RMR)。试验开始时,将动物放入透明呼吸室中,呼吸室位于恒温箱内,根据高原鼠兔的热中性区在25~30℃范围内[39],可以维持最低基础或静止代谢率水平[40],将恒温箱温度设为27℃。每个通道的取样间隔设置为3 min,设置气泵进入呼吸室的空气流速为600 mL·min−1。1号呼吸室作为空白对照,另外3个呼吸室中放入高原鼠兔。适应30 min 后,开始测定代谢率。重复测量10次,共计2 h。根据公式[41]计算代谢率(metabolic rate,MR):
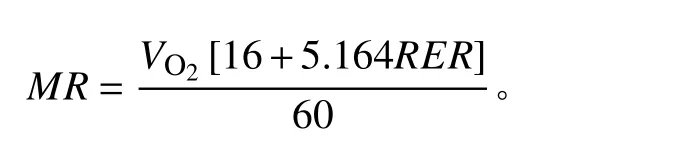
式中:MR为代谢率;RER(respiratory exchange ratio)为呼吸交换率,即CO2产生率(VCO2,mL·min−1)除以O2消耗率(VO2,mL·min−1)。选择每个个体10次测量结果中MR的最低值,作为其静止代谢率。
1.5.3 皮质醇激素
采用ELISA 酶联免疫法测定高原鼠兔粪便皮质醇含量,使用玻璃棒将粪便样品混匀,称取1 g粪便,加入9 mL 生理盐水,制备成浓度为10%的粪便匀浆,经离心机离心15 min,转速3000 r·min−1;离心结束取上清液1 mL,使用大鼠ELISA 检测试剂盒(广州徕智生物科技有限公司生产)测定样品中的皮质醇含量(同一份样品重复测量2次,取平均值)。检测灵敏度为1.0 ng·mL−1。板间和板内差异均为15%。
1.6 统计分析
对所有数据进行正态分布和方差齐性检验。采用Kruskal-Wallis秩和检验比较4个时间段、3个处理组之间艾美尔球虫卵囊数的差异。采用主成分分析法对探索性数据进行降维[42],得到与探索性相关的维度。采用lmerTest 程序包,通过混合线性效应模型分析艾美尔球虫与高原鼠兔个性、生理特征间的关系,分别将探索性、食物摄入量、体重、皮质醇浓度作为响应变量,将试验时间与不同处理作为固定效应,将个体差异作为随机效应;若处理效应显著,采用emmeans包进行简单效应分析,获得各组间差异性结果。试验结果以平均值 ± 标准误表示,P<0.05为差异显著,P<0.001为差异极显著。所有数据统计分析使用R 软件3.6.2 进行。
2 结果与分析
2.1 艾美尔球虫卵囊数量
艾美尔球虫卵囊数量变化结果表明,随着时间的变化,艾美尔球虫卵囊数量间有显著差异(F=3.337,P=0.006)(图1)。从第0天到第5天,艾美尔球虫卵囊数呈增长趋势,第5天后又逐渐下降。第0天、第8天和第18天,不同处理组间艾美尔球虫卵囊数量无显著差异(P>0.05);第5天,G 组艾美尔球虫卵囊数量显著高于C组和Q组(P< 0.05)。
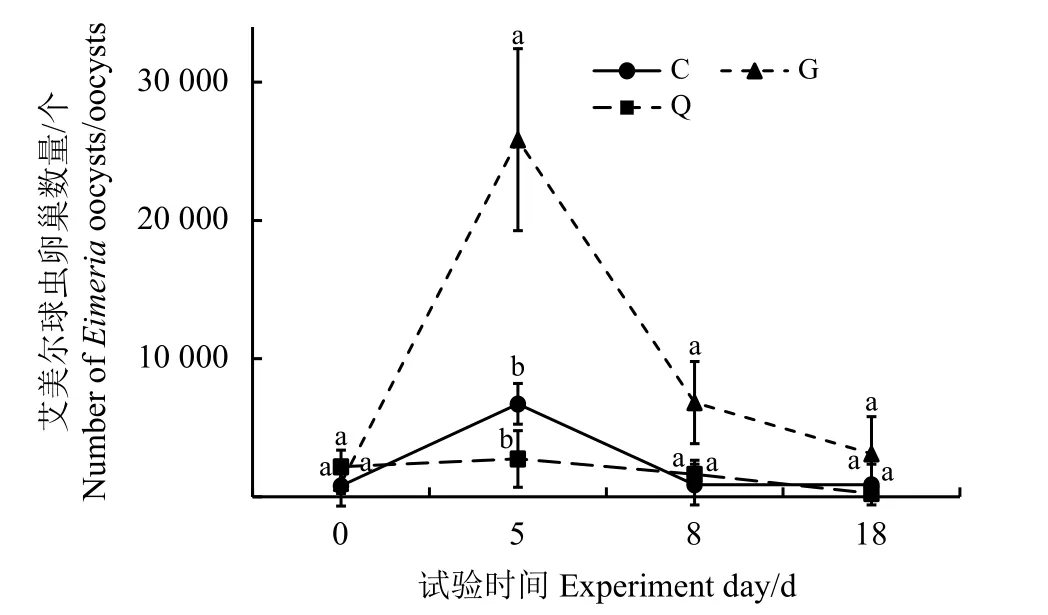
图1 艾美尔球虫卵囊数量比较Figure 1 Comparison of the number of Eimeria oocysts
2.2 生理特征
艾美尔球虫对高原鼠兔生理特征影响的结果表明,随着时间的变化,艾美尔球虫对高原鼠兔食物摄入量有显著影响(F=2.478,P= 0.0476)(图2)。第18天,G 组与C组高原鼠兔食物摄入量之间无显著差异(P>0.05),但均显著低于Q组(P<0.05)。艾美尔球虫对高原鼠兔的体重无显著影响(F=1.132,P=0.345),但对其粪便皮质醇浓度有显著影响(F=2.417,P= 0.0472)。第0天和第5天,3组高原鼠兔粪便皮质醇浓度间无显著差异(P>0.05);第8天,Q组和G 组高原鼠兔粪便皮质醇浓度间无显著差异(P>0.05),但均显著高于C组(P<0.05);第18天,C 组和G组高原鼠兔粪便皮质醇浓度间无显著差异(P>0.05),但均显著高于Q组(P<0.05)。艾美尔球虫对高原鼠兔的静止代谢率有显著影响(F=2.951,P=0.010 3)。从第0天到第8 天,3个处理组静止代谢率间无显著差异(P>0.05);第18天,G 组高原鼠兔静止代谢率显著低于C 组(P< 0.05)。

图2 不同处理组间高原鼠兔的各项生理指标比较Figure 2 Comparison of physiological traits of plateau pika in different treatment groups
2.3 个性特征
对高原鼠兔的探索性数据进行主成分分析,前两个主成分解释了80%的方差(表1),将第一主成分命名为探索性用于后续分析。
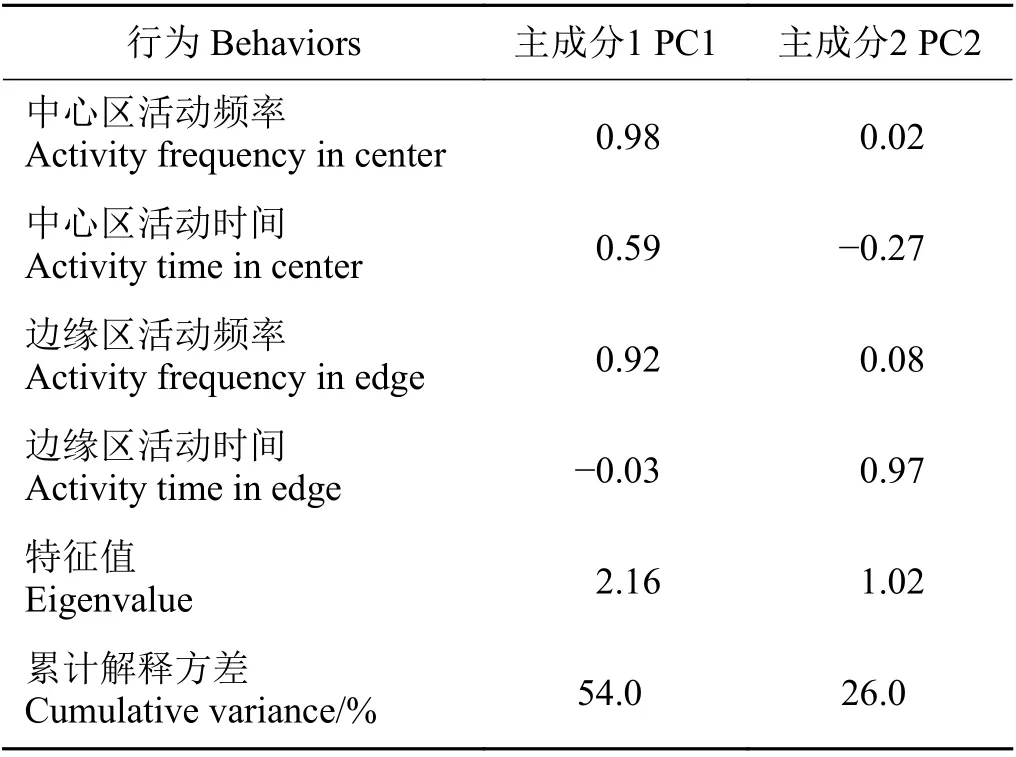
表1 4个高原鼠兔行为变量的主成分分析Table 1 Principal component analysis of measures of the four behaviors of plateau pika
艾美尔球虫对高原鼠兔探索行为影响的结果表明,随着时间的变化,艾美尔球虫对高原鼠兔的探索性有显著影响(F=2.251,P=0.044)(图3)。总体上看,从第0天到第5天,Q组和C组高原鼠兔探索性上升,之后逐渐下降;从第0天到第5天,G 组高原鼠兔探索性显著下降(P<0.05),并维持在相对较低的水平。第5天,G 组高原鼠兔探索性显著低于C组(P<0.05),而Q组和C组高原鼠兔探索性间无显著差异(P>0.05)。

图3 不同处理组间高原鼠兔探索性比较Figure 3 Comparison of plateau pika exploration in different groups
3 讨论与结论
本研究结果表明,3组艾美尔球虫卵囊数量间有显著差异,在第5天均达到最大值,灌喂艾美尔球虫组高原鼠兔排出的艾美尔球虫卵囊数显著高于对照组和驱虫组,这与边疆晖等[43]研究结果略有不同,其结果表明,灌喂艾美尔球虫卵囊后,第5天时,高原鼠兔成体才开始大量排艾美尔球虫卵囊。郑若愚等[44]认为感染艾美尔球虫后,动物排艾美尔球虫卵囊数与其年龄呈正相关关系,如与低龄个体相比,感染相同剂量艾美尔球虫的大龄兔可排出大量艾美尔球虫卵囊。本试验所用高原鼠兔均为成年个体,年龄较大,可能导致高原鼠兔排艾美尔球虫卵囊数峰值提前。
寄生虫会影响宿主的食物摄入量[45]。一般而言,感染寄生虫后,宿主的食物摄入量减少,反之亦然[46]。Arneberg 等[47]研究发现,试验去除寄生虫后,驯鹿食物摄入量显著增加,这与本研究中驱虫组高原鼠兔食物摄入量显著高于对照组的结果一致。动物感染寄生虫后其食物摄入量与现存寄生虫数量有关[46]。在自然环境中,艾美尔球虫作为高原鼠兔的主要肠道寄生物[43],高原鼠兔对其感染可能产生了一定的免疫力,灌喂较低剂量的寄生虫,使得灌喂艾美尔球虫组与对照组高原鼠兔食物摄入量间无显著差异。
本研究中,灌喂艾美尔球虫对高原鼠兔体重无显著影响,这可能是由于高原鼠兔长期进化,适应了艾美尔球虫的寄生。当寄生虫侵入宿主体内时,宿主可以通过激活免疫系统来抵御寄生虫的攻击[25]。艾美尔球虫属自限性感染[48],宿主的最优策略是将能量主要用于免疫防御[49]。在长期的寄生共存关系下,宿主体内已产生相应的抗体[50],当再次灌喂艾美尔球虫后,体内已有的抗体使得高原鼠兔不需要将过多能量用于免疫,因此高原鼠兔体重没有显著降低。Silva 等[51]研究表明,与未驱虫的母马相比,驱虫后的母马体重显著增加,而本研究中驱虫组高原鼠兔体重与对照组间无显著差异。驱虫对动物体重的影响与饲料中粗蛋白含量有关,当饲料中粗蛋白质含量<11%时,驱虫对动物体重没有影响;当饲料中粗蛋白质含量>19%时,驱虫后的动物体重显著增加[52]。本研究饲料中粗蛋白含量为14.45%,可能导致驱虫后的高原鼠兔体重没有显著增加。
寄生虫感染与宿主皮质醇含量具有一定的关联性[53]。如感染寄生虫后,沙锥齿蜥(Zootoca vivipara)、灵敏负鼠(Gracilinanus agilis)的皮质醇浓度更高[54-55]。糖皮质激素适应假说认为,皮质醇浓度增加会导致动物适应能力下降、存活率和繁殖成功率降低,更容易被寄生虫感染[56]。本研究结果表明,第8天时,与对照组相比,灌喂艾美尔球虫组高原鼠兔粪便皮质醇浓度显著高于对照组。寄生虫感染通过消耗宿主营养、增加与免疫反应相关的成本,导致皮质醇浓度上升[53]。在第5天时,灌喂艾美尔球虫组高原鼠兔排艾美尔球虫卵囊数显著高于对照组,而在第8天时,其皮质醇浓度显著高于对照组,这可能是由于动物对寄生虫产生的应激反应具有时滞性[57]。第8天,驱虫组高原鼠兔皮质醇浓度显著高于对照组。在寄生虫与宿主的协同进化过程中,二者相互适应、共存[58],某些寄生虫感染甚至还会降低宿主对疾病的易感性,增加宿主的生存率和寄生虫的传播率[59]。如马来布鲁丝虫(Brugia malayi)分泌的免疫调节分子能限制人肺部的嗜酸性粒细胞反应,减缓过敏性炎症[60]。艾美尔球虫作为高原鼠兔的主要寄生物,可能在某些方面对宿主有利,高原鼠兔艾美尔球虫卵囊数减少了39.33%,这可能会对高原鼠兔产生刺激,导致其皮质醇浓度增加,具体机制还需进一步研究。第18天时,驱虫组高原鼠兔皮质醇浓度显著低于对照组,这可能是由于驱虫后高原鼠兔体内的艾美尔球虫卵囊数减少,对宿主的刺激减弱,皮质醇浓度降低,符合糖皮质激素适应假说。
寄生虫感染后,宿主激活免疫系统抵抗寄生虫攻击的过程会消耗大量能量,导致体内能量平衡改变[61-63]。例如,感染跳蚤(Xenopsylla ramesis)的沙鼠(Gerbillus dasyurus)能量消耗增加[64];感染蠕形住肠线虫(Enterobius vermicularis)的地松鼠(Xerus inauris)静止代谢率降低[65]。能量分配模型认为动物具有稳定的能量收支平衡,总能量保持不变,某一方面能量消耗增加,其他方面能量消耗就会减少[66-67]。灌喂艾美尔球虫后,高原鼠兔用于免疫防御的能量增加,导致其静止代谢率显著低于对照组。
寄生虫操纵假说认为寄生虫感染可以影响宿主行为,例如囊尾蚴(Cysticercus cellulosae)聚集在雌海螺(Busycon canaliculatum)的足部会使宿主失去挖掘洞穴的能力,被捕食率是未被寄生海螺的5~7倍[68],有利于寄生虫传播[69]。动物的探索性与被捕食风险有关,探索性弱的动物被捕食风险较低[70]。灌喂艾美尔球虫后,高原鼠兔探索性显著下降,降低了被捕食的风险,提高了宿主的存活率,有利于艾美尔球虫的传播。艾美尔球虫在高原鼠兔种群内的传播率增加,能更有效地降低高原鼠兔种群的繁殖力,进而控制高原鼠兔种群数量。
综上所述,高原鼠兔感染艾美尔球虫后,其皮质醇浓度升高、静止代谢率下降、探索性减弱,降低了被捕食风险,从而增加了艾美尔球虫在高原鼠兔种群内的传播率,为应用艾美尔球虫作为潜在的高原鼠兔生物防治制剂以及控制高原鼠兔种群数量提供了新的依据。

