长链非编码RNA H19在肠黏膜屏障功能中的作用*
梁雪君 叶 蕾 汪芳裕
南方医科大学附属金陵医院消化内科(210002)
近年来随着高通量测序技术的不断发展和应用,发现大部分人类基因组(约93%)可进行转录,但小于2%的转录物编码蛋白质,而约75%的基因组转录为非编码RNA,包括小干扰RNA(siRNA)、微RNA(miRNA)、piwi相互作用RNA(piRNA)和长链非编码RNA(long noncoding RNA, lncRNA)[1]。LncRNA为长度大于200个核苷酸的非编码RNA,能调节多种细胞过程。LncRNA根据其与最近的蛋白质编码基因的拓扑关系进一步分为正义、反义、双向、内含子和基因间lncRNA。通常位于细胞核中的lncRNA参与基因转录和染色质修饰,而细胞质中的lncRNA通过与mRNA、miRNA或RBP直接相互作用来调节转录后过程。
H19基因是第一个被发现的印记基因,位于人染色体11p15.5区域。LncRNA H19由H19基因转录而来,通过不同的分子机制作用于特定的基因来发挥多种细胞功能,这一过程取决于发育和疾病状态的生物学和时空背景。H19在胚胎组织中大量表达,出生后在除骨骼肌和心脏外的其他组织中的表达均明显下降[2]。H19调控细胞功能的机制包括表观遗传调控、H19/miR-675轴、miRNA海绵以及通过结合RBP调控靶基因的表达。研究表明,H19在食管癌组织中高表达,可能通过抑制let-7介导食管癌细胞增殖和侵袭[3]。褪黑素通过H19/miR-675/USP10通路拮抗心脏祖细胞的早衰[4]。近年研究[5]发现lncRNA H19在促进胆管细胞增殖和胆汁淤积性肝损伤中起重要作用,其机制可能是通过增强S1PR2/SphK2通路的表达。同时H19作为let-7的分子海绵,可抑制let-7 miRNA的生物活性,导致let-7 miRNA靶向的HMGA2表达增加,从而促进胆管细胞的生长。由此可见,H19可调节多种细胞内过程,并在不同的组织和细胞间具有相对特异性。本文就lncRNA H19在肠道炎症和肠道癌症中的作用作一综述。
一、炎症状态下H19在肠黏膜屏障功能中的作用
肠黏膜屏障由机械屏障、化学屏障、免疫屏障和生物屏障共同构成,可阻止病原菌的侵袭,同时允许水和其他可溶性物质进入,在防止肠黏膜损伤方面起重要作用。肠道干细胞和扩增的祖细胞不断复制并驱动上皮细胞更新,而新分裂的细胞沿着隐窝绒毛轴向上迁移,分化成各种成熟的细胞类型包括杯状细胞、Paneth细胞、肠吸收细胞等。尽管肠道具有快速自我更新的功能,但创伤、局部缺血、炎症性肠病(IBD)、肠梗阻等疾病的发生均会引起肠黏膜屏障急性或慢性损伤,导致肠道炎症[6]。
Zou等[7]的研究发现miR-675表达上调会抑制肠道紧密连接蛋白ZO-1和E-cadherin的表达,破坏肠黏膜屏障,而人抗原R(human antigen R, HuR)蛋白过表达可阻止H19介导的miR-675上调,恢复ZO-1和E-cadherin表达,并防止过表达lncRNA H19引起的上皮细胞屏障功能障碍。同时,肠上皮细胞中HuR靶向缺失可促进miR-675的产生,并延缓肠屏障的恢复。故H19与HuR蛋白共同调控肠上皮屏障功能。H19高表达可抑制ZO-1和E-cadherin mRNA翻译并诱导两者mRNA的降解,进而促进肠黏膜屏障功能障碍。另一方面,HuR蛋白通过增加ZO-1和E-cadherin的表达,抑制H19对miR-675的加工并增强肠黏膜屏障功能。由此可见,H19/miR-675轴可通过HuR蛋白维持肠上皮内环境的平衡。但Geng等[8]的研究发现,lncRNA H19在维持肠黏膜屏障的稳态中发挥重要作用。LncRNA H19敲除小鼠并没有表现出明显的肠道缺陷,但在DSS诱导的急性结肠炎中,相对于正常小鼠,lncRNA H19敲除小鼠表现为肠上皮屏障功能完整性的延迟恢复。提示在正常生理状态下,lncRNA H19对肠道发育和稳态并不是必需的,但在炎症引发肠黏膜屏障破坏的情况下,lncRNA H19在肠上皮的再生和修复中发挥重要作用。多项研究结果证实lncRNA H19在肠黏膜屏障稳态中发挥重要作用,与肠道炎症的发生息息相关,具体见表1。
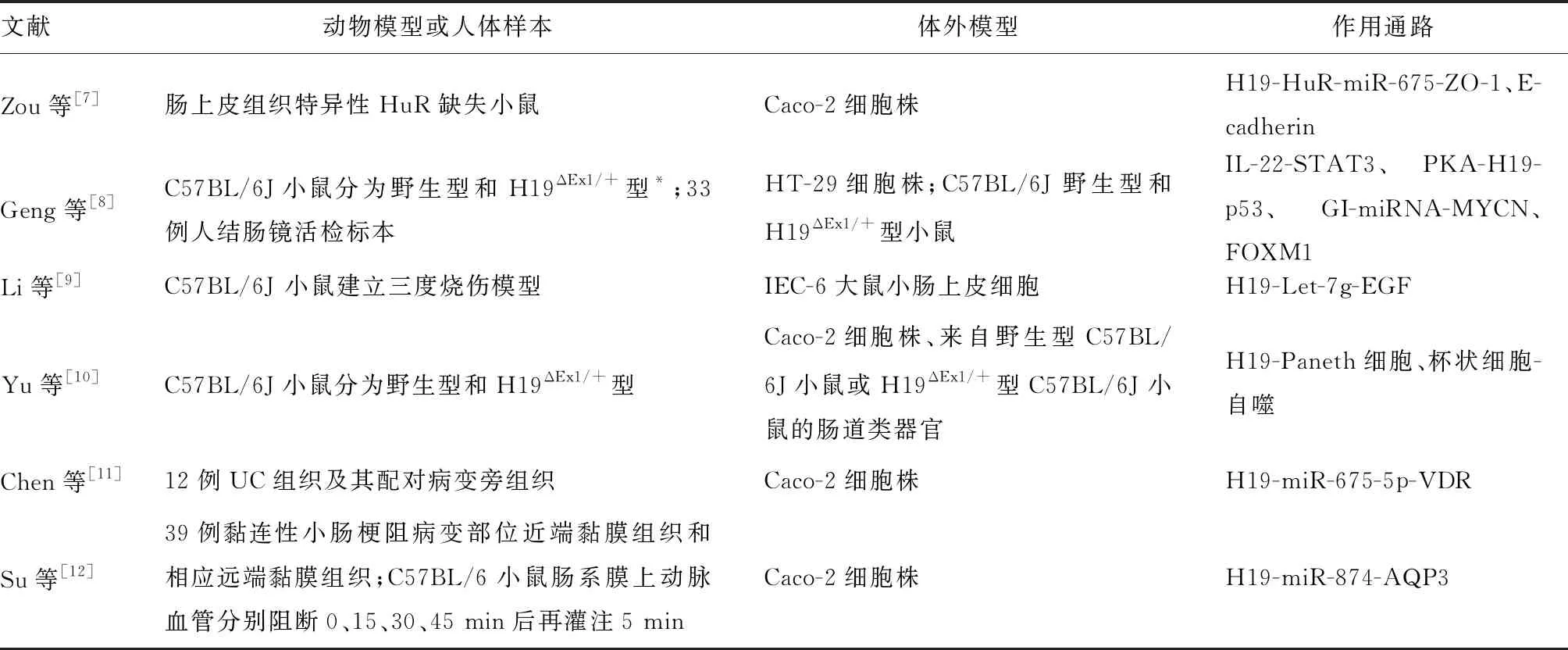
表1 H19在肠道炎症中作用的相关文献汇总
二、H19在结直肠癌肠黏膜屏障中的作用
结直肠癌是全世界发病率第三、死亡率第二的癌症,是中国人群第五大最常见的癌症死亡原因[13]。研究发现,脱氧胆酸通过破坏肠黏膜的物理屏障和功能屏障促进肠道肿瘤的发生[14]。Grivennikov等[15]认为由结直肠癌引发的遗传损伤引起屏障恶化,导致微生物产物侵入腺瘤,从而触发肿瘤引发的炎症,进而推动肿瘤生长。
上皮-间质转化(epithelial-mesenchymal transition, EMT)是一种进化上保守的程序,可将上皮细胞转化为进入间充质样细胞状态的细胞,这些细胞显示出独特的特征,包括干性、侵袭性、耐药性和在远处器官形成转移的能力,从而导致癌症转移和复发[16-17]。典型的EMT标志物包括细胞黏附分子如E-cadherin、Vimentin、N-cadherin、ITGA5和Fibronectin,以及转录因子如Snail1/2、ZEB1/2等[18]。
近期研究提出H19过表达触发hnRNPA2B1从细胞核移位至细胞质,增加hnRNPA2B1和Raf-1 mRNA之间的富集,从而稳定和上调Raf-1表达,导致ERK激活,诱导EMT,最终促进结直肠癌细胞的迁移和侵袭[19]。Ding等[20]的研究发现,H19低表达和miR-29b-3p高表达结直肠癌患者的总生存率(OS)远高于H19高表达和miR-29b-3p低表达者,其机制可能为H19通过抑制miR-29b-3p表达,下调下游PGRN,激活Wnt/β-catenin信号转导,导致结直肠癌内EMT的发生。Wang等[21]的研究发现,lncRNA H19可能是预测5-氟尿嘧啶(5-fluorouracil, 5-Fu)耐药的潜在生物学标志物,H19通过竞争性结合miR-194-5p的共同miRNA响应元件(MREs)来阻断miR-194-5p对SIRT1介导的自噬抑制,从而促进结直肠细胞对5-Fu的耐药。另有多项研究结果显示H19在介导结直肠癌转移和耐药方面起有关键作用,并强调了H19 作为结直肠癌预后预测因子和治疗靶点的潜力,具体见表2。
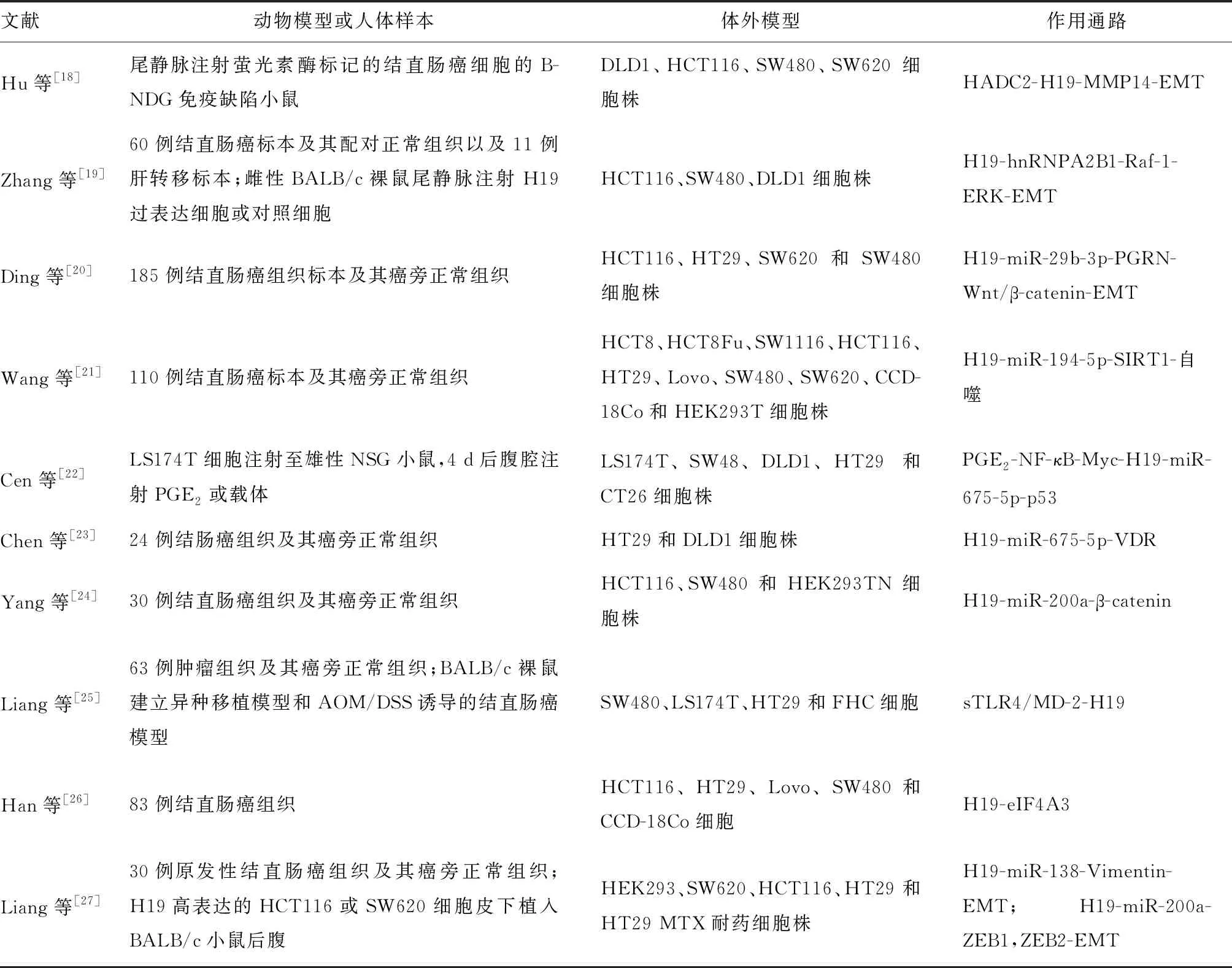
表2 H19在肠道癌症中作用的相关文献汇总
三、H19调节肠道炎癌相关信号通路
当肠道炎症不能达到完全缓解,持续的炎症会反复破坏黏膜上皮,上皮细胞的丢失必须通过上皮细胞增殖来弥补,这种修复机制的失控可能会导致癌症发生[28]。Dai等[29]的研究构建了AOM/DSS诱导的炎性结肠癌模型,AOM注射第2周可见严重结肠炎,第10周时发生结直肠肿瘤,且肠道组织中H19表达逐渐升高,差异有统计学意义。该研究同时对GDC数据库中220例结肠癌患者进行分析发现,H19表达上调与结肠癌患者的预后不良相关。由此可见,H19在肠道炎症和肠道癌症过程中具有重要作用,但其具体机制仍待进一步研究。
1. H19/维生素D受体(VDR):VDR是一种核受体,1,25-(OH)2D3对肠道屏障功能的影响主要通过VDR信号通
2. H19/p53:p53是大小为53 kDa(1 Da=0.992 1 u)的蛋白质,可响应DNA损伤、低氧、癌基因表达、营养剥夺、核糖体功能障碍等多种细胞信号,抑制细胞增殖[32]。肠上皮细胞凋亡增加和p53信号通路过度激活是IBD的标志[33]。研究发现,在炎症条件下,IL-22通过STAT3和蛋白激酶A(protein kinase A, PKA)介导的机制激活lncRNA H19表达,H19可减弱p53活性,促进肠上皮细胞的恢复[8]。Cen等[22]的研究发现,PGE2激活的NF-κB可促进Myc癌基因的转录,反过来,Myc作为转录因子可驱动H19上调,导致miR-675-5p表达增加,抑制结直肠癌细胞中TP53 mRNA翻译,促进癌细胞增殖和迁移(图2)。
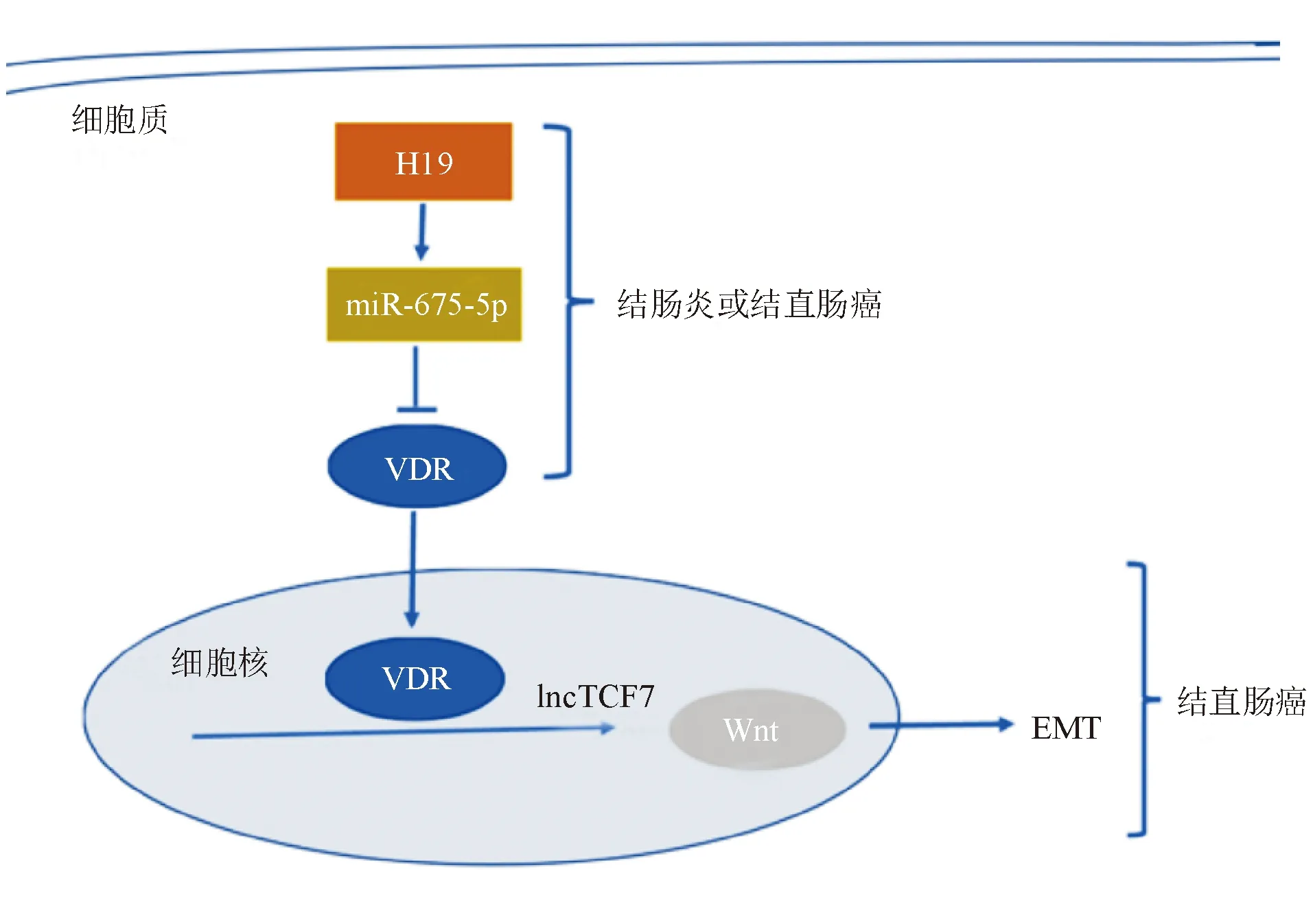
图1 H19/VDR在肠道中的通路图
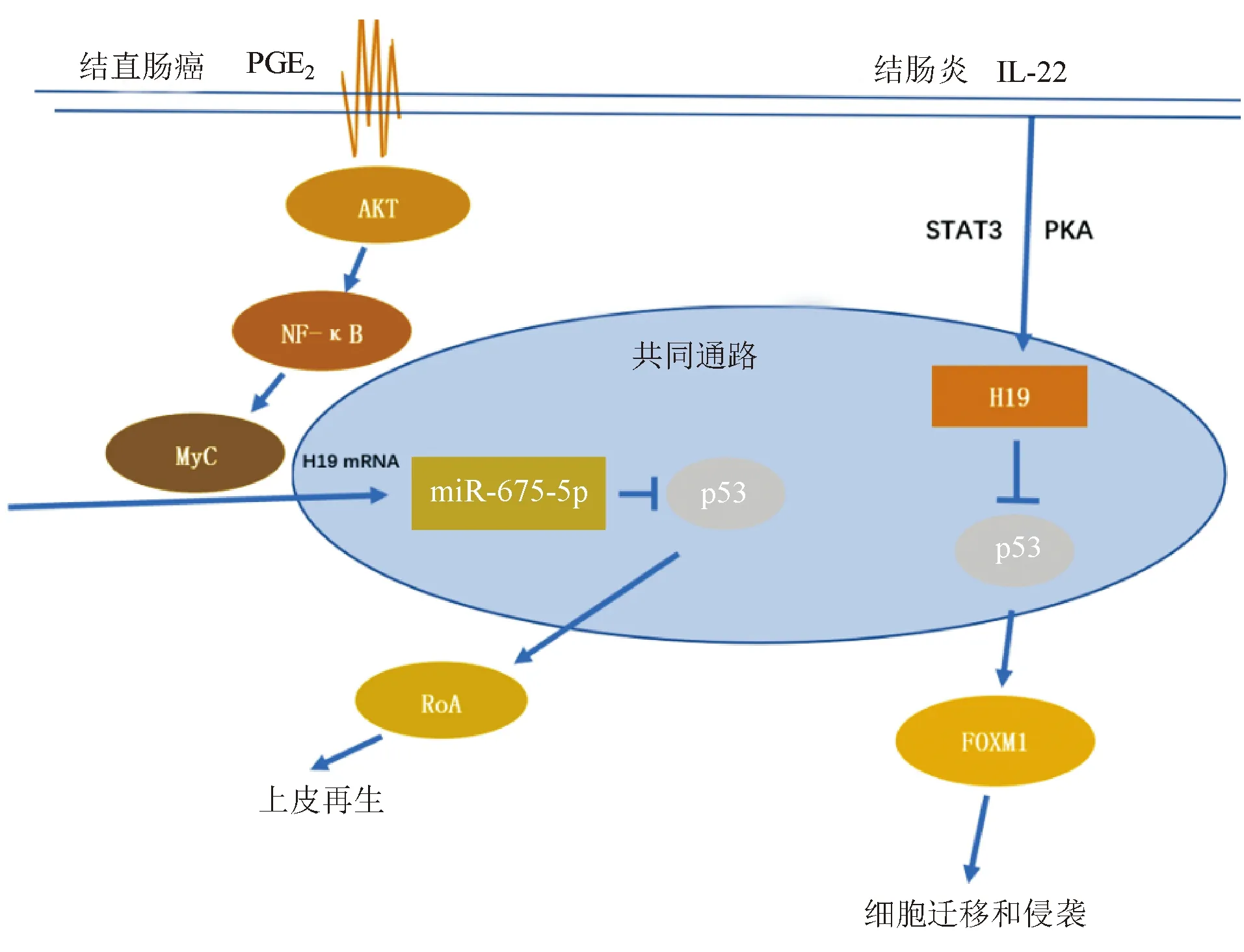
图2 H19/p53在肠道中的通路图
四、展望
大量研究表明,lncRNA是参与内环境稳态、再生反应和肿瘤发生所需的不同细胞过程的关键调节因子之一[1]。本文总结了H19在肠道炎症和结直肠癌状态下黏膜屏障功能中的调节作用、参与H19调节炎癌相关的信号通路,为探究H19在肠道炎癌转变中的作用提供思考方向。
尽管H19在肠道中的研究成果众多,但仍有许多要面对的问题:①H19对于慢性炎症(如IBD)机制研究模式单一:大多数关于肠道炎症的研究基于对机械屏障的研究,对于免疫屏障和生物屏障的研究甚少,而越来越多的研究认为典型慢性肠道炎症与免疫和肠道生物菌群有密不可分的联系。同时慢性肠道炎症模型的建立大多为DSS模型,与临床IBD发病机制仍有较大差距,并不是一个完美的模型。近期的基因敲除鼠模型如MUC2敲除小鼠,或许是可供研究的模型之一[34]。②实验与临床的差距:实验模型的建立多为小鼠,但小鼠与人之间有不可跨越的种属差异,研究成果能否用于人类肠道疾病的治疗仍有许多困难需要突破。③缺乏多种临床研究数据支持:尽管在病变组织和癌变患者血清中可检测到H19升高,但研究数据量少、随访时间短,缺乏高质量随机对照试验。
未来关于lncRNA H19的研究应更关注:①非侵入性检测手段的开发,H19在临床研究和基础研究中的结果充分显示了其作为非侵入性检测手段的潜力。②H19在炎癌转化中作用的进一步探索:炎症状态下H19对肠道黏膜屏障功能的作用主要体现在肠黏膜机械屏障破坏、促进肠黏膜上皮增殖和修复,这与H19促进EMT、结直肠癌的发生具有一定的一致性,且H19表达在肠道炎症、肠道癌症阶段呈进行性升高[29],因此H19很有可能在肠道炎癌转换中发挥重要作用,但其中的机制仍有待进一步研究。

