组蛋白乙酰化修饰在哮喘小鼠气道内黏蛋白5AC表达中的作用研究*
潘珍珍,徐诗尧,张健,王倩,项红霞,李羚
(无锡市儿童医院1.呼吸科,2.检验科,江苏 无锡214023)
支气管哮喘(以下简称哮喘)是儿童常见的一种慢性气道变应性疾病。有研究表明表观遗传修饰在环境和遗传因素之间起重要作用,其中与哮喘发病机制密切相关的是组蛋白乙酰化修饰[1]。这个可逆性过程分别由组蛋白乙酰基转移酶(histone acetyltransferase, HAT)和组蛋白去乙酰基酶(histone deacetylases,HDAC)介导[1]。
MUC5AC是一种主要的黏蛋白基因,在正常气道中有表达,且在哮喘和慢性阻塞性肺疾病患者气道中的表达升高。虽然气道黏蛋白分泌是气道防御的重要组成部分,但过多分泌也是气道阻塞的重要原因之一。曲古抑菌素A(Trichostatin A, TSA)作为HDAC 的抑制剂,在本课题组前期研究中发现对哮喘小鼠具有治疗作用,与既往研究结果类似[2-4]。具体机制与其可使T 细胞高度乙酰化,Th1/Th2 比值降低有关。亦有实验证实不同浓度的TSA 可影响MUC5AC 的表达[5],本课题组前期实验亦证实人MUC5AC基因的核心启动子区域位于-935 bp至+48 bp处,且P 300 可以下调MUC5AC基因的表达[6],说明HAT 活性与MUC5AC基因的转录调控密切相关。本文通过动物实验,进一步证实组蛋白乙酰化修饰在哮喘小鼠MUC5AC 表达中的重要作用。
1 材料与方法
1.1 复制哮喘小鼠模型
雄性、SPF 级、6~8周龄BALB/c 小鼠40只,平均体重为(20±2)g,无卵蛋白饮食。首日致敏予腹腔内注射10%卵蛋白和10%氢氧化铝混合液1 ml,第7 天重复1 次以加强致敏;2 周后将小鼠置于自制透明雾化吸入箱(20 cm×30 cm×40 cm),予1%OVA雾化吸入(雾化颗粒直径3~5 μm),1次/d,30 min/次,连续2 周。
1.2 TSA干预
末次激发后将哮喘小鼠随机分为3 组,哮喘组(13 只)、TSA治疗组(13只)和对照组(14只),哮喘组及对照组小鼠尾静脉注射生理盐水0.2 ml(1.0 mg/kg),TSA治疗组小鼠尾静脉注射TSA 0.2 ml(1.0 mg/kg)。
1.3 眼眶后静脉丛采血
TSA 干预小鼠48 h 后经腹腔注射100 g/L 乌拉坦0.5 ml 麻醉,眼眶后静脉丛采血后EDTA 抗凝管保存,全血上机检测血常规[包括白细胞计数(WBC)、中性粒细胞计数(NE)、血小板计数(PLT)及嗜酸性粒细胞计数(EOS)],血清用作酶联免疫吸附试验(ELISA)检测MUC5AC 水平(试剂盒购自英国Abcam 公司)。
1.4 肺组织标本采集及肺泡灌洗液收集
固定小鼠,暴露胸腔,切除左肺迅速放入-80℃冰箱用作HAT 活性分析,再用一钝头注射器插入气管,轻柔注入生理盐水0.3 ml 后回抽,共3 次,回收液即肺泡灌洗液(BALF)。再注入40 g/L 多聚甲醛0.3 ml 使右肺充盈,结扎气管后切除右肺浸入4%多聚甲醛中固定,用于脱水、石蜡包埋固定和切片,进行肺组织苏木精-伊红(HE)染色及免疫组织化学染色检测。
1.5 肺组织HE染色
中性甲醛固定组织脱水后予二甲苯透明,用石蜡包埋切片,脱蜡至水,行肺组织HE染色,中性树胶封固,光学显微镜下观察小鼠肺组织病理学变化。
1.6 BALF计数
按常规瑞特染色进行,通过显微镜观察至少200 个细胞,确定不同细胞数目。
1.7 免疫组织化学法检测肺组织内MUC5AC蛋白表达
采用过氧化物酶标记的链酶卵白素(SP)染色,即切片经常规脱蜡、梯度水化后,用3%过氧化氢孵育10 min 灭活内源性过氧化物酶,枸橼酸盐缓冲液微波修复抗原10 min,正常山羊血清封闭,滴加1∶100 的小鼠抗MUC5AC 单克隆抗体4℃过夜,滴加速用型生物素化二抗工作液,DAB 显色,苏木精对比染色、脱水、透明、中性树胶封固。用常规抗体稀释液0.01 MPBS 代替小鼠抗MUC5AC 单克隆抗体作为阴性对照;在高倍视野下,细胞质呈棕黄色着染为阳性细胞。蛋白表达强度用高清晰度彩色图像分析系统测定5 个视野的光密度(OD)值,取其平均值表示。
1.8 HAT和HDAC活性测定
取出小鼠左肺,采用Ficoll-Hypaque 密度分离法分离单个核细胞,后提取核蛋白,酶联免疫荧光法检测HAT 及HDAC 活性,试剂盒购自美国Bio Vision 公司。
1.9 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)或中位数和四分位数[M(P25,P75)]表示,比较用方差分析或H检验;进一步两两比较用LSD-t检验或χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 验证模型是否复制成功
哮喘模型的复制参考既往已发表的研究[7],通过症状和肺组织病理验证哮喘小鼠模型复制成功。
2.1.1 症状小鼠在致敏期间无任何阳性表现,首次激发期间小鼠即出现焦躁不安、呼吸急促等阳性反应,但并不明显,之后每次激发期间小鼠均表现出焦躁不安。
2.1.2 肺组织病理检查结果哮喘组小鼠肺组织HE染色可见气道周围水肿,炎症细胞浸润(见图1)。

图1 肺组织病理改变 (HE染色×400)
2.2 3组外周血常规比较
3 组小鼠的外周血嗜酸性粒细胞计数(EOS)比较,差异有统计学意义(P<0.05),进一步两两比较后可见哮喘组小鼠外周血EOS 较TSA 治疗组、对照组升高(P<0.05),TSA 治疗组与对照组比较,差异无统计学意义(P>0.05)。而3 组小鼠外周血白细胞计数(WBC)、中性粒细胞计数(NE)及血小板计数(PLT)比较,差异无统计学意义(P>0.05)。见表1。
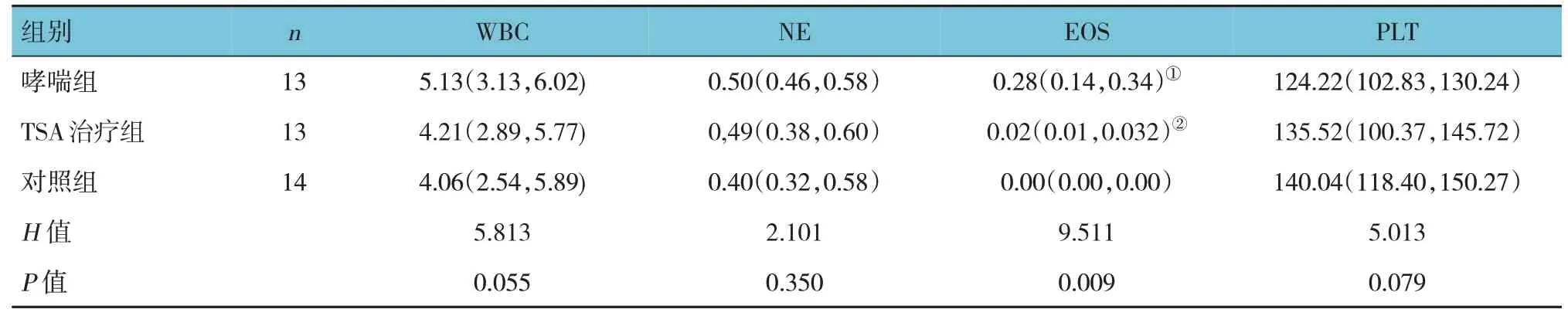
表1 3组外周血常规比较 [×109,M(P25,P75)]
2.3 3 组BALF 及EOS 计数的比较
3 组小鼠BALF 及EOS 计数差异均有统计学意义(P<0.05)。进一步两两比较,哮喘组BALF 和EOS 计数较TSA 治疗组及对照组升高(P<0.05),而TSA 治疗组与对照组比较,差异无统计学意义(P>0.05)。见表2。
表2 3组BALF及EOS计数比较 (×105,±s)
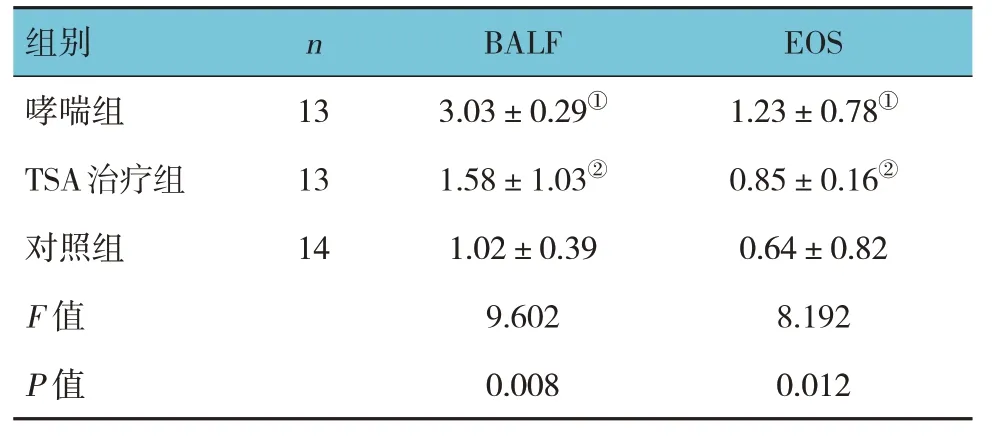
表2 3组BALF及EOS计数比较 (×105,±s)
注:①与对照组比较,P <0.05;②与哮喘组比较,P <0.05。
组别哮喘组TSA治疗组对照组F 值P 值n 13 13 14 BALF 3.03±0.29①1.58±1.03②1.02±0.39 9.602 0.008 EOS 1.23±0.78①0.85±0.16②0.64±0.82 8.192 0.012
2.4 3组小鼠HAT及HDAC活性比较
3 组小鼠的HAT 和HDAC 活性比较,差异均有统计学意义(P<0.05)。进一步两两比较,TSA 治疗组、对照组小鼠HAT、HDAC 活性较哮喘组降低(P<0.05),而TSA 治疗组与对照组HAT、HDAC 活性比较,差异无统计学意义(P>0.05)。新定义的变量HDAC/HAT 为两者间的比值,3 组比较,差异有统计学意义(P<0.05),进一步两两比较,TSA治疗组、对照组HDAC/HAT比值较哮喘组升高(P<0.05)。见表3。
表3 3组小鼠HAT和HDAC活性比较 (±s)
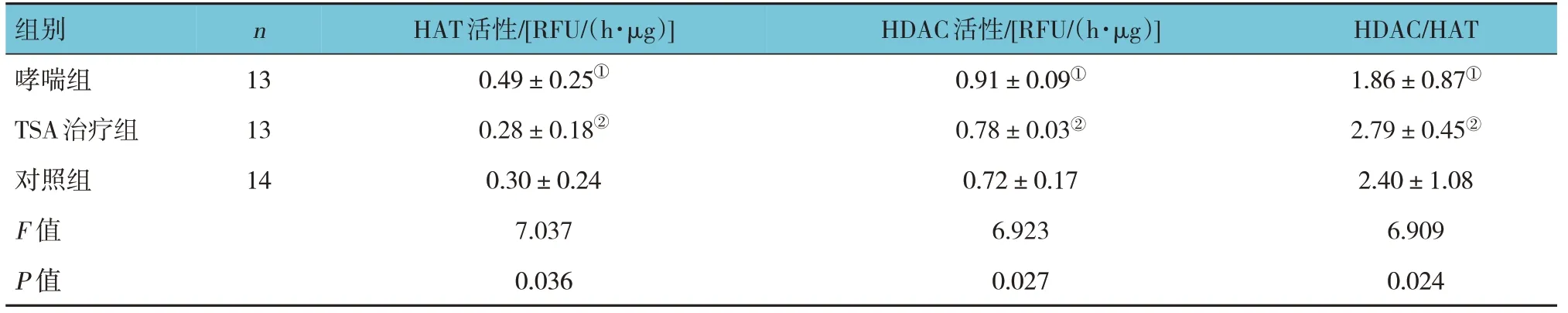
表3 3组小鼠HAT和HDAC活性比较 (±s)
注:①与对照组比较,P <0.05;②与哮喘组比较,P <0.05。
组别哮喘组TSA治疗组对照组F 值P 值n 13 13 14 HAT活性/[RFU/(h·μg)]0.49±0.25①0.28±0.18②0.30±0.24 7.037 0.036 HDAC活性/[RFU/(h·μg)]0.91±0.09①0.78±0.03②0.72±0.17 6.923 0.027 HDAC/HAT 1.86±0.87①2.79±0.45②2.40±1.08 6.909 0.024
2.5 3组小鼠血清MUC5AC表达水平比较
3 组小鼠血清MUC5AC 表达水平比较,差异有统计学意义(F=10.037,P=0.008)。进一步两两比较,TSA治疗组MUC5AC表达水平(0.38±0.072)、对照组小鼠MUC5AC 表达水平(0.29±0.130)均较哮喘组(0.74±0.015)低,而TSA 治疗组与对照组比较,差异无统计学意义(P>0.05)。
2.6 肺组织病理改变及免疫组织化学
2.6.1 肺组织HE 染色及气道AB-PAS 染色肺组织HE 染色可见哮喘组小鼠气道周围水肿,炎症细胞增多,而TSA 治疗后明显改善,但哮喘组的纤毛损伤不明显。气道AB-PAS 染色亦可见哮喘小鼠气道上皮炎症细胞浸润,TSA 治疗后炎症细胞浸润减少(见图2、3)。

图2 3组小鼠肺组织病理改变 (HE染色×400)
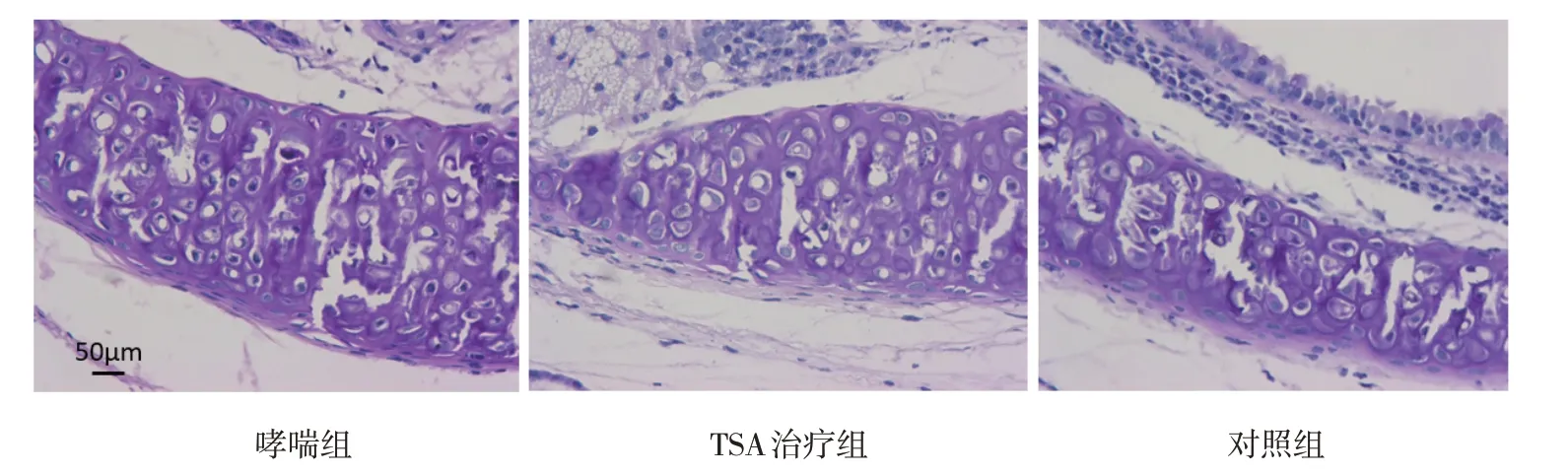
图3 3组小鼠气道组织病理改变 (AB-PAS染色×400)
2.6.2 肺组织免疫组织化学免疫组织化学结果示,哮喘组MUC5AC 蛋白阳性表达升高,而TSA 治疗组MUC5AC 蛋白阳性表达较哮喘组减 少(见 图4)。 定量分析可见3 组小鼠MUC5AC 抗体免疫组织化学OD 值差异有统计学意义(F=11.506,P=0.003)。进一步两两比较,哮喘组小鼠MUC5AC 抗体免疫组化OD 值(0.675±0.128)较对照组(0.099±0.134)升高(P<0.05),TSA 治疗组MUC5AC 抗体免疫组织化学OD 值(0.184±0.093)较哮喘组降低(P<0.05),TSA 治疗组与对照组比较,差异无统计学意义(P>0.05)。

图4 3组小鼠肺组织MUC5AC蛋白阳性表达 (免疫组织化学染色)
3 讨论
哮喘是儿童常见的一种气道变应原性慢性炎症性疾病,其影响到全球>10%的儿童,其发病机制目前尚不完全明确,其机制的研究有助于发现更好、更优的治疗手段。表观遗传学一直是比较热门话题,在环境和遗传因素之间起到重要作用,其中与哮喘发病机制密切相关的是组蛋白乙酰化修饰[1]。所谓组蛋白乙酰化修饰,即修饰多发生在H3/H4N-末端赖氨酸残基上致局部DNA 与组蛋白八聚体紧密缠绕被解开染色质构象发生改变,调控基因的转录组蛋白乙酰化通常促进基因的转录,与炎症基因诱导和细胞增殖有关。这个可逆性过程分别由HAT 和HDAC 介导[8]。
本课题前期实验证实在哮喘患儿体内存在HAT 活性的升高及HDAC 活性降低,且在哮喘小鼠体内有同样的改变[9],已知许多辅激活因子都具有HAT 活性,如环磷酸腺苷反应元件结合因子(cAMP response element binding protein-binding protein, CBP)、p300/CBP 相关因子(p300/CBPassociated factor, PCAF)、腺病毒E1A 相关蛋白等。其本身并不能结合DNA,但通过与序列特异的激活因子相互作用,被吸引到启动子部位,介导转录的激活[10-11]。当组蛋白的N 末端赖氨酸残基在上述刺激因子和前炎症转录因子如核因子-κB(nuclear factor-κB, NF-κB)及活化蛋白-1(activated protein-1, AP-1)等的作用下发生乙酰化,与组蛋白紧密缠绕的DNA 局部被解开,利于与RNA 聚合酶Ⅱ结合,激活转录,从而编码炎症蛋白,促进哮喘发生。
MUC5AC是一种主要的黏蛋白基因,在正常气道也有表达,但在哮喘和COPD 患者的气道是增加的[12]。虽然气道黏蛋白分泌是气道防御的重要组成部分,但过多分泌也是气道阻塞的重要原因之一,在致死性哮喘患者中,几乎总是与气道黏液过多分泌引起的阻塞有关[13]。另外,黏液高分泌是哮喘患者的一个共同症状,特别是哮喘加重期。已证明黏液产生与患者的FEV1 下降有关[14]。这证明黏液高分泌是哮喘加重的标志之一。目前人MUC5AC基因启动子的背景比较清晰,许多转录因子可与之结合并促进其转录,其中AP-1、SP-1、NF-κB等转录因子均可与CBP/p300 发生相互作用[15]。研究发现地塞米松可以通过招募HDAC2,减少MUC5AC 的表达[16],另有实验证实不同浓度的TSA可影响MUC5AC 的表达[8],说明MUC5AC基因的转录调控可能与乙酰化作用相关,但其中的分子学调控机制及动物试验的验证除本课题组的研究外尚未发现此类研究。
本课题组前期分子学实验已证实人MUC5AC基因的核心启动子区域位于-935 bp 至+48 bp 处,且P300 可以下调MUC5AC基因的表达[6],说明HAT 活性与MUC5AC基因的转录调控密切相关。接下来,本研究通过动物试验进一步证实组蛋白乙酰化修饰在哮喘小鼠MUC5AC 表达中的重要作用。本研究发现哮喘组小鼠外周血嗜酸性粒细胞计数较TSA 治疗组、对照组均升高,TSA 治疗组与对照组差异无统计学意义,哮喘组小鼠BALF 及EOS 计数均较TSA 治疗组及对照升高,进一步提示TSA 对于哮喘的治疗作用,而TSA 主要通过下调嗜酸性粒粒细胞性炎症来起到治疗哮喘的作用,其可能与HAT 具有招募嗜酸性粒细胞作用有关。另肺组织HE 染色可见哮喘组小鼠气道周围水肿,炎症细胞增多,而TSA 治疗后明显改善,以上结果均证实TSA 对于哮喘的治疗作用。TSA 作为HDAC 的抑制剂,在抑制HDAC 活性的同时却可刺激抗炎因子的合成和表达,包括细胞因子如TNF-α、IL-1b、IL-6、IL-10、IL-12 和IFN-γ 等[17-18],且HDAC 抑制剂的效果可能根据细胞类型而不同。在小鼠哮喘模型中,致敏期间T 细胞扩增和活化发生在胸部淋巴结中,在过敏原激发后,肺中的T 细胞群显著增加,其中大部分扩增是由于CD4+细胞产生Th2 细胞因子,如IL-4、IL-5 和IL-13,导致肺嗜酸性粒细胞增多、黏液分泌过多以及气高反应[19]。因此,控制Th2 细胞因子的产生将改善气道炎症、降低高反应性[20]。据报道,TSA 可减少CD4+T 细胞增殖,对IL-2 分泌和CD154 表达具有抑制作用[21],因此可以有效地抑制体内T 细胞的活性。另有实验证实TSA 减少BALF 中CD4+T 细胞数量,以及BALF 中代表性Th2细胞因子(包括IL-4 和IL-5)的表达。这些发现均表明TSA 对哮喘炎症反应具有治疗作用[2]。TSA 是公认的HDAC 抑制剂之一,但在本实验中发现,TSA 治疗组小鼠HAT 活性明显降低,说明TSA 不仅抑制HDAC 活性,亦可下调HAT 活性,与既往研究相符[22],但TSA 治疗组和对照组的HDAC/HAT 比值较哮喘组明显降低,这样的改变使TSA 治疗后虽HAT、HDAC 活性均被抑制,但是HDAC 活性仍能发挥主要作用,从而对哮喘起到治疗作用,但具体机制需要进一步实验证实。ELISA 结果显示TSA治疗可降低哮喘小鼠血清MUC5AC 浓度;免疫组织化学结果示,TSA 治疗组较哮喘组能明显减少MUC5AC 蛋白含量,TSA 治疗组与对照组无差异,说明组蛋白乙酰化修饰参与MUC5AC 蛋白的表达,结合前期分子学实验,考虑与HAT 活性有关,TSA在抑制HDAC 活性的同时,也抑制HAT 活性,从而使得MUC5AC 表达下降,证实组蛋白乙酰化修饰,尤其是HAT 活性在哮喘小鼠MUC5AC 表达中起重要的作用,而TSA 对哮喘小鼠气道炎症及黏液分泌方面起着治疗作用。
综上所述,组蛋白乙酰化修饰在哮喘发病中的作用日趋重要,但相关机制尚不完全清楚,黏蛋白作为哮喘患者体内分泌明显增高的一种蛋白,与哮喘的发病及病情演变密切相关,本课题组在前期实验中均证实组蛋白乙酰化修饰可能参与黏蛋白的分泌过程,但是本文仍具有一些局限性,主要包括以下几点:①因MUC5AC 分子量过大,本研究未成功完成Western blotting;②在本实验过程中出现肺泡灌洗液回收困难的情况,其中4 只小鼠在肺泡灌洗过程中出现肺泡破裂,3 只小鼠回抽肺泡灌洗液不成功,回收不成功小鼠大多数为哮喘组,考虑一方面与操作不当有关,另一方面可能与哮喘小鼠气道炎症肿胀有关;③未对小鼠的肺功能及气道高反应性进行检测;④本课题仅限于表型的研究,缺乏机制的研究,经过前期研究,初步考虑其机制可能与MUC5AC基因启动子出的组蛋白乙酰化或者相关转录因子发生乙酰化修饰有关。本课题组将在后期实验中进一步探索HAT 活性对MUC5AC 表达调控的作用,期望为将来从分子学角度研究哮喘的发病机制,从而指导分子学层面的诊疗奠定基础。

