肿瘤源性IL-35促进肿瘤血管生成的研究进展*
于佳兴 李增勋 黄崇标
白细胞介素最初是由白细胞产生并且在白细胞间发挥作用,因此命名为白细胞介素。2007年Collison1 等[1]首次发现白细胞介素-35(interleukin-35,IL-35),是调节性T 细胞(regulatory T cells,Treg)分泌的一种异源二聚体细胞因子,其功能主要为免疫抑制,即抑制CD4+效应T 细胞及Th17 细胞的增殖、诱导CD4+效应T 细胞转化为调节性细胞。IL-35 在炎症和自身免疫性疾病的发生发展中起着重要的作用,如在实验性自身免疫性脑炎、自身免疫性葡萄膜炎、类风湿性关节炎、原发性胆汁性肝硬化等动物模型中均起到一定的保护作用[2-4]。近年来,多项研究表明IL-35 不仅可以由肿瘤细胞分泌,而且在肿瘤的发生发展中扮演重要角色。其中,IL-35 促进肿瘤血管生成的作用得到越来越多的研究证实。
肿瘤血管生成是肿瘤的重要特征之一,在促进肿瘤细胞的存活、增殖、侵袭和转移中起到重要作用。肿瘤细胞、间质细胞(包括内皮细胞、成纤维细胞、炎性细胞等)、细胞外基质及其分泌的各种细胞因子共同调控肿瘤的血管生成[5-7]。肿瘤血管生成依赖于促血管因子的合成和释放,目前发现的促血管生成因子多达数十种,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子、基质金属蛋白酶、整合素、转化生长因子、白细胞介素-8、血小板源性生长因子等[8-10]。VEGF 家族是目前已知最重要的促血管生成因子之一,被认为是最具潜力的抗血管生成治疗靶点,靶向VEGF 通路的抗血管生成药物越来越多地用于临床治疗和研究。然而,抗血管生成药物如贝伐单抗等,临床效果却差强人意,即便初期效果尚可也存在耐药现象,很可能源于肿瘤血管生成途径过多、机制复杂,针对某一位点或通路的抑制会被其他旁路所代偿[11-13]。肿瘤血管生成的机制以及抗血管生成靶向治疗仍需基础研究和临床研究的进一步探索。本文将对IL-35 在肿瘤血管生成中的作用及机制进行综述。
1 IL-35 概述
1.1 IL-35 结构、受体及信号通路
IL-12 家族细胞因子均是由α 链与β 链组成的异源二聚体,α 链包括p35、p28 和p19 亚基,β 链包括p40 和EbI3 亚基。IL-35 是由EBI3 亚基和p35 亚基构成的异源二聚体细胞因子,因此被归纳为IL-12 家族成员。IL-35 受体包括gp130 和IL-12Rβ2。IL-12Rβ2 主要表达于T 细胞和某些肿瘤细胞,而gp130几乎在所有组织器官中均有表达。IL-35 通过与其受体gp130 和IL-12Rβ2 的异源二聚体或同源二聚体结合诱导Janus 激酶(Janus kinases,JAK)家族成员磷酸化,激活下游STAT1 和STAT4 磷酸化形成异源二聚体或同源二聚体,进入细胞核启动下游基因的转录(图1)[1]。因此,IL-35 的信号传导模式与IL-12 家族的其他成员不同,即使只有一个受体也能传递信号[1]。另外,IL-35 可能还有与其他IL-12 家族成员共用的受体,但仍需进一步研究证实。

图1 IL-35 受体以及信号通路[1]
1.2 IL-35 来源
IL-35 由多种细胞分泌产生,最先发现是由Treg分泌,并且IL-35 诱导产生的诱导型调节性T 细胞(inducible regulatory T cells,iTreg)也可以分泌IL-35。有研究表明多种免疫细胞均可以分泌IL-35,如调节性B 细胞、单核巨噬细胞、骨髓源性抑制细胞(myeloid-derived suppressor cells,MDSC)、树突状细胞(dendritic cells,DCs)等[1,14-15]。同样,IL-35 在某些恶性肿瘤组织中呈高表达,如胰腺癌、乳腺癌、鼻咽癌、黑色素瘤、恶性B 细胞淋巴瘤等[16-18]。另外,IL-35 的两个亚基EBI3 和p35 被发现在外周血γδT 细胞、CD8+T 细胞及胎盘滋养层细胞中共表达[19]。上述细胞能否产生具有生物活性的IL-35 仍有待确定。
2 IL-35 与肿瘤血管生成
在多种肿瘤中IL-35 均发挥促进血管生成的作用,均是以间接方式促进血管生成。但在非肿瘤性疾病中,IL-35 对血管生成的作用尚未统一。
2.1 IL-35 与黑色素瘤
Wang 等[18]通过免疫组织化学染色发现某些人类肿瘤组织表达IL-35,如大B 细胞淋巴瘤、鼻咽癌和黑色素瘤。其通过小鼠体内实验发现,B16 黑色素瘤细胞和J558 浆细胞瘤细胞过表达IL-35 促进了肿瘤的生长、CD11b+Gr1+骨髓细胞浸润以及肿瘤血管生成。然而体外实验表明,IL-35 过表达并未促进肿瘤细胞增殖以及对MDSC 的趋化。定量RT-PCR 结果显示IL-35 过表达同样不影响VEGF 水平。因此,该研究认为IL-35 通过某种途径招募CD11b+Gr1+骨髓细胞,进而促进肿瘤血管生成。虽未阐明其中的作用机制,但初步发现IL-35 与肿瘤血管生成具有一定的相关性。
2.2 IL-35 与胰腺癌
胰腺癌是恶性程度最高的消化系统肿瘤,其5年生存率不足7%[20]。虽然严重的间质纤维化以及乏血供为胰腺癌组织的重要特点,但肿瘤细胞周围常伴有大量的新生血管。血管生成对于胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的持续生长、侵袭和转移至关重要。
Jin 等[21]最先研究发现胰腺癌患者血清中IL-35水平明显升高。Huang 等[17]进一步证实IL-35 在胰腺癌细胞中高表达,且IL-35 表达水平与患者的不良预后呈负相关,肿瘤源性IL-35 通过上调细胞间黏附分子-1(intercellular cell adhesion molecule-1 ,ICAM-1)的表达促进肿瘤细胞血管生成和远处转移过程。Huang 等[22]另一项研究发现人胰腺癌组织中肿瘤源性IL-35 表达水平与微血管密度呈正相关。动物实验证实这种相关性依赖于单核细胞的参与,当药物(如氯膦酸二钠脂质体,clodronate liposomes)清除小鼠体内单核细胞后,IL-35 促血管生成的作用明显消失。进一步研究发现肿瘤源性IL-35 促进胰腺癌血管生成的作用主要包括以下方面:1)肿瘤源性IL-35 通过上调趋化因子CCL5 招募单核细胞;2)肿瘤源性IL-35 通过上调单核细胞中促血管生成因子CXCL1 和CXCL8 的表达,间接促进了肿瘤的血管生成。肿瘤源性IL-35 不仅在数量上招募大量单核细胞,而且在质量上促进单核细胞分泌更多的促血管生成因子。分子机制方面,IL-35 通过与肿瘤细胞或单核细胞表面受体gp130 和IL-12Rβ2 的异源二聚体结合诱导JAK家族成员磷酸化,激活下游STAT1 和STAT4 磷酸化形成异源二聚体,进入细胞核启动CCL5、CXCL1、CXCL8 的转录。该研究以肿瘤源性IL-35 为切入点,阐明了IL-35 在胰腺癌血管生成中的作用及机制(图2)[22]。基于此可以进一步推测,由于胰腺癌组织中的IL-35 可以来源于调节性T 细胞、调节性B 细胞、单核巨噬细胞等,CCL5、CXCL1 和CXCL8 也可以来源于成纤维细胞、单核巨噬细胞、T 细胞等免疫细胞,因此肿瘤细胞与间质细胞之间可能形成IL35-CCL5-CXCL1/CXCL8 的正反馈环路,进一步促进胰腺癌血管生成。
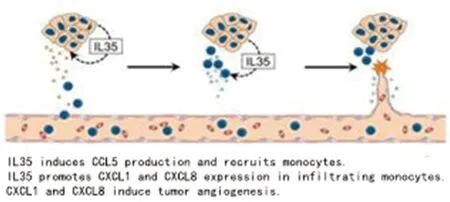
图2 IL-35 促进胰腺癌血管生成模式[22]
2.3 IL-35 与胃癌
IL-35 在胃癌中同样发挥促血管生成的作用。Li等[23]通过对人胃癌组织免疫组织化学染色发现IL-35表达水平与微血管密度呈正相关。体外实验发现IL-35 重组蛋白并不能直接促进内皮细胞成管,而IL-35过表达细胞的上清液却能够促进内皮细胞成管。由此得出结论,IL-35 通过间接方式促进肿瘤血管生成。进一步研究发现,IL-35 通过上调PAI1 和IGFBP1,下调TIMP1 介导肿瘤血管生成。
2.4 IL-35 与非肿瘤性疾病
除上述研究外,IL-35 对血管生成的影响在非肿瘤性疾病中也有相应报道。Jiang 等[24]研究发现在类风湿性关节炎中IL-35 通过抑制VEGF/Ang2/Tie2 信号通路抑制关节组织血管生成。Wu 等[25]同样发现类风湿性关节炎动物模型中IL-35 能够抑制血管生成。机制方面,IL-35 通过STAT1 途径抑制类风湿滑膜细胞分泌VEGF、FGF-2、TNF-α 和IL-6,促进其分泌血管内皮抑制素,进而抑制血管生成。然而,Liu 等[26]研究却得出不同结论,IL-35 在类风湿性关节炎中通过促进骨形成和血管生成来预防骨质丢失。IL-35 通过Th17/IL-17 相关信号通路促进成骨细胞增殖、抑制凋亡,并促进成骨细胞分泌促血管生成因子。上述研究提示IL-35 对于不同类型的细胞发挥不同的调控作用。
3 靶向IL-35 抗肿瘤治疗策略
目前以IL-35 为抗肿瘤治疗靶点的研究仍较少。Huang 等[22]研究发现在小鼠原位成瘤模型中,IL-35中和抗体能够明显地减轻肿瘤组织单核细胞浸润,抑制组织内微血管生成,最终增强吉西他滨的化疗效果。该研究从IL-35 促血管生成的角度揭示了抗IL-35 在肿瘤治疗中的作用。Turnis 等[27]研究表明,B16 黑色素瘤细胞和MC38 结肠腺癌细胞的小鼠皮下成瘤模型中,IL-35 中和抗体明显抑制了肿瘤生长,这依赖于IL-35 中和抗体阻断了IL-35 的免疫抑制作用。另外,Liao 等[28]构建一种数学模型,推演出抗IL-35 药物能够起到抗肿瘤的治疗效果。虽然对靶向IL-35 抗肿瘤治疗的研究尚未达到结论性阶段,但IL-35 有望成为一种潜在的药物靶点。
4 结语
与IL-12 家族其他成员不同,IL-35 不仅来源于多种免疫炎性细胞,也可以由多种肿瘤细胞表达。虽然IL-35 本身不是趋化因子及促血管生成因子,但IL-35 能够促进趋化因子释放间接招募单核系细胞,同时也能够促进单核细胞分泌更多的促血管生成因子,进而促进肿瘤非VEGR 依赖血管生成。肿瘤细胞与间质细胞相互作用,通过IL-35—趋化因子—血管生成因子途径形成正反馈环路,级联放大促血管生成的效果。虽然动物实验中靶向IL-35 起到一定的抗肿瘤治疗效果,但IL-35 能否成为临床上抗肿瘤治疗的靶点仍需大量研究证实。

