TACE联合冷冻消融治疗不可切除肝癌临床疗效的meta分析
李虎子, 段振东, 赵 成, 方文岩, 张 洪, 贺 斌, 李 悦
肝癌患者确诊时大多已失去手术机会。对于不可切除的HCC,TACE可作为首选的局部治疗方案,而冷冻消融治疗(cryoablation)是新近发展起来的局部替代治疗方案。近年来,TACE联合冷冻消融治疗不可切除HCC的报道日益增多。本文收集所有关于TACE与冷冻消融联合治疗肝癌的随机对照试验(RCT),采用meta分析对比临床疗效,希望明确联合治疗对比单纯TACE治疗的优势,为临床治疗提供决策依据。
1 材料与方法
1.1 文献检索
2名研究者单独采用计算机检索中国知网(NCKI)、万方数据库(WANFANG)、Cochrane library、PubMed等数据库,然后合并检索结果。文献类型:TACE联合冷冻消融(联合组)/单纯TACE(对照组)治疗HCC的随机对照试验(RCT)研究文献,无论是否采用了盲法/分配隐藏。检索时限:起始时限不限,截止时限为2020年6月19日。语言限定为:中文或英文。检索策略遵循Cochrane系统评价手册5.0,采用主题词与自由词相结合的方式。中文文献检索词包括:肝恶性肿瘤,肝癌,原发性肝癌,肝细胞癌,肝细胞肝癌,肝脏恶性肿瘤,肝脏肿瘤,肝占位,肝脏占位;肝动脉化疗栓塞,肝动脉栓塞化疗,TACE;冷冻,氩氦,冷 消 融;英 文 检 索 词 包 括:liver cancer,hepatic carcinoma,hepatoma,liver carcinoma,liver neoplasms,HCC,cancer of liver,heptaocellular;transcatheter arterial chemoembolization;cryoablation,ablation,cryosurgery,cryotherapy。如果文献内容重复,仅纳入较新或数据较完整的研究。
1.2 文献纳入和排除标准
纳入标准:①RCT研究;②经临床、影像学、细胞或组织病理学检查明确诊断为HCC的患者,性别、种族及国籍不限;③治疗前患者心、肝、肾等器官无严重的功能衰竭,无明显的血液学异常;④纳入患者无外科切除适应证,或具有禁忌证;⑤对各组患者的一般临床特征有所描述,且具有可比性;⑥若有多组病例构成,只选择所需两组,且其组间均衡性好,具有可比性;⑦至少具有一项评价指标。
排除标准:①非RCT研究;②同时伴有其他恶性肿瘤,或其他部位肿瘤肝转移的患者;③干预措施为非TACE联合冷冻消融与TACE的比较;④文献属综述、非临床报道、病例报道、重复文献、无评价指标、会议摘要等;⑤无法获得全文文献。
1.3 干预措施
联合组:TACE联合冷冻消融治疗;对照组:单独TACE治疗。
1.4 评价指标
1.4.1 近期疗效 完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)、客观缓解率(ORR)、疾病控制率(DCR);评价标准遵循一项标准之一:世界卫生组织实体瘤疗效评价标准(WHO标准)、实体肿瘤的疗效评价标准(RECIST)(包括RECIST1.0,RECIST1.1,改良RECIST)、欧洲肝脏研究协会疗效评价标准(EASL标准)。ORR=(CR+PR)/该组全部患者;DCR=(CR+PR+SD)/该组全部患者。
1.4.2 远期疗效6个月生存率,1年和2年生存率。
1.5 文献筛查
文献筛查及数据提取由2名研究者独立完成,对有纳入分歧文献则经共同讨论,由第3位研究者决定。资料欠缺的通过电话或邮件与作者或通信作者联系以获得完整数据。提取数据内容包括:①一般资料,题目、作者姓名、发表日期、文献来源;②研究对象的一般情况、干预措施;③结果指标。
1.6 质量评价
根据Cochrane系统评价手册中“偏倚风险评估”工具对纳入研究进行质量评价:①随机分配法选择;②是否做到分配方案隐藏;③对研究对象、治疗方案实施者、研究结果测量者是否采取盲法;④结果数据完整性;⑤选择性报告研究结果;⑥其他偏倚来源。针对每项研究结果,对以上6条作出“low risk”(低度偏倚风险)、“high risk”(高度偏倚风险)和“unclear risk”(缺乏相关信息或偏倚情况不确定)的判断。
1.7 统计学分析
文献管理采用NoteExpress软件,提取数据采用Execl软件,统计分析采用Rev Man 5.3软件。计数资料采用相对危险度(RR)作为效应量,各效应量均以95%CI表示。纳入研究的异质性分析采用Chi2检验,若P≥0.1,I2≤50%则认为纳入研究间不存在明显异质性,采用固定效应模型,反之则采用随机效应模型。纳入文献以漏斗图法评估发表偏倚,所有纳入指标均为双侧检验。P<0.05表示差异有统计学意义。
2 结果
2.1 文献检索结果
通过检索文献数据库,共检索到825篇文献,其中中文文献785篇,英文文献40篇。剔除重复文献后,剩余182篇;先阅读文章题目和摘要,排除重复文献、综述、基础实验、非对照研究等文献,初步筛选出可能符合标准的39篇文献;阅读全文后排除34篇(21篇为回顾性研究,7篇文献无法提取有效的一般临床特征,4篇无相关评价指标,1篇引入了其他干预因素且未做脱落处理,1篇文献未提及任何肿瘤病灶相关信息不确定其可比性)(见图1)。最终纳入5篇文献[1-5],均为中文文献,计有418例患者,其中TACE联合冷冻治疗组(联合组)和单独TACE组(对照组)患者分别为212例、206例。5篇文献均报道了近期疗效评价数据,4篇文献报道了生存率。

图1 文献筛选流程及结果
2.2 纳入研究的基本特征
主要包括研究者、发表年份、研究病例数、年龄、肿瘤大小、Child-Pugh分级、随访时间,纳入研究基本特征见表1

表1 纳入研究的基本特征
2.3 纳入研究的质量评价
5项研究中实验组和对照组患者的性别、年龄、肿瘤大小等无统计学差异,组间基线一致,具有可比性。5项研究均为随机分配,其中2项[1,3]采用随机数字表法,3项未报告随机分组方法。(表2,图2)
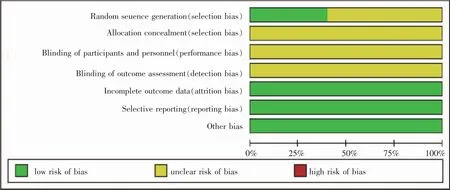
图2 纳入研究文献质量评价

表2 纳入研究方法学质量评价
2.4 meta分析
2.4.1 近期疗效分析5项研究均报道了近期疗效 评 价 结 果,2篇 文 献[1,5]采 用RECIST1.1标 准,2篇文献[3-4]采用了mRECIST标 准,1篇[2]未明 确 采用的评价标准,但依据文中描述结合临床实践推定为RECIST1.0或RECIST1.1。采用Rev Man5.3软件分 析,CR、PR、PD、ORR、DCR卡 方 检 验 分 别 为:Chi2=1.82,I2=0%,P=0.77;Chi2=0.63,I2=0%,P=0.96;Chi2=0.98,I2=0%,P=0.91;Chi2=2.83,I2=0%,P=0.59;Chi2=1.69,I2=0%,P=0.79,提示各研究间均无明显异质性。采用固定效应模型进行meta分析,结果显示RR=2.20,95%CI:1.51~3.22,P=0.000 1;RR=1.22,95%CI:0.94~1.59,P=0.13;RR=0.38,95%CI:0.24~0.59,P<0.000 1;RR=1.49,95%CI:1.26~1.77,P<0.000 1;RR=1.23,95%CI:1.12~1.35,P<0.000 1,提示联合组的CR、PD、ORR、DCR与对照组存在显著差异,具有统计学意义,而两组的PR差异不显著。分析SD卡方检验为:Chi2=8.68,I2=54%,P=0.07,提示各研究间存在明显异质性,采用随机效应模型分析结果为:RR=0.84,95%CI:0.48~1.45,P=0.53,提示联合组的SD与对照组无显著差异。进一步分析异质性来源,发现:异质性主要来自张智慧[2]、何远春[1]两项研究。当移除何远春研究后显示:Chi2=5.37,I2=44%,P=0.15;当移除张智慧2016研究后显示:Chi2=4.08,I2=27%,P=0.25;当移除其他研究后无法消除异质性。(见图3~图8)
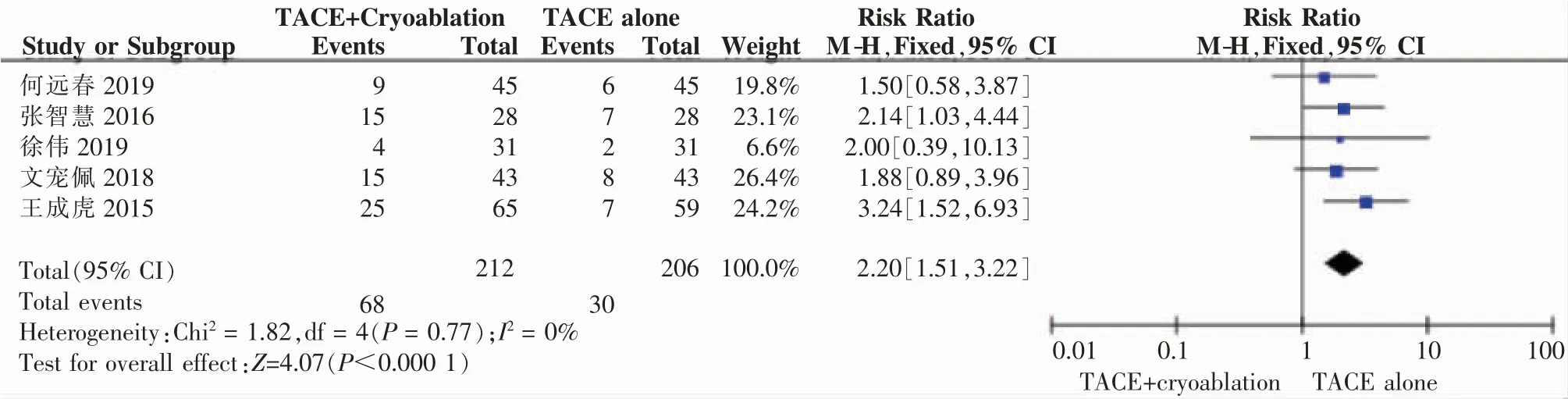
图3 联合组和对照组治疗患者的CR比较

图8 联合组和对照组治疗患者的DCR比较
2项研究[3-4]采用了mRECIST标准进行短期疗效评价,对其合并研究发现,CR、PR、SD、PD、ORR、DCR在两项研究间无明显异质性,可以采用固定效应模型分析结果分别为:Chi2=0.01,I2=0%,P=0.94,RR=1.90,95%CI:0.96~3.75,P=0.06;Chi2=0.01,I2=0%,P=0.94,RR=1.15,95%CI:0.77-1.70,P=0.49;Chi2=0.39,I2=0%,P=0.53,RR=1.07,95%CI:0.57-2.00,P=0.84;Chi2=0.39,I2=0%,P=0.53,RR=0.36,95%CI:0.17~0.76,P=0.007;Chi2=0.32,I2=0%,P=0.57,RR=1.35,95%CI:1.02~1.78,P=0.03;Chi2=0.01,I2=0%,P=0.94,RR=1.27,95%CI:1.07~1.50,P=0.005;提示实验组与对照组在PD、ORR、DCR差异有统计学意义,在CR、PR、SD无明显差异。(见图9~图14)

图4 联合组和对照组治疗患者的PR比较

图5 联合组和对照组治疗患者的SD比较

图6 联合组和对照组治疗患者的PD比较

图7 联合组和对照组治疗患者的ORR比较

图9 采用mRECIST标准时联合组和对照组治疗患者的CR比较

图14 采用mRECIST标准时联合组和对照组治疗患者的DCR比较
2.4.2 生存期分析3项研究[1-2,5]报道了6个月的生存率,合并数据后卡方检验显示:Chi2=13.92,I2=86%,P=0.000 9,显示各研究间存在明显的异质性,采用随机效应模型分析显示:RR=1.09,95%CI:0.89~1.33,P=0.42,提示联合组和对照组患者的6个月生存率无统计学差异。进一步分析显示,异质性来源于张智慧[2]2016研究(权重21.8%),移除该项研究后卡方检验显示:Chi2=0.67,I2=0%,P=0.41。(见图15)

图10 采用mRECIST标准时联合组和对照组治疗患者的PR比较

图11 采用mRECIST标准时联合组和对照组治疗患者的SD比较

图12 采用mRECIST标准时联合组和对照组治疗患者的PD比较

图13 采用mRECIST标准时联合组和对照组治疗患者的ORR比较
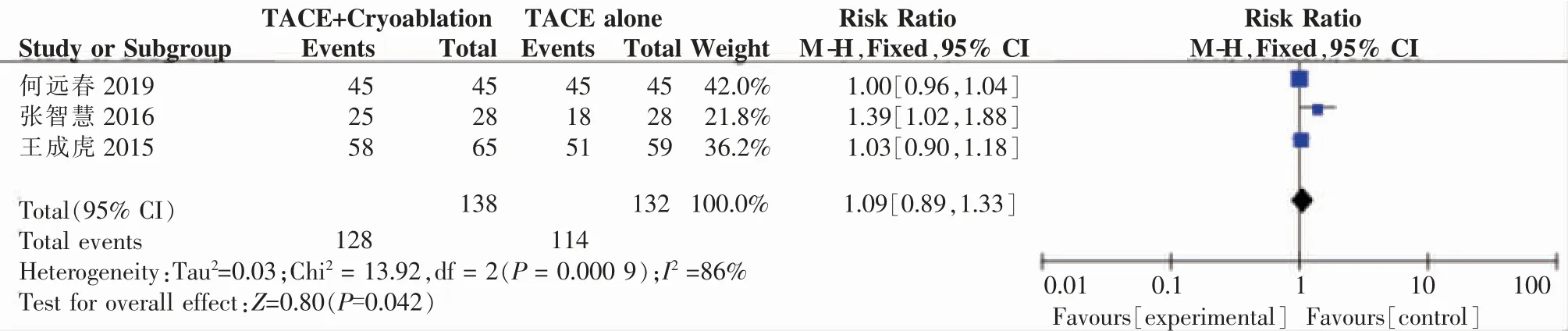
图15 联合组和对照组治疗患者的6个月生存率比较
4项研究[1-2,4-5]报道了1年生存率,合并数据后卡方检验显示:Chi2=4.26,I2=30%,P=0.23,显示各研究间无明显的异质性,采用固定效应模型分析显 示:RR=1.38,95%CI:1.20~1.60,P<0.000 1,提示实验组患者的1年生存率显著优于对照组。(见图16)

图16 联合组和对照组治疗患者的1年生存率比较
3项 研 究[1,2,4]报 告 了2年 生 存 率,合 并 数 据 后卡方检验显示:Chi2=1.36,I2=0%,P=0.51,显示各研究间无明显的异质性,采用固定效应模型分析显示:RR=1.68,95%CI:1.23~2.29,P=0.001,提示实验组和对照组患者的2年生存率存在显著差异。(见图17)

图17 联合组和对照组治疗患者的2年生存率比较
2.4.3 敏感性分析及偏倚 采用依次逐项剔除纳入的单个研究进行meta分析,显示总效应量不受单个研究影响,meta分析结果稳健。采用漏斗图评价偏倚,均为对称的倒置“漏斗”,提示无偏倚(见图18)。

图18 各研究结果meta分析的漏斗图
3 讨论
近30%中晚期HCC患者失去外科手术治疗机会[6],TACE和局部消融治疗均是其可以选择的治疗方案。近年来,多项研究也提示两者联合治疗临床疗效优于单一治疗方案,但是这些治疗以单中心、小样本研究为主,其结论可靠性可能受到影响,尚需前瞻性、多中心、大样本的随机对照研究或meta分析。本研究是首次对TACE与冷冻消融联合治疗不可切除肝癌对比单独TACE的临床疗效进行meta分析。
TACE通过减少、阻断肿瘤病灶的滋养动脉,使肿瘤细胞缺血、缺氧而坏死,被推荐为BCLC B期HCC患者的首选治疗方案。但是TACE仍存在一些不足之处:①TACE对血供丰富的HCC效果较好,但是对乏血供病灶效果不理想;②有少部分肿瘤组织血供来源于门静脉系统而非肝动脉系统,消弱了TACE治疗效果,导致肿瘤坏死不完全;有研究显示:TACE术后肿瘤组织完全坏死率低[7],有30%~50%肿瘤组织坏死,但仅有2%彻底坏死[8];③TACE后肿瘤组织内的缺氧环境会引起血管内皮因子(VEGF)表达上调,促进侧支循环的建立或肝外供血增加,促进肿瘤复发、转移[9];④当HCC合并动静脉瘘、丰富侧支血供时,栓塞剂及化疗药物可能进入其他正常血管,造成异位栓塞及正常肝组织损伤[10];⑤反复多次TACE也将加重肝功能损伤;⑥TACE的远期疗效有待进一步改善[7、11]。因此,TACE尚需联合其他治疗方法共同实施以进一步增强临床疗效。冷冻消融是一种局部物理治疗方法,借助液态低温惰性气体(主要为氩气、氦气)在短期内低温-复温循环,使肿瘤组织变性坏死[12],已达到消灭肿瘤的目的。冷冻消融具有创伤小、可视、可控、高效、安全等特点,具有较高的病灶消除能力,尤其是小肝癌可达到完全消融,有效延长患者的生存时间[13]。但是其对于体积较大的肿瘤无法完全消融病灶,临床效果不佳[14]。而TACE与冷冻消融联合,既能发挥两者的优势,又能相互弥补劣势,形成协同效应,疗效要优于单一治疗方案[15]。
本研究经meta分析TACE与冷冻消融联合治疗对比单一TACE治疗的短期疗效显示:实验组较单纯TACE组CR患者明显增多,PD患者明显减少,ORR(RR=1.49,95%CI:1.26-1.77,P<0.000 1)、DCR明显增高,而PR、SD在两组间差异无统计学意义。这可能归因于:①TACE后有些肿瘤细胞会因侧支循环的建立、门静脉系统供血等因素而存活,冷冻消融治疗可以协助TACE灭杀这部分肿瘤细胞,减少复发的机会;②冷冻消融治疗还能够弥补TACE对乏血供肿瘤杀伤效应不足的缺点;③TACE后局部碘油沉积,有利于协助冷冻治疗定位靶病灶及确定治疗范围[16],并能发现一些不易被CT、MRI发现的病灶,提高了冷冻消融治疗的精确性;④TACE后局部病灶血流减少,有利于消弱热池效应,使冷冻消融时冰球形成更快、更大[16],显著提高肿瘤坏死率[17];⑤冷冻消融和TACE均可使癌细胞膜通透性增加,进而使化疗药物更易渗透进入癌细胞内[18],具有协同杀伤作用。
研究已经表明,mRECIST评估TACE[19]、冷冻消融[20]治疗肝癌的疗效要优于RECIST1.1或RECIST1.0,因此本研究对于采用mRECIST的2项研究进行亚组分析。Meta分析结果显示:实验组PD明显低于对照组(RR=0.36,95%CI:0.17~0.76,P=0.007),且ORR(RR=1.35,95%CI:1.02~1.78,P=0.03)、DCR(RR=1.27,95%CI:1.07~1.50,P=0.005)明显高于对照组,而CR(P=0.06)、PR(P=0.49)、SD(P=0.84)在两组间无统计学差异。这也提示联合治疗能够提高客观反应率和疾病控制率,延缓疾病进展。
本研究还显示,两组患者6个月生存率无明显差异,而实验组的1年和2年生存率显著高于对照组,这说明联合治疗能够有效提高患者的远期生存率,使更多的患者生存获益。
本研究还有一些不足之处:①此项研究的国际报道较少,纳入文献均为国内文献,无法控制有病患群体不同导致的选择性偏倚;②本研究中所有文献对盲法均未做详细阐述,不除外实施或研究中观察导致的偏倚;③目前TACE和冷冻消融联合治疗肝癌尚无指南或专家共识作为参考,缺乏规范化,可能影响本研究的可靠性。

