血清25-羟维生素D水平与2型糖尿病患者甲状腺功能的相关性研究
王 莉,周焕发,张辉容
长沙市中心医院全科医学科(湖南 长沙 430100)
维生素D作为机体必不可少的一种营养物质,在骨骼代谢以及钙磷代谢等方面起着重要调节作用,维生素D缺乏不仅增加了骨性疾病发生风险,而且还影响机体免疫能力、炎症反应以及糖脂代谢[1]。2型糖尿病是中老年群体中常见的疾病,Altimimi等[2]研究显示,超过2/3的2型糖尿病患者存在维生素D不足,特别是病程较长且血糖控制相对较差患者,其维生素D水平明显降低。国外早期研究显示[3]维生素D的长期缺乏能够促使血清甲状腺旁素(PTH)水平明显升高,部分患者会出现代偿性甲亢。血清25-羟维生素D[25(OH)D]水平是评价机体维生素D状况的一个主要指标,本研究分析了血清25(OH)D水平与2型糖尿病患者甲状腺功能的关系,现报道如下。
1 资料与方法
1.1 一般资料选取2015年1月-2016年12月长沙市中心医院收治的2型糖尿病患者200例,所有患者均符合中国2型糖尿病防治指南(2010年版)中的诊断标准[4]。入选标准:①甲状腺球蛋白抗体和甲状腺过氧化物酶抗体水平均正常;②2型糖尿病病程均在12个月以上者;③均接受正规治疗方案者;④既往均无钙剂或维生素类药物服用史者。排除标准:①病例资料不全者;②伴有恶性肿瘤、感染性疾病、骨代谢疾病、高血压或高血脂者;③存在2型糖尿病酮症等糖尿病严重并发症者;④严重肝肾功能障碍者。其中男115例,女85例;年龄38~73岁,平均(55.18±12.63)岁;糖尿病病程3~19年,平均(10.63±4.52)年。根据不同血清25(OH)D水平分为正常组[>30μg/L(75 mol/L)]、不足组[20~30 μg/L(50~75 mol/L)]、缺乏组[10~20μg/L(25~50 mol/L)]和严重缺乏组[<10μg/L(25 mol/L)][5]。
1.2 方法所有患者均详细收集年龄、性别、身高、体质量、体质量指数、病程等一般资料。清晨抽取患者空腹静脉血10 mL,日立7600全自动生化分析仪测定空腹血糖、血钙水平;通过电化学发光法测定患者PTH、空腹胰岛素水平,并计算胰岛素抵抗指数(HOMA-IR);美国Bio-Rad D-10全自动糖化血红蛋白检测仪及配套试剂盒测定糖化血红蛋白(HbAlc)水平;酶联免疫吸附试验法检测25(OH)D水平,酶标仪为美国Bio-Rad伯乐-680型全自动酶标仪;采用美国雅培i-2000全自动化学发光免疫分析仪及其配套试剂盒检测促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、总三碘甲状腺原氨酸(TT3)、总甲状腺素(TT4),严格按照试剂盒说明进行操作。
1.3 统计学处理采用SPSS 20.0统计学软件,计量资料用均数±标准差(±s)表示,多组计量资料采用方差分析,组间比较采用SNK-q检验,计数资料采用χ2分析,25(OH)D与甲状腺功能代谢指标的关系采用Spearman相关分析和多元线性逐步回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较维生素D充足者21例(10.50%),维生素D不足者37例(18.50%),维生素D缺乏者53例(26.50%),维生素D严重缺乏者89例(44.50%)。4组患者在性别、年龄、体质量指数等一般资料比较,差异无统计学意义(P>0.05);缺乏组、严重缺乏组2型糖尿病病程、冠心病发病率高于充足组(P<0.05),见表1。

表1 4组患者一般资料比较
2.2 血钙及血糖代谢指标水平比较4组患者血钙及空腹胰岛素、空腹血糖、HOMA-IR、HbAlc水平比较,差异无统计学意义(P>0.05),见表2。
表2 4组患者血钙及血糖代谢指标水平比较( ±s)

表2 4组患者血钙及血糖代谢指标水平比较( ±s)
组别 n HbAlc/%空腹血糖/(mmol·L-1)(mmol·L-1) HOMA-IR 血钙/(mmol·L-1)空腹胰岛素/充足组 21 9.14±1.29 6.48±1.06 7.34±4.02 2.29±1.41 2.26±0.14不足组 37 9.65±1.32 7.19±1.85 5.79±3.17 1.89±1.62 2.27±0.15缺乏组 53 9.31±1.87 7.21±1.46 6.92±4.77 2.27±1.83 2.24±0.11严重缺乏组 89 9.54±1.96 7.42±2.11 6.78±5.31 2.31±2.08 2.23±0.12
2.3 甲状腺功能代谢指标水平比较严重缺乏组TSH、FT3、TT3水平均明显高于充足组,缺乏组FT3水平明显高于充足组(P<0.05);4组患者FT4、TT4、PTH水平比较,差异无统计学意义(P>0.05),见表3。
表3 4组患者甲状腺功能代谢指标水平比较( ±s)
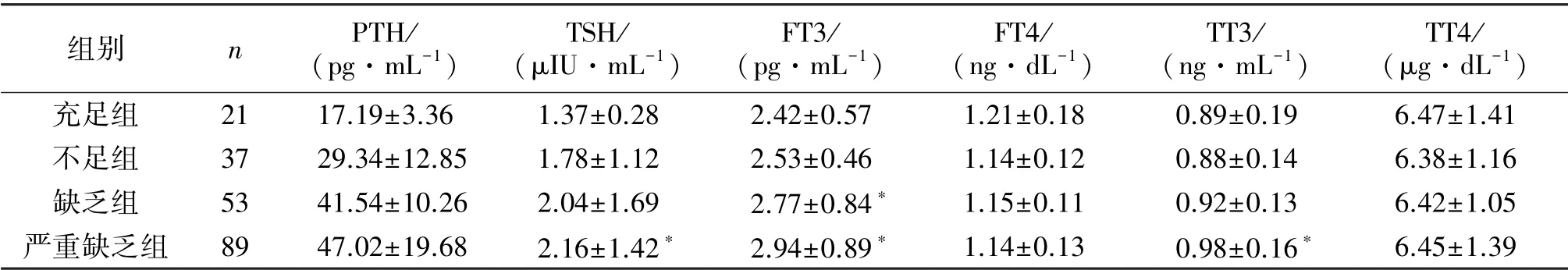
表3 4组患者甲状腺功能代谢指标水平比较( ±s)
注:与充足组比较,*:P<0.05
组别 n PTH/(pg·mL-1)TSH/(μIU·mL-1)FT3/(pg·mL-1)FT4/(ng·dL-1)TT3/(ng·mL-1)TT4/(μg·dL-1)充足组 21 17.19±3.36 1.37±0.28 2.42±0.57 1.21±0.18 0.89±0.19 6.47±1.41不足组 37 29.34±12.85 1.78±1.12 2.53±0.46 1.14±0.12 0.88±0.14 6.38±1.16缺乏组 53 41.54±10.26 2.04±1.69 2.77±0.84* 1.15±0.11 0.92±0.13 6.42±1.05严重缺乏组 89 47.02±19.68 2.16±1.42* 2.94±0.89* 1.14±0.13 0.98±0.16* 6.45±1.39
2.4 25(OH)D与甲状腺功能代谢指标相关性分析校正患者年龄和病程之后,Spearman相关分析结果显示,25(OH)D与TSH呈负相关(P<0.05),与PTH、FT3、FT4、TT3、TT4均无相关性(P>0.05),见表4。

表4 25(OH)D与甲状腺功能代谢指标相关性
2.5 25(OH)D与甲状腺功能代谢指标的多元线性逐步回归分析将25(OH)D作为应变量,PTH、TSH、FT3、FT4、TT3、TT4作为自变量进行多元线性逐步回归发现,25(OH)D是预测TSH水平的独立危险因素(β=-0.227,P<0.05)。
3 讨论
2型糖尿病患者存在明显的维生素D水平降低现象,且血糖控制越差,维生素D水平越低[6]。本组资料中,绝大多数2型糖尿病患者存在维生素D减少,维生素D充足比例仅为10.50%,维生素D严重缺乏比例高达44.50%,而缺乏比例达到了26.50%。这与国内相关研究结果基本一致[7]。研究指出,胰岛β细胞中存在着维生素D的相关受体,当维生素D不足时可造成钙离子通道关闭,使得胰岛素合成与分泌降低,引起机体血糖升高[8];同时,维生素D缺乏能够引起胰岛素受体底物磷酸化受阻,又加重了机体胰岛素抵抗[9]。不过在本研究中,并未发现不同血清25(OH)D水平患者之间糖代谢指标存在明显统计学差异,可能与本组患者均给予降糖药物干预治疗以及样本量较少有关。
国内相关调查显示[10]2型糖尿病患者是甲状腺功能代谢异常的高发群体。研究指出[11]甲状腺功能代谢异常对2型糖尿病患者存在明显危害,如亚临床甲状腺功能减退症增加了患者心血管事件发生风险,而甲状腺功能减退症则加快了患者病情进展,促进了糖尿病肾病的发生。因此,积极纠正2型糖尿病患者甲状腺功能代谢异常具有重要临床意义。Chailurkit等[12]研究发现,青年健康人体内高维生素D状态与低循环TSH有关。本研究中,严重缺乏组TSH、FT3、TT3水平均明显高于充足组,缺乏组FT3水平明显高于充足组(P<0.05),且经过校正患者年龄和病程之后,25(OH)D与TSH呈显著负相关(P<0.05),与其余甲状腺功能代谢指标无明显相关性。
甲状腺细胞上有TSH受体,当TSH受体与TSH结合之后,能够进一步促使甲状腺球蛋白再吸收和水解,而且提升了碘的摄入量,从而增加了甲状腺激素分泌以及促进了甲状腺球蛋白碘化[13]。在正常人体中,甲状腺每天可以分泌约5 nmol的T3及100 nmol的T4,在外周组织当中5’脱碘酶可以促使T4向T3转变,而且甲状腺内部也有5’脱碘酶存在。机体处于碘相对缺乏状态时,5’脱碘酶的活性会出现代偿性增强,从而促进了T3的分泌,进而产生了活性更强的激素混合物[14]。TSH对甲状腺细胞的调节作用,主要是通过G蛋白-腺苷酸环化酶-环磷酸腺苷系统完成的,在此过程中细胞内钙离子水平会对其产生一定影响[13]。当维生素D不足导致钙离子通道关闭之后,会使得细胞内钙离子水平出现变化,进而对TSH信号通路产生影响,一方面甲状腺对碘摄入量和利用率减低,造成5’脱碘酶的活性代偿性增强,促进了甲状腺分泌更多的T3,另一方面,垂体也会代偿性地分泌大量TSH。早期动物实验指出[15]鼠肾脏灌流甲状腺T3和T4之后,1,25(OH)2D的合成率显著降低。由此可见,2型糖尿病患者甲状腺功能代谢异常又会进一步加剧维生素D不足状态。
本研究亦发现,缺乏组、严重缺乏组患者冠心病比例均高于充足组。胡战等[16]研究发现维生素D可能为冠心病的危险因素。郜攀等[17]研究亦表明维生素D水平与冠心病呈显著正相关性,其水平对冠心病发病有一定预测价值。其原因可能与低水平的维生素D促进炎症反应、冠状动脉钙化增高、内皮功能受损和血管僵硬度增加有关[18]。
综上所述,2型糖尿病患者血清25(OH)D水平明显降低,25(OH)D与2型糖尿病患者甲状腺功能有一定关系。

