零维碳基纳米材料细胞毒性效应的研究进展
李依檬,刘 熙,吴添舒*
零维碳基纳米材料细胞毒性效应的研究进展
李依檬1,刘 熙2,吴添舒1*
(1.东南大学公共卫生学院,环境医学工程教育部重点实验室,江苏 南京 210009;2.东南大学医学院,江苏 南京 210009)
介绍了碳基纳米材料进入细胞的主要途径,重点总结分析了几种常见零维碳基纳米材料导致细胞发生不同形式的死亡效应及其可能的毒作用机制,影响纳米材料毒性的各种理化性质也有所阐述.最后在本课题研究成果的基础上对未来碳基纳米材料的毒性研究前景进行了思考和展望,将为碳基纳米材料设计优化和广泛应用提供有价值的参考.
碳基纳米材料;文献计量学;纳米毒理学;细胞死亡方式
在过去的几十年里,纳米技术已经成为一个快速发展的领域,产生了许多具有不同物理和化学性质的纳米材料,纳米复合材料因其重量轻、强度高、导电性好而成为研究热点,并且得到了广泛的应用.碳基纳米材料是一种具有单一物理化学性质的新型纳米材料,这些材料已经在生物医学应用中得到了广泛的适应性应用,包括纳米医学、生物传感器、生物芯片、生物电子学等领域[1].
由于碳基纳米材料较小的体积和特殊的表面性质,它可以轻易地通过呼吸道、消化道、皮肤和注射等途径进入人体,直接或经由淋巴系统进入血液循环,使其在生物体的各个系统之间迁移并引起全身性的生物效应.碳基纳米材料进入人体的呼吸系统后,一般沉积在支气管和肺泡部,不但可能经肺泡上皮毛细血管或被巨噬细胞吞噬后进入血液循环系统,而且可能直接穿透肺间质时会与肺间质细胞发生作用,引起炎症等一系列疾病的发生.由于一些纳米材料已经广泛应用于牙膏、胶囊、口香糖、药品添加剂等日常用品中,消化道暴露成为人群暴露的另一个常见途径.其中,小尺寸、高脂溶性及表面带正电的纳米颗粒相对更容易跨越胃肠道粘膜,进入粘膜下层组织,经淋巴和血液循环转运入全身器官并发挥损伤作用.皮肤作为机体对外界环境损害因素的第一道屏障,并不具有高度通透性,但碳基纳米材料凭借其粒径的减小及表面性质的改变易被吸收.此外,近些年研究发现纳米颗粒对肿瘤细胞具有杀伤作用,因此将纳米颗粒直接注入体内,并利用纳米颗粒载带活性成分运送到病变组织和细胞,进行靶向药物运输.该项纳米医药技术虽然给肿瘤治疗带来了光明,但是随之产生了纳米材料的另一种暴露途径,即注射暴露,也可能造成正常组织细胞的损伤[2].
大量纳米材料应用到了人类生活生产的各个领域,它们在环境和人群中的暴露率将大幅度提升,而目前对于纳米材料的毒性效应研究较少,缺乏全面透彻的认识.此外,由于部分纳米材料在有关疾病,如肿瘤的诊断和治疗有着显著的优势,深入了解并规避其毒性能为医疗技术进步提供可能性.因此,全面了解纳米材料的毒性行为,才能更好地应用纳米材料并发展纳米技术[3].由于生命的基本单位是细胞,纳米材料的生物效应和毒性机制信息通常来源于细胞实验,近年来,越来越多的研究者开始探索碳基纳米材料的细胞毒性,以期为其的生物安全性应用提供保障.本文总结分析了现有碳基纳米材料细胞毒性的研究现状、未来发展动向、以及已有的研究成果,并对碳基纳米材料的毒性研究前景进行了思考和展望.
1 碳基纳米材料细胞毒性研究的出版趋势
借助陈超美教授开发的Citespace V可视化文献分析软件进行文献计量学分析[4].该软件提供的突发关键词探测技术通过统计评估关键词随时间推移而变化的出现次数,将频次在某段时间内快速增加的关键词探测出来,再将这些关键词按时间顺序排列,从而确定该领域的研究发展趋势,为相关领域的研究指引方向.
以TS=( carbon nanomaterials AND cytotoxicity)作为检索式,从Web of Science中检索了过去九年期间(即2012~2020)的相关研究文献,之后应用Excel 2019软件和CiteSpace V软件对数据进行了定性和定量的分析,并通过CiteSpace V软件对初筛数据做进一步除重处理,共得到1097篇不重复文献(截止2020.10月).获得的数据进行统计学分析后显示,随着时间的推移,与碳基纳米材料毒性相关出版物的数量呈逐年上升趋势(趋势线²=0.2849)(图1),由此可见,碳基纳米材料的细胞毒性研究正在稳步发展.
在该领域相关的前五大出版国中,中国以286篇文献排名第一,这表明中国在碳基纳米材料的细胞毒性研究领域取得了重大进展(图2).但是美国出版的文献在被引用数量上仍旧多于中国,由此可知,美国学者在碳基纳米材料细胞毒性方面研究成果的质量更高,更能够得到相关学者引用的关键词地图显示的科学相关出版物直观地表明了所有集群与索引词标记提取出的参考.大型集群不仅包括毒性、表面功能化、细胞凋亡、细胞吸收等生物相关效应,也包括富勒烯、氧化石墨烯、纳米金刚石等应用广泛的碳基纳米材料,这说明了碳基纳米材料的的毒性评估及其潜在毒性机制的探索正在成为现下流行的研究热点(图3).
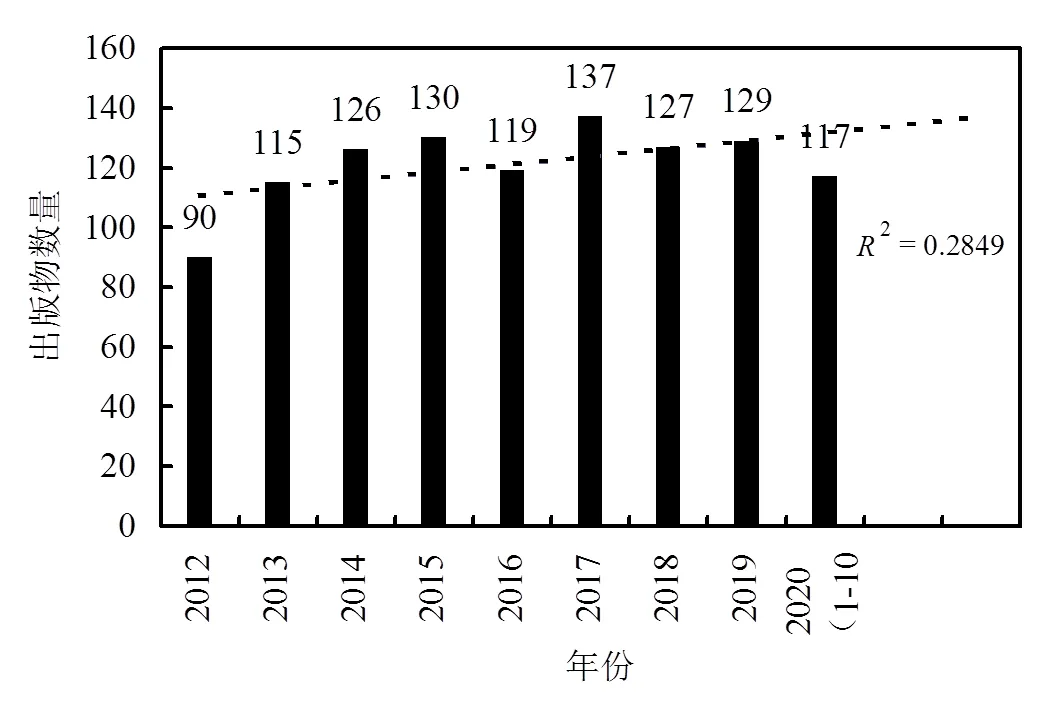
图1 2012年至2020年出版物数量统计及趋势图
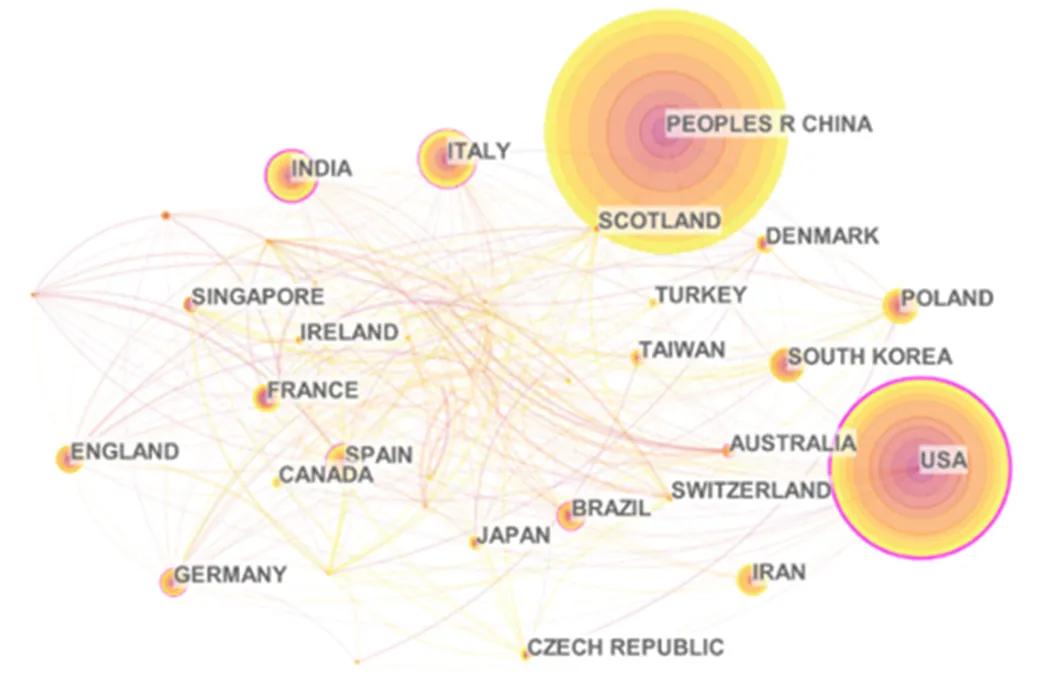
图2 2012年至2020年关于碳基纳米材料的细胞毒性研究的国家/地区网络
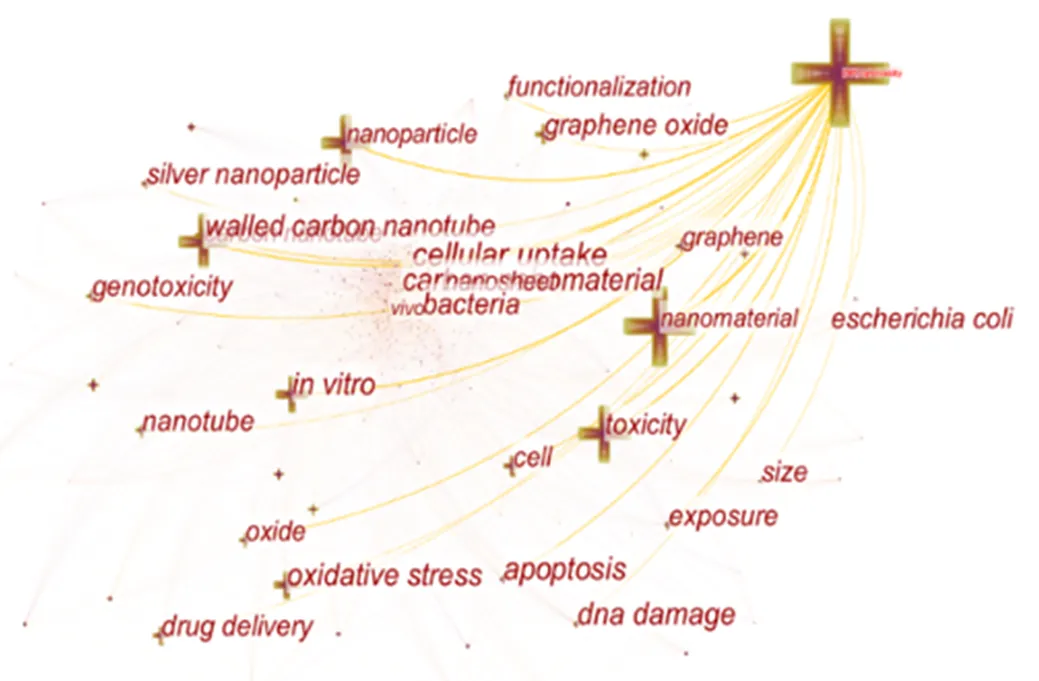
图3 2012年至2020年碳基纳米材料毒性研究的引用关键词网络
此外,共引图将从参考文献中提取的索引项进行了标记(图4).大类中不但包括了诸如体外毒性、自噬、共聚焦活细胞成像、暴露等生物学效应,也包括碳纳米点、氧化石墨烯等明确的碳基纳米材料名称,这表明碳基纳米材料正在成为纳米毒理学领域研究的热点对象,学者们对该材料的研究更加多元化,也更加深入.
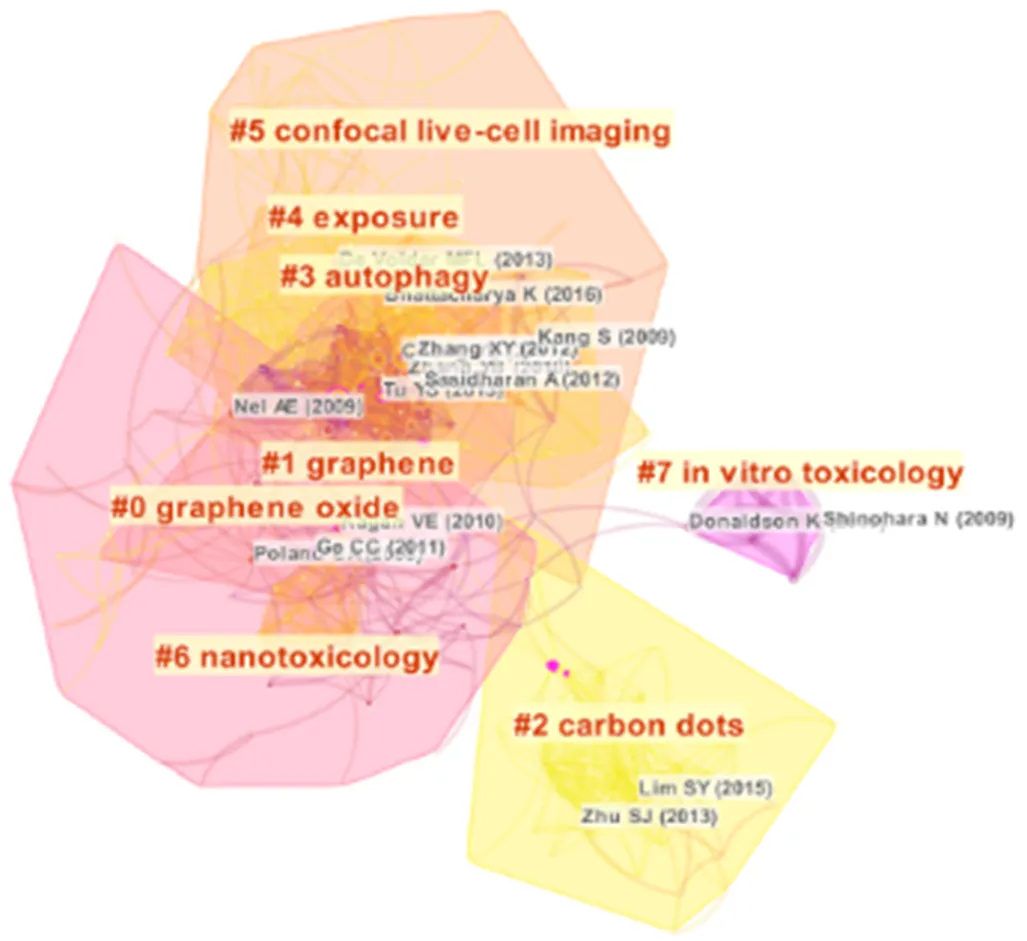
图4 利用碳基纳米材料进行纳米科学研究的参考文献共引
突发关键词指该领域突变或新兴的研究趋势,提供了研究前沿的合理预测.本文作者通过该项探测技术提取了前20个碳基纳米材料细胞毒性前沿研究的关键词,预测发现该领域今后主要研究方向将集中在对碳基纳米材料中的纳米片、纳米复合材料,石墨烯量子点等与巨噬细胞和肺细胞的相关毒性研究(图5).除了对碳基纳米材料进行毒理学研究外,也有和纳米材料在癌症等疾病中诊断和治疗的交叉研究,推断以基础且深入的纳米毒理学研究为基础,未来在疾病的临床治疗上也会有不小的进展.
通过文献计量学的研究,明确了对碳基纳米材料进行细胞毒理学研究是目前纳米材料和纳米毒理学领域的研究热点,在未来几年将呈上升趋势.碳基纳米材料种类繁多,按其空间维度受纳米尺度的约束程度可以分为三类:零维、一维和二维.其中零维纳米材料(0-dimensional nanomaterials)是指在空间三维尺度方向均在纳米尺度的物质,如纳米颗粒、原子团簇和量子点等,一般由少量原子和分子组成.零维碳基纳米材料有很多,常见者如碳黑纳米粒子(CBNPs)、纳米金刚石(ND)、富勒烯(C60)、氧化石墨烯(GO)、碳纳米点(C-dots)以及石墨烯量子点(GQDs)等,由于其具有优异的物化性能组合,如机械强度高、电导率和导热率高、光学性能好等特点,它们在许多领域得到了广泛应用,也增加了公众和环境对碳基纳米材料的潜在暴露,其生物安全性和毒性效应引起了人们的广泛关注.目前部分零维碳基纳米材料已经进行了安全性测评,本文将已有的相关领域的毒理学数据进行了分析总结,特别关注了如今细胞毒理学中的研究热点——细胞死亡方式的探索,为后续该领域的研究提供了指导方向和数据参考.

图5 使用碳基纳米材料进行纳米科学研究的出版物中引用突出最强的关键词
2 碳基纳米材料被细胞摄入的研究
细胞内化过程在纳米材料的生物医学应用及其健康危害中起着关键作用.Reja等[5]的研究发现了碳基纳米材料与几种纳米材料相似的进入细胞的途径.由于碳基纳米材料体积小,可通过微胞吞、网格蛋白介导的内吞和小凹介导的内吞途径直接进入细胞.同时,碳基纳米材料的细胞毒性不仅体现在正常细胞中,对癌细胞系也有损伤作用,包括不同来源的成纤维细胞、成骨细胞、巨噬细胞、上皮细胞和内皮细胞.而不同的碳基纳米材料与细胞的相互作用也有所不同.
Georgakilas等[6]人的研究显示石墨烯纳米材料比表面积较高,因此该材料可以进行较为有效的吸附,也可能与分子及其功能性聚集物结合.在胞吞作用之前,石墨烯纳米材料与细胞膜的直接接触是产生功能性石墨烯纳米材料(FGNs)细胞毒性的重要因素[7].由于FGNs分为单层和多层形态,单层或低层的材料暴露于活细胞时,在其和细胞膜二者的相互接触过程内,会对细胞膜造成直接有效的物理膜损伤[8].GO在尺寸相对较小的情况下可以进入细胞内,而尺寸较大的可以依附在细胞表面并将细胞包裹起来[6].
此外,一些经典的碳纳米材料还会由于本身理化特征的优势进一步影响与细胞的相互作用.李炜的研究表明水溶液中的C60是以团聚的形态呈现,并且他们的表面形态特征、尺寸大小及其表面颗粒电荷都将影响与细胞的相互作用.C60在水溶液中呈非单一分子表现,是以团聚(100~200mm)的形态呈现[9].同时,多个研究团队已经明确了碳纳米管提供的关键优势之一是能够有效跨越生物屏障,这将使其能够用于治疗活性分子的传递,经KOSTAS KOSTARELOS的研究发现,不同类型的功能化碳纳米管(f-CNTs)具有被多种细胞吸收的能力,并能在细胞内通过不同的细胞屏障流通[10].同时在实验的支持下,王馨悦的研究团队发现在多壁碳纳米管的影响下,细胞表面高度及其表面糙度具有显著的改变.
总而言之,碳基纳米材料与细胞膜产生接触后,由于材料与细胞膜有相互作用的,所以较为容易地实现入胞的过程.另外,由于细胞表面的不同带电状态,很大程度上改变了相互作用之间的能量水平,则会产生特质迥异的结构[11].碳基纳米材料在与细胞的相互作用过程中,大部分直接有效的特异性反应可与其表面的配体和细胞膜上的补体分子或受体之间结合,此作用产生了受体介导的内吞反应[12].
3 零维碳基纳米材料的细胞毒性研究
3.1 碳黑纳米粒子(CBNPs)
CBNPs是颗粒物环境污染的重要组成部分,广泛应用于橡胶、塑料、油墨和涂料中,但是CBNPs的大量生产导致职业暴露量急剧增加,其毒性备受关注[13].CBNPs能通过呼吸道进入肺部并在肺部积聚,而肺泡巨噬细胞位于肺泡腔和小气道,它们对于清除有毒污染物和防御被入侵的微病原体至关重要,CBNPs通过诱导巨噬细胞的坏死导致肺部炎症[14],还可以吸附Pb2+形成CBNPs-Pb2+复合物,通过粒子化改变其物理性质,协同诱导大鼠肺泡巨噬细胞凋亡并阻断自噬通量[15].由此可见,CBNPs与很多呼吸系统疾病息息相关.
3.2 纳米金刚石(ND)
NDs是一种新型纳米碳材料,具有多种引人注目的力学、化学、光学和生物特性,使其通过生物分子的表面修饰或功能化在药物载体方面发挥极其重要作用[16].NDs具有将生物片段导入单个细胞或靶向细胞的潜力,成群的NDs围绕在药物周围,以确保药物与健康细胞分离,直到药物到达靶部位的癌细胞,并在癌细胞中释放出来,且NDs的大小使肾脏能够在不阻塞其他血管的情况下轻松将其排出体外,因此被广泛应用于癌症治疗[17].例如表面功能化非生物毒性爆震纳米金刚石(DND)被提出与全反式维甲酸(ATRA)联合用于增强ATRA药物对急性早幼粒细胞白血病(APL)典型靶癌细胞HL-60的疗效[18],含阿霉素的聚甘油功能化纳米金刚石可通过激活多形性胶质母细胞瘤(GBM)细胞自噬用于治疗癌症[19].
此外,在眼部给药领域,NDs已被发现在青光眼等疾病的治疗中有重要的应用[20].NDs也是局部保护皮肤免受晒伤的极佳候选药物,它们不表现出光催化活性,而光催化活性是产生活性氧(ROS)的主要因素,从而导致皮肤损伤;它们表现出散射特性,从而防止紫外线B引起的皮肤损伤[21].
3.3 富勒烯(C60)
C60是碳的第三种同素异形体,其中C60是最常见、最小的富勒烯.富勒烯有三种形式包括球体、椭球体和小管,分子大小从30到3000个碳原子不等,其具有耐高温、耐压和耐辐射的特性[22].据报道, MTT法观察到C60对肺泡巨噬细胞没有细胞毒性作用[23],对人巨噬细胞的细胞毒性也非常低,不作为生物诱导剂引发炎症反应[24].但是,C60可能具有强大的抗癌活性,水溶性羟化富勒烯C60(OH)24和Nano- C60均被发现与肿瘤细胞的自噬密切相关[25-26],可见探索富勒烯在低浓度和非细胞毒性浓度下诱导自噬的能力是否可以用来改善癌症化疗将是非常值得的.
3.4 石墨烯量子点(GQDs)
GQDs是一种新型纳米石墨烯,由几层石墨烯碎片组成,由于其独特的可调谐光致发光性能、物理化学性能、高光稳定性、良好的生物相容性和体积小,可作为生物相容性成像探针用于同时示踪和给药[27].利用GQDs,可以克服低溶解度、快速排泄、低生物相容性和低靶向性等给药挑战[28],因此可以用于治疗癌症.例如GQDs在蓝光照射下产生ROS,并通过氧化应激诱导U251人胶质瘤细胞凋亡和自噬[29].在GQDs表面掺入伊马替尼(一种专为抑制酪氨酸激酶而设计的分子),可通过诱导细胞凋亡有效内化并杀伤癌细胞,特别适用于白血病的治疗[30].体外研究表明,由于GQDs超小体积与高氧含量的特点,其细胞毒性极低.同时,体内生物分布实验显示,GQDs在小鼠主要器官中无物质积累,肾脏可以将其快速清除[31],但也有研究证实了GQDs可以通过p38MAPK和NF-kB信号通路诱导人巨噬细胞的炎症反应、凋亡和自噬,其大小和表面面积对免疫系统存在影响[32].
3.5 碳纳米点(C-dots)
C-dots作为一种新兴的碳基纳米材料,是一种具有非晶或晶芯结构的纳米颗粒,其制备工艺简单,具有发光性好、细胞毒性小、生物相容性好、发射性能可调等优点[33].许多实验组对C-dots的毒性进行了测试和研究,由于它主要由碳、氢、氧等无毒元素组成,因此具有良好的生物相容性,对活细胞和植物生长几乎没有任何毒性作用[34],被广泛用于生物成像、靶向药物给药纳米生物偶联物、细胞分化平台以及组织工程.
3.6 氧化石墨烯(GO)
GO是石墨烯最著名的衍生物,它是一种薄的碳纳米结构,在基面和边缘都有各种极性含氧官能团,如羟基(OH)、羰基(C=O)羧基(C-O-OH)和烷氧基(C-O-C).这些含氧基团的存在导致GO在水和其他有机溶剂中的分散性和溶解度,并能显著改善其机械、电子和电化学性能[35].关于GO的细胞毒性效应或机制的研究主要集中在纳米材料进入细胞模型,但覆盖细胞功能的研究相对较少.在某些情况下, GO对细胞活力无显著影响,但它可能在细胞信号转导和网络功能上发挥着重大作用.
4 零维碳基纳米材料引起不同形式的细胞死亡及其毒作用机制
4.1 凋亡
细胞凋亡是一种程序性、非炎症性的反应,它在发生机制方面的显著特点是独特的DNA裂解以及激活细胞凋亡的关键执行分子——半胱天冬酶3和9(caspases 3and 9).细胞凋亡的形态学表现包括膜起泡、细胞萎缩、染色质凝聚、核小体间DNA碎裂以及凋亡小体的形成.特别地,一种从内层到外壁的浆膜磷脂酰丝氨酸触发器是巨噬细胞检测到可吞噬的凋亡细胞的典型信号[36].细胞凋亡存在多种特征,比如,HL-60细胞暴露于富勒烯衍生物后,可因为活性氧的生成而出现DNA碎裂和染色质凝结等[37].即使对新型碳基纳米材料GQDs,细胞接触后也出现了凋亡的形态学和生物化学特征[38].Qin等研究者进一步发现GQDs是通过线粒体相关途径诱导细胞凋亡,涉及半胱天冬酶家族的激活,表现为Bax、Bad、caspase 9和caspase 3表达的增强[32].
此外,碳基纳米材料组装的生物分子作为一种高效的药物传递系统,促进了各种癌细胞的凋亡作用.Fan的研究表明,爆轰纳米金刚石(DND)可以通过形成DND–ATRA复合物传递药物,并有效促进HL-60细胞的凋亡[39].然而,在某些情况下,一些碳基纳米材料却对细胞凋亡具有保护作用.Lao等人报道,C60-(C(COOH)2)2纳米粒子具有选择性进入被氧化损伤的脑内皮细胞而非正常内皮细胞的特殊能力,能够通过调节几个与JNK通路相关的信号物质防止细胞凋亡,包括减少JNK磷酸化、激活蛋白1(AP-1)和半胱天冬酶3(caspase 3)、抑制多聚ADP聚合酶(PARP)裂解和释放线粒体细胞色素C[40].
4.2 自噬
自噬主要是细胞内的一个适应性过程,具有细胞保护功能,使其能在营养缺乏和ATP缺乏的条件下生存.简单地说,大自噬是最典型的自噬途径,也可能是主要的自噬途径.在这个过程中,通过吞噬体的作用,细胞质内的物质被隔离,吞噬体膨胀并成熟,形成称为自噬体的双膜小泡.自噬体可与核内体融合,并最终与溶酶体融合,形成自噬溶酶体.在微自噬中,细胞质内的物质被溶酶体或者液泡膜的突起和分离直接吞噬[36].
许多研究都观察到零维碳基纳米材料诱导了细胞自噬,并对其毒作用机制进行了研究.一项研究表明,含阿霉素的聚甘油功能化纳米金刚石(Nano-DOX)暴露会激活多形性胶质母细胞瘤细胞的自噬.由于DOX是一种公认的凋亡诱导剂,DOX处理后的GC呈现ΔΨm消退、细胞表面膜联蛋白V和半胱氨酸蛋白酶3活性明显上升.相比之下, Nano-DOX处理的GC凋亡标志只发生轻微改变,但Beclin-1和LC3-II等自噬标记上调明显且出现许多自噬小体[41].GQDs暴露也被发现可以导致一系列自噬的形态和生化特征,包括自噬小泡的形成、LC3-I/LC3-II的转换、beclin-1表达的增加和自噬靶点p62的降解[32].
此外,Yamawaki等[25]报道了水溶性羟化富勒烯C60(OH)24可引起血管内皮细胞多聚泛素化蛋白的积累和自噬体的形成,导致自噬细胞死亡.Harhaji等[26]随后报道,Nano-C60在胶质瘤细胞系中诱导酸化的胞浆内小泡,提示自噬,这有助于Nano-C60的细胞静态作用.由此可见,C60(OH)24和Nano-C60在相对低的浓度下都能引起一定程度的自噬,不会导致显著的细胞死亡.鉴于富勒烯特别是Nano-C60在高浓度的暴露条件下对正常细胞具有相对较大的毒性,探索富勒烯在低浓度和非细胞毒性浓度下诱导自噬的能力是否可以用来改善癌症化疗将是非常值得的[42].此外,橄榄油提取的C60暴露12周,可使得脑内Caspase-3、Beclin-1等氧化应激指标上调,Bcl-2下调,改善了LC3-I/II比率,阻止了自噬通量的极大增加,改善氧化还原失调、高血糖诱导的细胞凋亡紊乱,对高糖应激海马细胞具有细胞保护作用;同时,C60通过BCL-2/Beclin-1的互反表达调控自噬,可防止海马功能紊乱[43].
4.3 坏死
细胞坏死被定义为一种意外的、促炎的细胞死亡形式,各种病理条件如外伤、毒素暴露、缺血、病毒或细菌感染、神经退行性疾病等均可导致细胞坏死.细胞在坏死早期会表现出一系列特异性的形态学改变,包括水肿、羽状变性、浑浊肿胀和空泡变性.在此之后,不可逆转的细胞坏死与线粒体内膜和外膜之间的关键分离有关,氧化磷酸化能力也发生不可逆性损失.最后,在坏死晚期,细胞质中失去内容并呈现均匀嗜酸性外观,细胞质细胞器膜不规则现象,线粒体肿胀,基质密度增加,液泡形成和磷酸钙沉积.在细胞核层面,可以发现有染色质凝结、核分裂和色质破坏[44].
有研究表明C57BL/6小鼠巨噬细胞暴露于CBNPs,通过溶酶体破裂、组织蛋白酶B释放活性氧生成以及减少细胞内TP水平,在体内和体外诱导的急性坏死细胞中,mtDNA从坏死细胞中泄漏激活了中性粒细胞而导致肺部炎症[14].水溶性纳米微粒羟基化富勒烯,即富勒醇,对人晶状体上皮细胞、人视网膜色素上皮细胞具有细胞毒性作用,可通过激活细胞的caspase-3、增强蛋白酶活性导致其发生坏死[45].多羟基化C60主要具有抗氧化和细胞保护作用,仅具有温和的不依赖于ROS的促凋亡活性,与多羟基化C60不同,纯晶体C60似乎具有较强的促氧化能力,可以导致细胞快速坏死[46].
4.4 焦亡
焦亡是一种与炎性小体激活、caspase-1裂解和下游IL-1释放相关的细胞死亡类型.研究发现,焦亡具有坏死和凋亡两者的特征,它既类似凋亡是一种程序性细胞死亡的形式,又类似坏死表现为膜完整性的丧失[47].焦亡的发生机制具有几个特点.首先,caspase-1的酶介导细胞死亡的过程在细胞凋亡中发挥关键作用;其次,焦亡的特点是浆膜快速破裂,细胞内促炎物质的释放,导致细胞体积增大;第三,染色体DNA的裂解是一个致命的事件,它是由一种未被识别的caspase-1激活的核酸酶在焦亡作用中产生的;最后,肌动蛋白细胞骨架的破坏也在细胞焦亡中被观察到,但这种破坏的机制尚不清楚[47].
研究发现巨噬细胞暴露于CBNPs后细胞内的NLRP3炎性小体激活,以激活半胱天冬酶-1和IL-1释放,通过半胱天冬酶-1抑制剂和焦亡抑制剂对CBNPs诱导的细胞死亡的抑制作用,证实了暴露的细胞凋亡为焦亡[48].
4.5 铁死亡
铁死亡是一种由铁依赖的脂过氧化积累导致的新非凋亡程序性细胞死亡的形式,伴有谷胱甘肽(GSH)和谷胱甘肽过氧化物酶4(GPX4)的降低[49].铁死亡作为一种被研究者发现不久的一种新型死亡方式,形态学特点还不是很明确,目前的研究提出的改变包括细胞体积收缩、线粒体膜密度增加等.铁死亡的诱导物可分为两类小分子物质,第一类为系统Xc-抑制剂,第二类为GPx4抑制剂.此外,一些药物,如索拉非尼、青蒿素及其衍生物,可导致铁死亡[50].
研究发现,氮掺杂石墨烯量子点(N-GQDs)通过诱导线粒体氧化应激引起小胶质细胞铁蛋白增多,小胶质BV2细胞出现胞内铁超载、GSH缺失、ROS生成过多和脂质过氧化等铁死亡特征;相同暴露方式下氨基功能化的石墨烯量子点(A-GQDs)诱导的铁蛋白作用较N-GQDs温和,提示氨基功能化对GQDs引起的铁死亡有轻微的保护作用[51-52].
4.6 坏死性凋亡
坏死性凋亡是一种不依赖半胱氨酸蛋白酶细胞死亡途径,它是由细胞外或细胞内稳态的扰动引起的,主要依赖于MLKL、RIPK3和RIPK1[53].某些碳基纳米材料也可以引起细胞发生坏死性凋亡,它是许多人类病理的一部分,包括病毒感染和神经元兴奋性毒性,可以导致亨廷顿病、帕金森病和阿尔茨海默病等神经系统疾病[36].

表1 不同结构的零维碳基纳米材料诱导细胞死亡的体外研究

表2 不同结构的零维碳基纳米材料诱导细胞死亡的体内研究
5 碳基纳米材料诱导的细胞死亡间关系
虽然大多数生物分子只控制一种细胞死亡途径,但是最近的证据表明有特定生物分子参与两种或两种以上的细胞死亡途径[56],纳米材料导致的细胞死亡效应间也存在这多种联系(图6).如果外部刺激导致细胞内能量水平的降低不能激活自噬途径,细胞就会激活坏死来控制细胞[57].此外,有研究证实了几种重要的凋亡调控蛋白,如Bcl-2家族成员、caspase-8和FADD样凋亡蛋白,同样能够控制自噬[58],而自噬通路中ATG5、Beclin-1和ATG4D的激活也会对细胞凋亡产生影响[59].在心脏病发作等病理条件下,细胞凋亡作为细胞中第一个发现,也是最重要的细胞死亡途径,并无特异性作用,坏死过程作为备用途径,清除了受损细胞[60].在caspase-8未表达的细胞中,TNFR1与FAS、TNFR2、TRAILR1和TRAILR2等受体除了刺激细胞凋亡外,还可通过RIPK1激活的ripk3触发细胞的坏死过程[61].
虽然自噬和坏死之间的相互作用复杂,但这两种死亡途径间具有共同的介质.经典细胞凋亡抑制剂zVAD-FMK可以通过抑制caspases蛋白活性阻断细胞发生凋亡,同时也可以通过抑制溶酶体组织蛋白酶阻断自噬的发生[62],或者通过限制激酶RIPK1的活性来导致细胞的坏死[63].乙酰化酶复合物(NAD+-依赖的蛋白去乙酰化酶)除了通过活化ATG5、ATG7和ATG8诱发自噬外,还可以通过调节肿瘤细胞中的RIPK3活性,导致坏死[64].此外,在另一项试验中,Basit显示Bcl-2抑制剂obatoclax可以触发自噬,进而激活RIPK1介导细胞坏死[65].
目前大量的体内体外研究发现,碳基纳米材料主要通过氧化应激、DNA损伤和炎症诱导诱发细胞死亡[55].C60可以通过诱导HL-60细胞中活性氧的产生,导致DNA碎裂和染色质凝结,从而诱发凋亡[37]. CBNPs作用于C57BL/6小鼠巨噬细胞,通过溶酶体破裂、组织蛋白酶B释放活性氧生成以及减少细胞内TP水平,在体内和体外诱导急性细胞坏死, mtDNA从坏死细胞中泄漏激活了中性粒细胞而导致肺部炎症[14].
在研究碳基纳米材料对正常细胞产生的毒性时,科学家们开始日益重视利用它们的细胞毒性来治疗肿瘤.例如,在GQDs表面掺入伊马替尼,可通过诱导细胞凋亡来杀伤癌细胞,特别适用于白血病的治疗[66].含阿霉素的聚甘油功能化ND可通过激活GBM细胞自噬用于治疗癌症[19].C60(OH)24和Nano-C60在低浓度或非细胞毒性浓度下可以增强细胞的自噬能力来改善癌症化疗[42].

图6 纳米材料导致多种细胞死亡方式的分子作用机制和相互联系
6 零维碳基纳米材料的理化表征对细胞毒性的影响
碳基纳米材料由于其成本效益高、毒性低、环保、荧光、发光性好、易于合成和表面钝化功能化等特点,应用越来越广泛,受到研究者的广泛关注[67],但是其可能导致的毒性效应也不容忽视.在毒理学研究领域,碳基纳米材料的暴露剂量肯定与其毒性效应密切相关.以GODs为例,低浓度剂量时GO不存在明显细胞毒性,但当浓度>250µg/mL时,50nm的GQDs对PC12细胞有着较为明显的细胞毒性,且细胞活力显著降低[68].研究者发现,碳基纳米材料的结构和理化性质同样可以影响其诱导的细胞死亡模式,但是其毒作用机制较为复杂.在大多数情况下,碳基纳米材料的细胞毒性可以由其晶体结构决定,其他的理化特性,包括形状、大小、表面反应、化学成分、面外电荷、过渡金属的存在、纳米拓扑结构和表面粗糙度等都不同程度地决定了其细胞毒性的大小.
6.1 尺寸
碳基纳米材料需要通过许多不同的方法进行制备、转移或改性,以获得独特的性能.尺寸是描述每个阶段的纳米材料的重要特征性指标之一,但与此同时,由于小尺寸和其所需的精度可以极大地影响碳基纳米材料的属性[69].越来越多的研究表明,碳基纳米材料的毒性和颗粒大小成反比.炭黑纳米粒子(CBNPs)是零维碳基纳米材料,以不同方式大量生产,当通过吸入暴露于肺部时,水溶性差的炭黑对健康构成威胁.不溶性颗粒的核心部分产生活性氧,对实验动物产生毒性[70].在封闭的反应室中,不动的炭黑聚集体基本上是100~1000nm大小范围内的细粉,在制造过程的最后步骤中,由于范德华力,形成更大的聚集体[71].
研究证实,尺寸小于100nm的纳米颗粒可以进入细胞,<35nm的颗粒能够跨越血脑屏障,<40nm的可以进入细胞核.当其直径<40nm时,毒性与尺寸呈正相关,即尺寸越小毒性越小;尺寸在100~500nm范围内时,毒性与大小呈负相关[72-73].
6.2 形貌与结构
随着纳米颗粒成像技术的发展,其形状与生物效应间的关系也受到越来越多的关注.形状各异的纳米颗粒与细胞膜的相互作用会产生些许差异,细胞膜上分子及细胞功能之间的内在运动都会对其附着的颗粒形状变化有不同程度的影响,由此导致细胞内吞作用的变化[74].C-dots由于其亲水性和细胞通透性,已经在很多应用领域取代了传统的金属量子点,包括光电、光催化和药物靶向[75].C60具有独特的笼状结构,其特殊的物理化学性质可能与独特的分子印迹有关[76].根据结构相异的富勒烯类化合物,从而体现出不同的细胞毒性,这表明了富勒烯的细胞毒性和它的化学结构具有密切相关性,富勒烯母体所连接的支链类型和数目会对该材料在体内的细胞毒性造成影响[77].经研究发现,毒性最高的是富勒烯母体,而随着侧链类型和数目的变化,细胞毒性呈明显下降趋势[78].
纳米金刚石[79]是碳基晶体纳米颗粒,在纳米尺度上继承了金刚石结构,具有优异的性能,如光学透明度、硬度和化学惰性[80].纳米金刚石的SP3四面体结构在1332cm-1处呈现拉曼信号,并且由于点缺陷而能够发荧光[81].然而,非荧光纳米金刚石显示出强烈的相干反斯托克斯拉曼散射效应.NDs细胞摄取的定量分析有望应用于生物标记和生物成像.有研究表明,纳米金刚石的氧化形式会破坏胚胎干细胞中的脱氧核糖核酸[82].
6.3 分散性
在不同浓度(200、400、600和800g/mL)下,有学者研究了直径为(6.5±2) nm的PEI包覆的CQDs基纳米杂化物对非洲绿猴肾上皮细胞的细胞毒作用.MTT分析显示,纳米杂化物在浓度为600g/mL时杀死了39%的细胞,尽管在较低浓度下没有明显的毒性迹象[83].对原始荧光碳量子点(~7nm)的细胞毒性进行了评估显示,量子点优先位于细胞表面,其暴露诱导氧化应激和降低细胞活力.作为细胞毒性最强的细胞,在浓度为100g/mL时,带正电荷的量子点在G0/G1期引发细胞周期的显著改变[84].有学者研究了羟基修饰的GQDs对人肺癌细胞株H1299和A549的不良作用.水动力直径为(10.3±1.9) nm的羟基量子点在浓度为50克/毫升时,显著降低了细胞活力和细胞内活性氧的生成.细胞信号通路分析显示羟基化的GQDs诱导两种类型细胞的G0/G1停滞、细胞衰老和抑制Rb磷酸化[85].经证实,长时间孵育后,GQDs对人乳腺癌(MCF-7)和人胃癌(MGC-803)细胞的细胞毒性较低.在小窝介导的胞吞作用后,纳米颗粒显著渗透到细胞的细胞质和细胞核中,但它们不影响细胞形态[86].
6.4 表面修饰
石墨烯的二维结构和化学功能赋予了其吸附各种化合物的能力,使其成为一种吸引表面增强拉曼光谱的纳米材料.Jablonska经研究发现,石墨烯是一种有效的荧光猝灭剂,可以提高拉曼光谱的质量,并通过化学机制提高拉曼光谱增强因子[87].相反,还原GO的化学灵活性使其能够在拉曼光谱活性载体上对分子或细胞进行可调性吸附,被应用于细胞的拉曼成像[88].当石墨晶体转化为纳米粒子时,围绕石墨粒子的边缘就出现了.外围区域周围开放边缘的存在导致了纳米石墨化合物的独特性能,不同于它们的封闭表面同类,如C60和CNTs[89].
碳量子点通常是直径小于10nm的准球形纳米粒子,由碳、氧、氢、氮和其他元素组成.由于其亲水性和细胞渗透性,碳量子点在许多应用中已经取代了传统的金属基量子点,包括光伏、光催化和药物靶向[90].氧化的碳量子点可能含有5%~50%的氧,这取决于合成程序.碳量子点通常在紫外-可见光谱中呈现两个光学吸收带[91].当碳纳米点被表示为2~10nm大小的π共轭单片时,它们被称为石墨烯量子点[92].研究表明,石墨烯量子点具有磁性、电子和光学特性.
7 本团队相关研究成果
近年来,随着碳基纳米材料应用研究的广泛开展,本团队同样意识到其生物安全性评价的重要性.本课题组对纳米材料暴露导致的多种细胞死亡方式早有研究[93-95],近期就零维碳基纳米材料中的GQDs进行了深入的生物安全性评价和毒效应机制研究.虽然GQDs的成分没有任何毒性,但是其与单纯的碳元素有所不同,一定剂量和一定时间的暴露依然导致了生物体的负面生物效应,尤其是其对细胞内的遗传物质具有较大的影响,最终可能会导致较为严重的毒性后果,包括细胞死亡[96-97].这些研究成果与研究者已经归纳总结的纳米材料与细胞相互作用后诱导产生细胞毒性的作用机制一致[98]:纳米材料与DNA发生作用,破坏DNA片段结构,抑制细胞周期的分裂和蛋白质的合成.
基于已有的纳米材料导致细胞死亡效应的研究基础,本课题组重点探讨了GQDs导致的一种新型细胞死亡方式——铁死亡及其作用机制.铁死亡是2012年学者Dixon首次报道并命名的一种铁依赖性并伴随脂质过氧化反应的细胞非凋亡性程序性坏死,诱导肿瘤细胞铁死亡是目前癌症治疗领域一个新兴热点[100].我们的研究结果显示不同化学修饰的GQDs可以诱发神经细胞的铁死亡效应,不但强调了对所谓低毒组分的新型纳米材料进行生物安全性评价的重要性,而且也为神经系统肿瘤的治疗提供了新的研究方向[99].
8 结语
目前大部分针对零维碳基纳米材料的细胞毒性研究仍然聚焦在凋亡、自噬和坏死.研究GQDs导致的铁死亡效应以及背后的分子调控机制,不但可以为其在肿瘤治疗方面的应用提供一定数据,也为GQDs的生物安全性评价提供了新的研究思路.
建议毒理学家在未来可以通过以下几个方面改进纳米材料细胞毒性研究:使用多种细胞来反映纳米材料对正常细胞和癌细胞的毒性效应,分析其相似和不同,将纳米毒理学研究真正应用于实际的医学应用;模拟病理生理条件,更好地预测纳米材料在不同体内条件下的毒性;加入生物分子,反映特定生物微环境下纳米材料与生物分子间的相互作用;重点关注纳米材料的理化性质对毒性效应的影响,优化纳米材料的制备,从源头降低普通纳米材料的毒性,研制具有特殊作用的纳米材料.
[1] Ramos A P, Cruz M a E, Tovani C B, et al. Biomedical applications of nanotechnology [J]. Biophysical Reviews, 2017,9(2):79-89.
[2] 张 浩,朱庆明,刘秀玉,等.纳米材料的暴露途径及安全性研究 [J]. 化工新型材料, 2014,42(9):223-226.
Zhang H, Zhu Q M, Liu X Y, et al. Study on exposure pathway and safety of nanomaterials [J]. New Chemical Materials, 2014,42(9):223- 226.
[3] 周子靖,张金波,朱金玲,等.纳米材料的细胞毒性研究进展 [J]. 中国优生与遗传杂志, 2016,24(4):5-6,11.
Zhou Z J, Zhang J B, Zhu J L, et al. Research Progress on cytotoxicity of nanomaterials [J]. Chinese Journal of Birth Health & Heredity, 2016,24(4):5-6,11.
[4] Chen C M, Hu Z G, Liu S B, et al. Emerging trends in regenerative medicine: A scientometric analysis in CiteSpace [J]. Expert Opinionon Biological Therapy, 2012,12(5):593-608.
[5] Raja I S, Song S J, Kang M S, et al. Toxicity of zero- and one- dimensional carbon nanomaterials [J]. Nanomaterials (Basel), 2019, 9(9):1214.
[6] Georgakilas V, Tiwari J N, Kemp K C, et al. Noncovalent functionalization of graphene and graphene oxide for energy materials, biosensing, catalytic, and biomedical applications [J]. Chemical Reviews, 2016,116(9):5464-5519.
[7] Mendes P M. Cellular nanotechnology: making biological interfaces smarter [J]. Chemical Society Reviews, 2013,42(24):9207-9218.
[8] Bressan E, Ferroni L, Gardin C, et al. Graphene based scaffolds effects on stem cells commitment [J]. Journal of Translation Medicine, 2014, 12:296.
[9] 李 炜,赵 峰,陈春英,等.碳纳米材料的细胞生物效应 [J]. 化学进展, 2009,21(2/3):430-435.
Li W, Zhao F, Chen C Y, et al. Cellular biological effects of carbon nanomaterials [J]. Progress in Chemistry, 2009,21(2/3):430-435.
[10] Kostarelos K, Lacerda L, Pastorin G, et al. Cellular uptake of functionalized carbon nanotubes is independent of functional group and cell type [J]. Nature Nanotechnology, 2007,2(2):108-113.
[11] Lin I C, Liang M, Liu T Y, et al. Interaction of densely polymer- coated gold nanoparticles with epithelial Caco-2monolayers [J]. Biomacromolecules, 2011,12(4):1339-1348.
[12] Latour R A. Molecular simulation of protein-surface interactions: benefits, problems, solutions, and future directions [J]. Biointerphases, 2008,3(3):FC2-12.
[13] Sorahan T, Hamilton L, Van Tongeren M, et al. A cohort mortality study of U.K. carbon black workers, 1951-1996 [J]. American Journal of Industral Medicine, 2001,39(2):158-170.
[14] Yuan X, Nie W, He Z, et al. Carbon black nanoparticles induce cell necrosis through lysosomal membrane permeabilization and cause subsequent inflammatory response [J]. Theranostics, 2020,10(10): 4589-4605.
[15] Guan S, Tao S, Huang Y, et al. Combined toxic effects of CBNPs and Pb on rat alveolar macrophage apoptosis and autophagy flux [J]. Ecotoxicology and Environmental Safety, 2020,205:111062.
[16] Chauhan S, Jain N, Nagaich U. Nanodiamonds with powerful ability for drug delivery and biomedical applications: Recent updates on in vivo study and patents [J]. Journal of Pharmaceutical Analysis, 2020, 10(1):1-12.
[17] Sachdeva M S. Drug targeting systems for cancer chemotherapy [J]. Expert Opinion on Investigtional Drugs, 1998,7(11):1849-1864.
[18] Fan F Y, Liu J S, Li H D. Combining nanodiamond and all trans retinoic acid to increase the apoptosis of HL-60cell [J]. Materials Letters, 2014,133:262-265.
[19] Li T F, Xu Y H, Li K, et al. Doxorubicin-polyglycerol-nanodiamond composites stimulate glioblastoma cell immunogenicity through activation of autophagy [J]. Acta Biomaterialia, 2019,86:381-394.
[20] Kim H J, Zhang K, Moore L, et al. Diamond nanogel-embedded contact lenses mediate lysozyme-dependent therapeutic release [J]. Acs Nano, 2014,8(3):2998-3005.
[21] Wu M S, Sun D S, Lin Y C, et al. Nanodiamonds protect skin from ultraviolet B-induced damage in mice [J]. Journal of Nanobiotechnology, 2015,13:35.
[22] Yuan X, Zhang X X, Sun L, et al. Cellular toxicity and immunological effects of carbon-based nanomaterials [J]. Particle and Fibre Toxicology, 2019,16(1):18.
[23] Jia G, Wang H F, Yan L, et al. Cytotoxicity of carbon nanomaterials: Single-wall nanotube, multi-wall nanotube, and fullerene [J]. Environmental Science & Technology, 2005,39(5):1378-1383.
[24] Fiorito S, Serafino A, Andreola F, et al. Effects of fullerenes and single-wall carbon nanotubes on murine and human macrophages [J]. Carbon, 2006,44(6):1100-1105.
[25] Yamawaki H, Iwai N. Cytotoxicity of water-soluble fullerene in vascular endothelial cells [J]. American Journal of Physiology. Cell Physiology, 2006,290(6):C1495-502.
[26] Harhaji L, Isakovic A, Raicevic N, et al. Multiple mechanisms underlying the anticancer action of nanocrystalline fullerene [J]. European Journal of Pharmacology, 2007,568(1-3):89-98.
[27] Tang D S, Liu J J, Yan X M, et al. Graphene oxide derived graphene quantum dots with different photoluminescence properties and peroxidase-like catalytic activity [J]. RSC Advances, 2016,6(56): 50609-50617.
[28] Yuan X C, Liu Z M, Guo Z Y, et al. Cellular distribution and cytotoxicity of graphene quantum dots with different functional groups [J]. Nanoscale Reseach Letters, 2014,9(1):108.
[29] Markovic Z M, Ristic B Z, Arsikin K M, et al. Graphene quantum dots as autophagy-inducing photodynamic agents [J]. Biomaterials, 2012,33(29):7084-7092.
[30] Felix’s D M, Rebelo L M, Alencar R, et al. Graphene quantum dots decorated with imatinib for leukemia treatment [J]. Journal of Drug Delivery Science and Technology, 2020,61(5):10.1016/j.jddst.2020. 102110.
[31] Chong Y, Ma Y, Shen H, et al. The in vitro and in vivo toxicity of graphene quantum dots [J]. Biomaterials, 2014,35(19):5041-5048.
[32] Qin Y, Zhou Z W, Pan S T, et al. Graphene quantum dots induce apoptosis, autophagy, and inflammatory response via p38 mitogen- activated protein kinase and nuclear factor-kappaB mediated signaling pathways in activated THP-1macrophages [J]. Toxicology, 2015, 327:62-76.
[33] Manisha H, Priya Swetha P D, Shim Y-B, et al. Revisiting fluorescent carbon nanodots for environmental, biomedical applications and puzzle about fluorophore impurities [J]. Nano-Structures & Nano- Objects, 2019,20:100391.
[34] Ostadhossein F, Pan D. Functional carbon nanodots for multiscale imaging and therapy [J]. Wiley Interdisciplinary Reviews- Nanomedicine and Nanobiotechnology, 2017,9(3):10.1002/wnan. 1436.
[35] Madannejad R, Shoaie N, Jahanpeyma F, et al. Toxicity of carbon-based nanomaterials: Reviewing recent reports in medical and biological systems [J]. Chemico-Biological Interactions, 2019,307: 206-222.
[36] Mohammadinejad R, Moosavi M A, Tavakol S, et al. Necrotic, apoptotic and autophagic cell fates triggered by nanoparticles [J]. Autophagy, 2019,15(1):4-33.
[37] Nishizawa C, Hashimoto N, Yokoo S, et al. Pyrrolidinium-type fullerene derivative-induced apoptosis by the generation of reactive oxygen species in HL-60cells [J]. Free Radical Research, 2009, 43(12):1240-1247.
[38] Markovic Z M, Ristic B Z, Arsikin K M, et al. Graphene quantum dots as autophagy-inducing photodynamic agents [J]. Biomaterials, 2012, 33(29):7084-7092.
[39] Fan F, Liu J, Li H. Combining nanodiamond and all trans retinoic acid to increase the apoptosis of HL-60cell [J]. Materials Letters, 2014, 133:262-265.
[40] Lao F, Chen L, Li W, et al. Fullerene nanoparticles selectively enter oxidation-damaged cerebral microvessel endothelial cells and inhibit JNK-related apoptosis [J]. Acs Nano, 2009,3(11):3358-3368.
[41] Li T F, Xu Y H, Li K, et al. Doxorubicin-polyglycerol-nanodiamond composites stimulate glioblastoma cell immunogenicity through activation of autophagy [J]. Acta Biomaterials, 2019,86:381-394.
[42] Zhang Q, Yang W, Man N, et al. Autophagy-mediated chemosensitization in cancer cells by fullerene C60nanocrystal [J]. Autophagy, 2009,5(8):1107-1117.
[43] Demir E, Nedzvetsky V S, Ağca C A, et al. Pristine C 60 fullerene nanoparticles ameliorate hyperglycemia-induced disturbances via modulation of apoptosis and autophagy flux [J]. Neurochemical Research, 2020,45:10.1007/S11064-020-03097-w.
[44] Edinger A L, Thompson C B. Death by design: apoptosis, necrosis and autophagy [J]. Current Opinion on Cell Biology, 2004,16(6):663-669.
[45] Wielgus A R, Zhao B, Chignell C F, et al. Phototoxicity and cytotoxicity of fullerol in human retinal pigment epithelial cells [J]. Toxicology and Applied Pharmacology, 2010,242(1):79-90.
[46] Isakovic A, Markovic Z, Todorovic-Markovic B, et al. Distinct cytotoxic mechanisms of pristine versus hydroxylated fullerene [J]. Toxicological Science, 2006,91(1):173-183.
[47] Bergsbaken T, Fink S L, Cookson B T. Pyroptosis: host cell death and inflammation [J]. Nature Reviews Microbiology, 2009,7(2):99-109.
[48] Reisetter A C, Stebounova L V, Baltrusaitis J, et al. Induction of inflammasome-dependent pyroptosis by carbon black nanoparticles [J]. Journal of Biological Chemistry, 2011,286(24):21844-21852.
[49] Wu J R, Tuo Q Z, Lei P. Ferroptosis, a recent defined form of critical cell death in neurological disorders [J]. Journal of Molecular Neuroscience, 2018,66(2):197-206.
[50] Yu H, Guo P, Xie X, et al. Ferroptosis, a new form of cell death, and its relationships with tumourous diseases [J]. Journal of Cell Molecular Medicine, 2017,21(4):648-657.
[51] Wu T, Liang X, Liu X, et al. Induction of ferroptosis in response to graphene quantum dots through mitochondrial oxidative stress in microglia [J]. Partical and Fibre Toxicology, 2020,17(1):30.
[52] Petrie E J, Czabotar P E, Murphy J M. The structural basis of necroptotic cell death signaling [J]. Trends in Biochemical Science, 2019,44(1):53-63.
[53] Zhou B, Liu J, Kang R, et al. Ferroptosis is a type of autophagy- dependent cell death [J]. Seminars in Cancer Biology, 2019:1475- 1504.
[54] Sharifi M, Hosseinali S H, Saboury A A, et al. Involvement of planned cell death of necroptosis in cancer treatment by nanomaterials: Recent advances and future perspectives [J]. Journal of Controlled Release, 2019,299:121-137.
[55] Sharifi M, Hosseinali S H, Saboury A A, et al. Involvement of planned cell death of necroptosis in cancer treatment by nanomaterials: Recent advances and future perspectives [J]. Journal of Controlled Release, 2019,299:121-137.
[56] Amaravadi R K, Thompson C B. The roles of therapy-induced autophagy and necrosis in cancer treatment [J]. Clinical Cancer Research, 2007,13(24):7271-7279.
[57] Djavaheri-Mergny M, Maiuri M C, Kroemer G. Cross talk between apoptosis and autophagy by caspase-mediated cleavage of Beclin 1 (vol 29, pg 1717,2010) [J]. Oncogene, 2010,29(49):6508-6519.
[58] Fimia G M, Piacentini M. Regulation of autophagy in mammals and its interplay with apoptosis [J]. Cellular and Molecular Life Sciences, 2010,67(10):1581-1588.
[59] Kessel D. Apoptosis, paraptosis and autophagy: Death and survival pathways associated with photodynamic therapy [J]. Photochemistry and Photobiology, 2019,95(1):119-125.
[60] Grootjans S, Vanden Berghe T, Vandenabeele P. Initiation and execution mechanisms of necroptosis: an overview [J]. Cell Death & Differentiation, 2017,24(7):1184-1195.
[61] Wu Y T, Tan H L, Huang Q, et al. zVAD-induced necroptosis in L929cells depends on autocrine production of TNF alpha mediated by the PKC-MAPKs-AP-1pathway [J]. Cell Death & Differentiation, 2011,18(1):26-37.
[62] Bray K, Mathew R, Lau A, et al. Autophagy suppresses RIP kinase- dependent necrosis enabling survival to mTOR inhibition [J]. Plos One, 2012,7(7):26-37.
[63] Nikoletopoulou V, Markaki M, Palikaras K, et al. Crosstalk between apoptosis, necrosis and autophagy [J]. Biochemica ET Biophysica ACTA-Molecular Cell Research, 2013,1833(12):3448-3459.
[64] Tait S W G, Ichim G, Green D R. Die another way - non-apoptotic mechanisms of cell death [J]. Journal of Cellular Science, 2014, 127(10):2135-2144.
[65] Felix D M, Rebelo Alencar L M, Duarte De Menezes F, et al. Graphene quantum dots decorated with imatinib for leukemia treatment [J]. Journal of Drug Delivery Science and Technology, 2020: 26-37.
[66] Xu Q, Li W, Ding L, et al. Function-driven engineering of 1D carbon nanotubes and 0D carbon dots: mechanism, properties and applications [J]. Nanoscale, 2019,11(4):1475-1504.
[67] 邓邦莲,陈雪峰,孟 蕾,等.不同粒径的石墨烯量子点在PC12细胞中的成像效应及细胞毒性 [J]. 武警医学, 2018,29(9):901-904.
Deng B L, Chen X F, Meng L, et al. Biological imaging effect and biocompatibility of graphene quantum dots (GQDs) of different size in PC12cells [J]. Medical Journal of the Chinese People's Armed Police Force, 2018,29(9):901-904.
[68] Kroner A, Hirsch T. Current trends in the optical characterization of two-dimensional carbon nanomaterials [J]. Frontiers in Chemistry, 2019,7:10.3389/fchem.2019.00927.
[69] Jackson P, S K, Oslash, et al. Pulmonary exposure to carbon black by inhalation or instillation in pregnant mice: Effects on liver DNA strand breaks in dams and offspring [J]. Nanotoxicology, 2012,6(5):26-37.
[70] Husain M, Kyjovska Z O, Bourdon-Lacombe J, et al. Carbon black nanoparticles induce biphasic gene expression changes associated with inflammatory responses in the lungs of C57BL/6mice following a single intratracheal instillation [J]. Toxicology and Applied Pharmacology, 2015,289(3):438-448.
[71] Liu Y Y, Luo Y, Wu J, et al. Graphene oxide can induce in vitro and in vivo mutagenesis [J]. Scientific Report-Uk, 2013,3:10.10381/ srepo3469.
[72] Ma J, Liu R, Wang X, et al. Crucial role of lateral size for graphene oxide in activating macrophages and stimulating pro-inflammatory responses in cells and animals [J]. ACS Nano, 2015,9(10):10498- 10515.
[73] Huang X, Teng X, Chen D, et al. The effect of the shape of mesoporous silica nanoparticles on cellular uptake and cell function [J]. Biomaterials, 2010,31(3):438-448.
[74] Xiao Y Y, Liu L, Chen Y, et al. Developmental toxicity of carbon quantum dots to the embryos/larvae of rare minnow () [J]. Biomed Research International, 2016,2016:4016402.
[75] Chen M, Zhou S, Zhu Y, et al. Toxicity of carbon nanomaterials to plants, animals and microbes: Recent progress from 2015-present [J]. Chemosphere, 2018,206:255-264.
[76] 倪 瑾.富勒烯新衍生物的合成、细胞毒性和放射细胞生物学活性研究 [D]. 上海:第二军医大学, 2006.
Ni J. Synthesis of new fullerence derivatives and studies on their cytotoxicity, radiobiological cellular activity [D]. Shanghai: Second Military Medical University, 2006.
[77] Rancan F, Rosan S, Boehm F, et al. Cytotoxicity and photocytotoxicity of a dendritic C(60) mono-adduct and a malonic acid C(60) tris- adduct on Jurkat cells [J]. Journal of Photochemitry and Photobiology B, 2002,67(3):157-162.
[78] Abdolahpur Monikh F, Grundschober N, Romeijn S, et al. Development of methods for extraction and analytical characterization of carbon-based nanomaterials (nanoplastics and carbon nanotubes) in biological and environmental matrices by asymmetrical flow field- flow fractionation [J]. Environmental Pollution, 2019,255(2):10.1016/ j.envpol.2019.113304.
[79] Zhang X, Yin J, Kang C, et al. Biodistribution and toxicity of nanodiamonds in mice after intratracheal instillation [J]. Toxicology Letters, 2010,198(2):237-243.
[80] Lin Y C, Wu K T, Lin Z R, et al. Nanodiamond for biolabelling and toxicity evaluation in the zebrafish embryo in vivo [J]. Journal of Biophotonics, 2016,9(8):438-448.
[81] Silbajoris R, Linak W, Shenderova O, et al. Detonation nanodiamond toxicity in human airway epithelial cells is modulated by air oxidation [J]. Diamond and Related Materials, 2015,58:16-23.
[82] Emam A N, Loutfy S A, Mostafa A A, et al. Cyto-toxicity, biocompatibility and cellular response of carbon dots–plasmonic based nano-hybrids for bioimaging [J]. RSC Advances, 2017,7(38):23502- 23514.
[83] Havrdova M, Hola K, Skopalik J, et al. Toxicity of carbon dots – Effect of surface functionalization on the cell viability, reactive oxygen species generation and cell cycle [J]. Carbon, 2016,99:238-248.
[84] Tian X, Xiao B B, Wu A, et al. Hydroxylated-graphene quantum dots induce cells senescence in both p53-dependent and -independent manner [J]. Toxicology research, 2016,5(6):432-439.
[85] Wu C Y, Wang C, Han T, et al. Insight into the cellular internalization and cytotoxicity of graphene quantum dots [J]. Advanced healthcare materials, 2013,2(12):32-38.
[86] Jablonska A, Jaworska A, Kasztelan M, et al. Graphene and graphene oxide applications for SERS sensing and imaging [J]. Current Medicinal Chemistry, 2019,26(38):6878-6895.
[87] Plonska-Brzezinska M E. Carbon Nanomaterials: Perspective of their Applications in Biomedicine [J]. Current Medical Chemistry, 2019, 26(38):6832-6833.
[88] Tarasenka N, Stupak A, Tarasenko N, et al. Structure and optical properties of carbon nanoparticles generated by laser treatment of graphite in liquids [J]. Chemphyschem, 2017,18(9):1074-1083.
[89] Xiao Y Y, Liu L, Chen Y, et al. Developmental Toxicity of Carbon Quantum Dots to the Embryos/Larvae of Rare Minnow ( Gobiocypris rarus ) [J]. BioMed research international, 2016,2016:4016402.
[90] Xu Y, Tang C-J, Huang H, et al. Green synthesis of fluorescent carbon quantum dots for detection of Hg2+[J]. Chinese Journal of Analytical Chemistry, 2014,42(9):438-448.
[91] Cayuela A, Soriano M L, Carrillo-Carrión C, et al. Semiconductor and carbon-based fluorescent nanodots: the need for consistency [J]. Chemical Communications, 2016,52(7):1311-1326.
[92] Liang X, Wu T, Wang Y, et al. CdTe and CdTe@ZnS quantum dots induce IL-1ss-mediated inflammation and pyroptosis in microglia [J]. Toxicology in Vitro, 2020,65:10.1016/j.tiv.2020.104827.
[93] Wu T, Liang X, He K, et al. The role of NLRP3 inflammasome activation in the neuroinflammatory responses to Ag2Se quantum dots in microglia [J]. Nanoscale, 2019,11(43):20820-20836.
[94] Wu T S, Zhang S H, Liang X, et al. The apoptosis induced by silica nanoparticle through endoplasmic reticulum stress response in human pulmonary alveolar epithelial cells [J]. Toxicology in Vitro, 2019, 56:126-132.
[95] Wu T S, Liang X, Li Y M, et al. Differentially expressed profiles of long non-coding RNA in responses to graphene quantum dots in microglia through analysis of microarray data [J]. Nanoimpact, 2020, 19:10.1016/j.impact.2020.100244.
[96] Liang X, Wu T S, Tang M. Microarray analysis of gene expression differences in microglia after exposure to graphene quantum dots [J]. Science of the Total Environment, 2020,749:10.1016/j.scitotenv. 2020.141385.
[97] Lai D Y. Toward toxicity testing of nanomaterials in the 21st century: a paradigm for moving forward [J]. Wiley Interdisciplinary Reviews Nanomedicine and Nanobiotechnology, 2012,4(1):1-15.
[98] Wu T S, Liang X, Liu X, et al. Induction of ferroptosis in response to graphene quantum dots through mitochondrial oxidative stress in microglia [J]. Particle and Fibre Toxicology, 2020,17(1):238-239.
[99] Dixon S J, Lemberg K M, Lamprecht M R, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death [J]. Cell, 2012,149(5): 1060-1072.
Research advances on the cytotoxic effects of zero-dimensional carbon-based nanomaterials.
LI Yi-meng1, LIU Xi2, WU Tian-shu1*
(1.The Key Laboratory of Environmental Medicine Engineering, School of Public Health, Southeast University, Nanjing 210009, China;2.School of Medicine, Southeast University, Nanjing 210009, China)., 2021,41(9):
The main pathways of carbon-based nanomaterials entering into cells were introduced in this paper, and the analysis of different forms of cell death caused by several commonly used zero-dimensional carbon-based nanomaterials and their potential toxic mechanisms was focused on. The physical and chemical factors affecting the cell death induced by carbon-based nanomaterials were elaborated as well. Finally, the prospects of toxicity study of carbon-based nanomaterials based on our findings were provided in this review, which benefits the design optimization and wider application of carbon-based nanomaterials in the future.
carbon-based nanomaterials;bibliometrics;nanotoxicology;cell death
X503.1,X171.5
A
1000-6923(2021)09-4402-13
李依檬(1998-),女,四川成都人,本科生,主要从事劳动与卫生保障专业研究.
2021-01-28
国家自然科学基金(82103884);江苏省基础研究计划(BK20180371);中央高校基本科研业务费专项资金(2242020K40192);东南大学至善青年学者项目(2242020R40140)
* 责任作者, 讲师, ninatswu@seu.edu.cn, ninatswu@126.com

