鱼类转录组学研究概况
段晓晨,程起群
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学水产与生命学院,上海 201306)
现代高通量测序技术的迅速发展,使得通过不同方式来获得鱼类基因信息的过程变得更加快捷高效,转录组测序的对象变得更加广泛,精准率也得到了明显提高。第二代测序技术出现后,鱼类的转录组学研究达到了空前的热度。但是,测序技术的迅猛发展也逐渐暴露出一些问题,鱼类转录组学的发展面临着新的挑战,例如:缺乏大量的基因组信息、恶劣环境下的鱼类样本难以采集和有效保存、单细胞转录组测序技术应用少等。本文对转录组学技术的发展历程及其在鱼类研究中的应用概况进行了介绍,并对鱼类转录组学的研究进行了总结与展望。
1 转录组与转录组学的含义
转录组学、代谢组学和蛋白质组学等各种组学技术陆续出现,其中转录组学技术率先取得进步并被认为是应用最为深入的技术手段之一[1]。遗传学的中心法则显示:DNA上的一系列遗传信息可以经由生物细胞内的信使RNA(mRNA)在各项程序的精密调控下传递给蛋白质。因此,科学家们认为,RNA在DNA与蛋白质之间承担着生物信息传递的“纽带”职能,而所有能够进行表达的基因所转录出的RNA及其转录水平,综合起来被称为转录组(transcriptome)[2]。转录组最重要的特点是特定的时间性和空间性,转录组研究不仅反映了个体的特定组织在某种生长发育阶段下基因的表达水平,还可以用来比较同一部位在不同生存环境下基因表达水平的不同,这正是由转录组所具有的时间特性和空间特性所决定的[3]。转录组分为广义转录组和狭义转录组,其中细胞或组织所转录出来的RNA总和被称为广义转录组,细胞中参与翻译蛋白质的所有mRNA的总和则被称为狭义转录组[3]。而转录组学(transcriptomics)则是指一门在整体水平上研究细胞中基因转录的情况及转录调控规律的学科[1]。
2 转录组学技术的优点
随着生物个体所处生长发育阶段的不同及其生理状态与外界环境的改变,该生物个体的转录组信息也随之而改变。因此,为了更完整地研究生物生长发育、应激免疫等生理作用机制,将转录组分析作为重要的研究途径是必然的。通过对转录组图谱的全面分析,能够获得如基因表达信息、反义转录本、可变剪接、差异表达基因和新基因等众多信息[4]。相对于基因组分析而言,转录组分析的优点除了所需要的花费大大减少以外,其针对性也相对更强,从转录组中筛选的遗传标记可直接进行应用[5]。
转录组学技术具有许多优点:
(1)灵敏度较高,因此可以检测和定额痕量的RNA;
(2)不需预先得到所要研究物种的基因信息,因此适用于无参考基因序列的物种;
(3)获得的数据丰富;
(4)能够获得细胞或组织中全部的RNA信息。通过将RNA反转录为cDNA的方式进行测序,开发大量的单核苷酸多态性(single nucleotide polymorphism,SNP)标记和微卫星(simple sequence repeats,SSR)标记,并进行可变剪接的研究和定量分析[6-7]。
3 转录组学技术分类与流程
3.1 转录组学技术分类
由于转录组所具有的技术复杂性,一系列具有相应高通量的转录组学技术应运而生。转录组学技术主要包括以测序和杂交为基础的两类技术[4,8],目前这两类技术作为良好的研究工具均在鱼类的转录组学研究中得到了普遍运用。
依据不同的原理,可以将转录组学技术划分为两类[9],如表1所示。

表1 转录组学技术的分类及优点Tab.1 Classification and advantages of transcriptomics technology
测序技术的进步促进了转录组学研究的快速发展。20世纪70年代末,SANGER等[14]发明了双脱氧终止法,从而使DNA序列的高效测定成为可能,第一代测序技术由此诞生。第一代测序技术优点很明显,如读长可达300~1 000 bp、准确度高、可对高重复序列进行测序。但是由于自动化水平较低、测序通量较低且对基因的定量存在一定的偏差,因此限制了其在转录组学研究中的应用[15]。
继第一代测序技术得到普遍应用后,以第二代测序技术(next generation sequencing,NGS)为代表的高通量测序技术在鱼类转录组研究领域得到了稳步发展[16]。第二代测序技术的读长最高为2×150 bp,弥补了第一代测序技术阅读通量低、自动化程度低的缺陷,同时显著地提高了测序速度并减少了测序成本[17-18]。目前在研究中应用较多的测序方法为第二代测序技术,然而第二代测序技术仍存在着诸多问题,如读长相对较短,测序之后还需要复杂的拼接过程[19]。
近年来,随着第三代转录组测序技术的兴起,在很大程度上解决了第二代测序技术所存在的问题。第三代测序技术能够做到单分子实时测序,而且测序过程中免除了PCR扩增步骤,除此之外,还具有超长的读长功能。第三代测序技术在转录组学研究中可以更好地纠正错误拼接的基因,检测选择性剪切(alternative splicing)与多聚腺苷酸化(alternative polyadenylation,APA),鉴定长链非编码RNA(lncRNA),鉴定新基因等[20]。
3.2 转录组学技术流程
转录组测序流程和项目分析的流程[8]如图1所示。
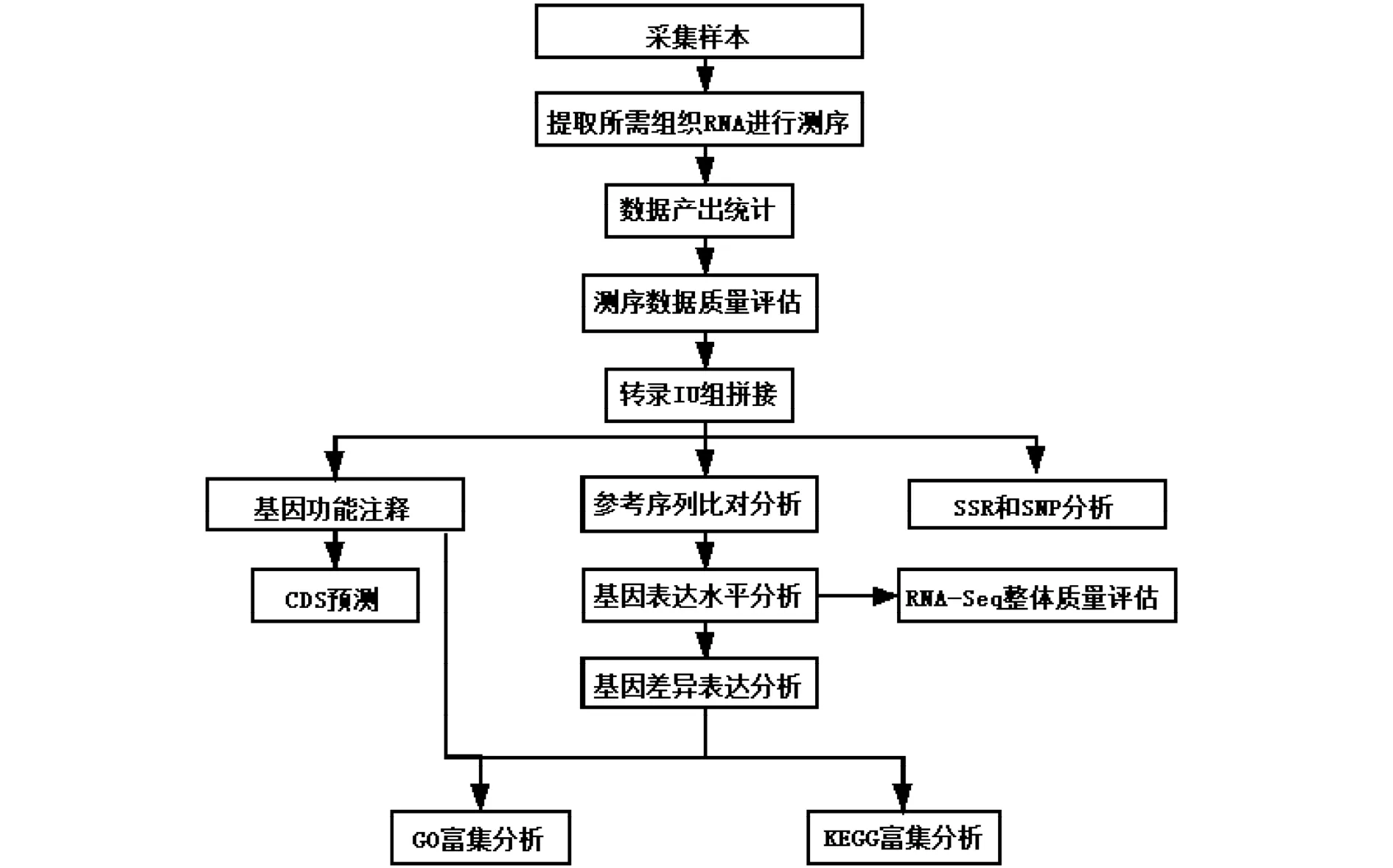
图1 转录组测序流程和项目分析的流程Fig.1 Transcriptome sequencing process and project analysis process
为了避免组织中RNA的降解,转录组测序流程中的样本采集和处理需要快速完成,其关键步骤为:首先将RNA保存液按样品量的5~10倍加入到冻存管中,然后将采集的生物样本麻醉,待麻醉剂起作用后将样本解剖,取出所需组织立即放入RNA保存液中(注意将组织切割成小于5 mm的小片),做好标记后置于4℃冰箱过夜,然后转入-20℃冰箱,最后按照步骤提取RNA。
4 转录组学技术在鱼类研究中的应用
高通量测序技术的快速发展,使通过不同途径来获得鱼类基因信息的过程变得更加便捷高效,转录组测序范围变得更加广泛,精确率也得到了显著的提高。研究者们可以从整体上集中对基因的功能、信号通路、基因的表达模式等方面进行全新的研究[11]。目前,转录组分析被广泛应用于分析鱼类发育生物学,研究包括化学胁迫、温度胁迫等环境胁迫对基因表达的影响,研究生物的适应性进化等。
4.1 在鱼类发育生物学研究中的应用
鱼类遗传育种、人工繁殖、动物胚胎与生殖工程等技术的发展和应用要求对鱼类生殖细胞的发生、受精等过程进行更为深入地研究,因此运用转录组学技术开展鱼类发育生物学各个领域的研究工作正在稳步进行中。
袁静[21]应用第二代测序技术对尼罗罗非鱼(Oreochromis niloticus)性腺发育的关键时期(孵化后5、30、90和180 d)进行高通量测序,发现在其性腺中共有21 334个基因得到表达,其中有21 006个基因在雌、雄性腺中均得到表达,有259个基因特异表达于雄鱼性腺,而仅有69个基因在雌鱼性腺中得到特异表达。该研究建立了当时尼罗罗非鱼中最大的性腺转录组数据库,转录组数据进一步证明雌激素对罗非鱼的性别决定和维持有重要作用。CHAPMAN等[22]利用454焦磷酸测序法对条纹鲈(Morone saxatilis)的卵巢进行了研究,共得到230 151个表达序列。通过Blastx比对获得的5 482个直系同源基因中,有4 120个得到GO(gene ontology)注释,其中与繁殖和发育过程有关的基因超过 1 300 个。GUDBRANDSSON等[23]将转录组学分析运用到来自于不同群体的北极红点鲑(Salvelinus alpinus)胚胎发育的4个阶段,发现一些与生物途径相关的基因表达量有差异,而和血液凝结与能量代谢相关的基因却在鲑鱼的不同群体中实现了差异性表达。何飞祥[16]利用RNA测序(RNA sequencing,RNA-Seq)技术对金钱鱼(Scatophagus argus)发育成熟的精巢和卵巢进行高通量测序并构建了cDNA文库,组装获得136 561个unigene,然后通过与数据库比对后获得大量注释信息,通过筛选得到32 122个差异表达基因,其中在精巢中高表达的有11 156个,在卵巢中高表达的有20 966个。
4.2 在鱼类受环境胁迫研究中的应用
不同的养殖环境会对鱼类组织的生理生化水平造成不同程度的影响,分析鱼类组织在环境胁迫下的转录组变化及其涉及到的调控机理可以揭示鱼体针对不同环境改变所做出的生长发育、物质代谢、免疫调控及相关信号通路的响应。因此,转录组分析被广泛应用于研究鱼类基因表达受环境胁迫的影响领域。
王美垚[24]首先研究了降温与升盐的协同作用对刀鲚(Coilia nasus)(同种异名C.ectenes)幼鱼脑组织转录组的影响,共得到4 721个差异表达基因,其中上调表达的基因有2 028个,下调表达的基因有2 693个,然后进一步分析得到差异最显著的前十名GO注释条目。结果显示差异最显著的基因主要涉及“突触传导”“神经信号传导”等生物过程。李永娟[25]对热激组的6尾虹鳟(Oncorhynchus mykiss)和对照组进行转录组测序,热激组与对照组共获得27 796个mRNA,其中两个组共有24 012个,热激组独有2 332个,对照组独有1 452个;以q-value<0.05为临界阈值,在受到热应激后共有128个肝脏基因的表达水平出现明显差异。这为进一步揭示虹鳟热应激反应的分子调控机理及拓展有关基因在应对未来气候变化中的运用奠定了大量数据基础。朱婷芳等[26]采用Illumina Hiseq 4000平台对大弹涂鱼(Boleophthalmus pectinirostris)进行高通量测序后获得该鱼短时低氧胁迫相关的转录组数据,低氧胁迫处理组中累计获得4 487个DEGs,其中包括2 507个上调的DEGs和1 980个下调的DEGs。其中低氧诱导组转录本的表达未发现显著变化,而3-磷酸甘油醛脱氢酶和血管内皮生长因子基因转录本的表达则上调。
4.3 在鱼类适应性进化研究中的运用
通过分子生物学手段研究生物的环境适应性及其遗传与变异是进化生物学领域所面临的机遇与挑战,而转录组学技术提供了一种对生物体在不同状态下基因的差异表达状态进行深入探究的工具。因此,转录组分析近年来也应用于研究鱼类的适应性进化方面。
JEUKENS等[27]利用RNA-Seq技术研究了短小型和正常鲱形白鲑(Coregonus clupeaformis)的转录组变化,结果显示正常鲱形白鲑高表达的基因主要集中在蛋白质的合成途径,而短小型高表达的基因主要位于免疫、DNA复制和修复等过程。俞孟超[28]选择分布于不同海拔的两种裂腹鱼类,软刺裸鲤(Gymnocypris dobula)和怒江裂腹鱼(Schizothorax nukiangensis),同生活在平原的鲤科鱼类斑马鱼(Danio rerio)作比较分析,应用Illumina平台进行转录组测序,获得两种裂腹鱼类共8个组织的测序原始reads,对预测的编码基因进行注释,共计得到11 007个单拷贝直系同源基因以用于后续的进化分析。结果显示,环境改变使裂腹鱼类发生了快速进化,且两种裂腹鱼对高原的适应机制可能是不同的。赵胤丞[29]运用二代测序技术对软鳍金线鲃(地表种)(Sinocyclocheilus malacopterus)和犀角金线鲃(洞穴种)(S.rhinocerous)进行了脑组织转录组测序,筛选得到的20 344个差异表达基因中,显著差异表达基因有3 289个;其中显著下调表达基因有2 598个,显著上调表达基因有691个。研究结果表明,洞穴种犀角金线鲃的脑在适应性进化过程中扮演着重要的角色。
4.4 在鱼类免疫学研究中的运用
高密度养殖是人工养殖的重要特点,然而鱼类病害却制约着水产养殖业的健康发展。为了减少经济损失,转录组学技术也应用到了鱼类的免疫学研究中。目前转录组学在鱼类免疫方面的研究主要集中在鱼类被寄生虫、细菌或病毒感染前后的免疫相关基因的差异表达和分子标记物的发现等方面。
杜光迅[30]对采自黄海海域的水样进行了菌种筛选,最终筛选出一株杀虫活性最强的菌株,在得到该细菌全基因组的基础上,对不同培养时间的该细菌转录组进行了分析,预测到大量差异表达基因。此研究对开发用于治疗大菱鲆(Scophthalmus maximus)盾纤毛虫病的安全药剂起到了促进作用。刘凯[31]利用RNA-Seq技术对感染异尖线虫(Anisakis)后的长江刀鲚肝脏组织进行测序分析。然后对原始数据进行过滤、组装后共获得62 604条Unigene,运用GO和KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书,用来指一种分析基因产物生物细胞中的代谢途径的方法)等生物信息学方法对其进行注释分析并预测其功能,共获得961个差异表达基因,包括545个上调基因和416个下调基因。张明洋[32]采用高通量测序技术开展类志贺邻单胞菌(Plesiomonas shigelloides)感染对鲟脾脏转录组和肠道菌群结构的影响研究,发现类志贺邻单胞菌感染可导致鲟脾脏和肠道转录组发生改变,其中有14 069个为脾脏差异表达基因,包括10 099个上调基因和3 970个下调基因;有16 091个为肠道差异表达基因,包含12 828个上调基因和3 263个下调基因。该研究得到的大量数据可为鲟鱼类志贺邻单胞菌感染的预防与控制提供科学依据。吴霆[33]通过转录组学分析发现异育银鲫(Carassius auratus gibelio♀×Cyprinus carpio var.Singuonensis♂)感染CyHV-2后的头肾中显著上调基因有3 090个,而显著下调基因有3 995个,KEGG信号通路分析进一步发现上调基因主要富集在单纯疱疹病毒感染信号通路和坏死性凋亡等免疫相关信号通路中。
5 总结与展望
以第二代测序技术为代表的高通量测序技术得到广泛应用后,转录组学领域获得快速发展。例如对于癌症治疗来说,目前已经逐步进入了精准治疗时代,即根据癌症患者的基因组特征和转录组特征来精准指导用药,这种治疗模式因其无创性和精准性获得了医生和患者的青睐。对于新型冠状病毒的研究,可以对其基因组进行测序分析,根据不同病毒亚型之间的基因组差异来做进化分析,对病毒的发生进行溯源并区分不同亚型的毒性强弱等,甚至对疫苗研究也有一定的指导意义。近年来,转录组学技术相继应用到鱼类的发育生物学、环境胁迫、适应性进化和免疫生物学等领域中,得到大量的基因差异表达和结构功能信息,对深入研究鱼类的生长发育、病虫害和遗传进化等起到了重要作用。
与此同时,现阶段转录组学在鱼类研究中面临的问题与挑战也是不容忽视的。第一,与人类和其他主要农作物相比,鱼类转录组学研究在转录组学研究领域还相对落后。尤其是鱼类种类庞杂,缺少大量的基因组信息,这就给基因注释造成了困难。第二,我国幅员辽阔、生物资源丰富,高海拔地区和其他极端环境中也存在多种鱼类,然而由于环境恶劣,鱼类的样本采集和有效保存都存在着巨大问题。第三,当前鱼类转录组学方面的研究很少应用单细胞转录组测序技术,基本上仍是用鱼类的整个组织或器官,然而鱼类的基因表达情况在不同的细胞行使的功能是不同的。
未来鱼类的转录组学研究趋势,首先要扩大鱼类转录组学的研究领域,进一步发展和丰富鱼类的基因组信息。除此之外,要增强对极端环境中鱼类的了解,解决目前普遍存在的如何有针对性地采集组织样品进行专项研究以及如何妥善保存样品并应用到以后的科学研究等方面的问题。随着单细胞转录组测序技术取得突破性进展和成本的逐步下降,采取单细胞转录组测序方法能够具体研究不同细胞中基因的表达状态,从而减少误差发生;但仅仅应用转录组学这一种组学技术尚存在一定的局限性,因此转录组测序技术与基因组学、甲基化组学、代谢组学以及蛋白质组学等方法结合的策略应当被广泛应用,多组学联合分析是转录组学研究发展的重要方向。
综上所述,转录组学技术为鱼类生长发育、抗病免疫等方面提供了一种崭新的研究手段,并因其高灵敏度和较低的成本等优点得到了众多研究者的青睐。尽管转录组学技术在鱼类的研究中尚存在一定的局限性,但随着测序技术的进步和单分子测序技术的发展,转录组也与基因组、代谢组等组学进行多组学联合分析,这将为更加深入地研究鱼类生长发育、适应性进化、抗病免疫和遗传育种等创造条件。

