骨髓间充质干细胞线粒体转移与白血病细胞耐药
张 利,郭 铃,刘文君
1.西南医科大学附属医院儿科(泸州646000);2.西南医科大学附属医院儿童血液肿瘤与出生缺陷实验室(泸州646000);3.四川省出生缺陷临床医学研究中心(泸州 646000)
线粒体(mitochondria)是存在于大多数细胞中最复杂的细胞器之一,是细胞中制造能量的结构,为细胞进行有氧呼吸的主要场所,被称为“power house”[1]。线粒体是细胞内活性氧(reactive oxygen species,ROS)的主要来源[2],ROS 的增多会激活细胞凋亡途径[3]。肿瘤化疗药物如阿糖胞苷(AraC)、甲氨蝶呤(MTX)等的一个重要机制就是通过提高细胞内ROS 水平诱导癌细胞凋亡[4],因此,上调线粒体ROS水平是杀死癌细胞的潜在策略[5]。细胞器在细胞间转移是一个普遍的生理现象[6]。研究表明,大约有40多种不同种类的细胞器可以在不同类型的细胞间转移,包括内质网、高尔基体、溶酶体及线粒体等[7-8]。其中,线粒体转移(mitochondrial transfer)可以介导多种生物功能发生显著的变化,如修复损伤的细胞[9-11];参与细胞分化和去分化[12];促进肿瘤细胞增殖和转移[13];促进肿瘤对化疗药物的耐药性等[8,14]。
白血病(leukemia)是一类造血干细胞恶性增殖性疾病,是儿童和青少年最常见的恶性肿瘤[15]。大部分患者通过化疗后可获得临床完全缓解,但部分患者对化疗药物产生耐药性而复发难治[16],其主要原因是不能根除导致复发的白血病干细胞(leukemia stem cell,LSC)或白血病起始细胞(leukemia-initiating cell,LIC)[17],而骨髓微环境(bone marrow microenviroment,BMME)在其中起到很大的庇护作用[18]。BMME 由许多不直接参与造血的细胞类型组成[19],其中骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是成体骨髓中的一类多能干细胞,亦称为骨髓基质细胞(bone marrow stromal cells,BMSCs),具有自我更新及多向分化潜能[20],已被证明BMSCs 支持白血病细胞的存活并导致化疗耐药[21]。有研究发现BMSCs 与白血病细胞之间亦存在线粒体转移,使白血病细胞能量代谢增加、增殖加快并对化疗产生耐药。因此,本文就BMSCs 与白血病细胞间线粒体的转移、转移的触发信号、转移途径及其与白血病细胞化疗耐药的关系做一综述。
1 BMSCs 与白血病细胞间的线粒体转移
2016年,Moschoi等[22]首次报道BMSCs可在体内和体外将功能性线粒体转移至急性髓系白血病(acute myeloid leukemia,AML)细胞中(图1),将线粒体荧光标记的小鼠BMSCs系MS-5、人原代间充质干细胞(mesenchymal stem cells,MSCs)、人MSCs 系HS-5 与人AML 细胞系和人原代AML 细胞共培养后,功能性线粒体均从上述细胞转移到AML 细胞中,且线粒体转移呈时间依赖性增加。Marlein等[23]也分别通过慢病毒转染稳定标记BMSCs 线粒体和对BMSCs线粒体荧光染色后与人AML母细胞、人AML细胞系和人原代AML细胞共培养,均观察到BMSCs与AML 细胞之间发生线粒体转移。在AML 细胞与BMSCs 共培养中发现线粒体转移呈单向转移,即只从BMSCs 细胞转移至AML 细胞中[22-23]。此外,从人AML 细胞小鼠模型中分离纯化得到的AML 细胞中检测到小鼠的线粒体DNA(mtDNA)和其编码的RNA[22-23]。在慢性粒细胞白血病(chronic myelogenous leukemia,CML)中研究发现HS-5细胞中线粒体转移至K562 细胞中[24]。研究者在急性前B 淋巴细胞白血病(B-precursor acute lymphoblastic leukemia,B-pre ALL)中也发现,线粒体从BMSCs中转移至人B-ALL细胞系中(图2),并在人B-ALL 细胞小鼠模型中得到证实[25]。然而,急性T淋巴细胞白血病(T cell acute lymphoblastic leukemia,T-ALL)中则发现,在化疗药物AraC、MTX 的作用条件下Jurkat 细胞与BMSCs 共培养,主要表现为T-ALL 细胞中线粒体转移至BMSCs 中(图3),虽然BMSCs 中线粒体亦可转移至Jurkat细胞中,但数量极少[26]。Usmani等[27]也报道了人原代ALL细胞与BMSCs共培养,线粒体在ALL细胞与MSCs 之间相互转移。然而,来自白血病患者和正常人的CD3+T 细胞和非恶性CD34+造血祖细胞并不接收BMSCs 细胞的线粒体[22-23],表明了不是所有的造血细胞都是线粒体转移的接受者。

图1 BMSCs与AML细胞间的线粒体转移

图2 BMSCs与B-ALL细胞间的线粒体转移

图3 BMSCs与T-ALL细胞间的线粒体转移
2 BMSCs 与白血病细胞间线粒体转移的触发信号
2.1 BMSCs线粒体转移与化疗药物
AraC、依托泊苷(ETO)、阿霉素(Doxo)、柔红霉素(DNR)作用于AML细胞,虽显著降低了AML活细胞数,但刺激了线粒体从BMSCs向AML细胞转移的增加[22-23]。在人AML 细胞小鼠模型中证明虽然白血病细胞对线粒体的摄取生理性地发生在BMME 中,但AraC 的应用可显著增加体内AML 细胞对线粒体的摄取[22],表明化疗药物进一步促进了线粒体转移至AML细胞中。慢性氧化应激已被证明有助于肿瘤存活[28],转移[29]和增殖[30]。已知AML 中存在高水平的氧化应激[31],并在AML复发时,氧化应激的标记物增加[32]。研究表明在共培养体系中,AML 细胞可导致BMSCs中氧化应激增加,促进了线粒体转移;抗氧化剂N-乙酰半胱氨酸(NAC)和谷胱甘肽(GSH)抑制线粒体转移,而氧化剂过氧化氢(H2O2)则进一步促进了线粒体从BMSCs 到AML 细胞的转移[23]。其机制可能是在化疗药物作用下,诱导AML细胞内ROS水平升高,细胞出现氧化应激现象[33],进一步增加了AML中已经很高的氧化应激环境,从而增加了线粒体的转移。在B-ALL 中,AraC、DNR 的应用提高了B-ALL 细胞的ROS 水平,与BMSCs 共培养后,线粒体转移数量与化疗药物作用于白血病细胞产生的ROS 呈正比,线粒体转移发生后B-ALL 细胞中ROS水平显著降低,并不再受化疗药物的影响;然而,抗氧化剂NAC 则可显著降低AraC 诱导的ROS 增加和细胞凋亡,并显著抑制化疗药物触发的线粒体转移[25]。同样实验表明,AraC和MTX作用于T-ALL,致使T-ALL 细胞中线粒体产生ROS 增加可导致白血病细胞的死亡,但T-ALL细胞可将ROS产生增多的线粒体转移至BMSCs中,从而减少细胞内ROS[26]。这些结果表明,一些化疗药物在白血病细胞水平上触发和进一步促进BMSCs 与白血病细胞之间的线粒体转移,其中化疗药物诱导白血病细胞中的氧化应激水平升高和ROS产生增加可能是化疗药物驱动线粒体转移的部分机制,从而使白血病细胞免受化疗药物的伤害,但触发转移的详细机制及下游信号是如何进行转导的,目前仍不清楚。
2.2 BMSCs线粒体转移与其他因素
在BMSCs 与AML 细胞的共培养中加入二苯基氯化碘盐(DPI)后发现可抑制BMSCs 中线粒体向AML细胞的转移,降低AML细胞存活率[23];而DPI又抑制NADPH氧化酶2(NOX-2),NOX-2衍生的ROS在非恶性造血干细胞的动员和归巢中起关键作用[34]。进一步研究发现在人原代AML细胞和人AML细胞系中敲除NOX-2,AML细胞超氧阴离子产生明显减少;在与BMSCs 共培养时,NOX-2 敲除的AML细胞刺激BMSCs产生ROS的能力降低,线粒体转移数量明显减少,AML细胞的线粒体基础呼吸和最大呼吸与对照组相比也显著降低;在小鼠模型中未敲除NOX-2 的AML 细胞转移的线粒体数目显著高于敲除NOX-2 的AML 细胞[23]。说明了在AML 细胞中,NOX-2衍生的超氧化物刺激BMSCs产生ROS,导致BMSCs中线粒体转移至AML细胞中,NOX-2是白血病细胞中驱动线粒体转移的触发信号之一。
3 BMSCs 与白血病细胞间线粒体转移的途径
现有研究表明,线粒体可以通过隧道纳米管(tunneling nanotubes,TNTs)[35-36]的直接细胞间连接、细胞内吞(endocytosis)[37]、胞外微泡(microvesicle,Mv)[38]或间隙连接(gap junction,GJ)通道[35,39-40]以及细胞融合(cell fusion)[35,41]等方式在细胞之间转移(图4)。目前认为细胞内吞及TNTs途径是白血病细胞与BMSCs间的线粒体转移的主要途径。
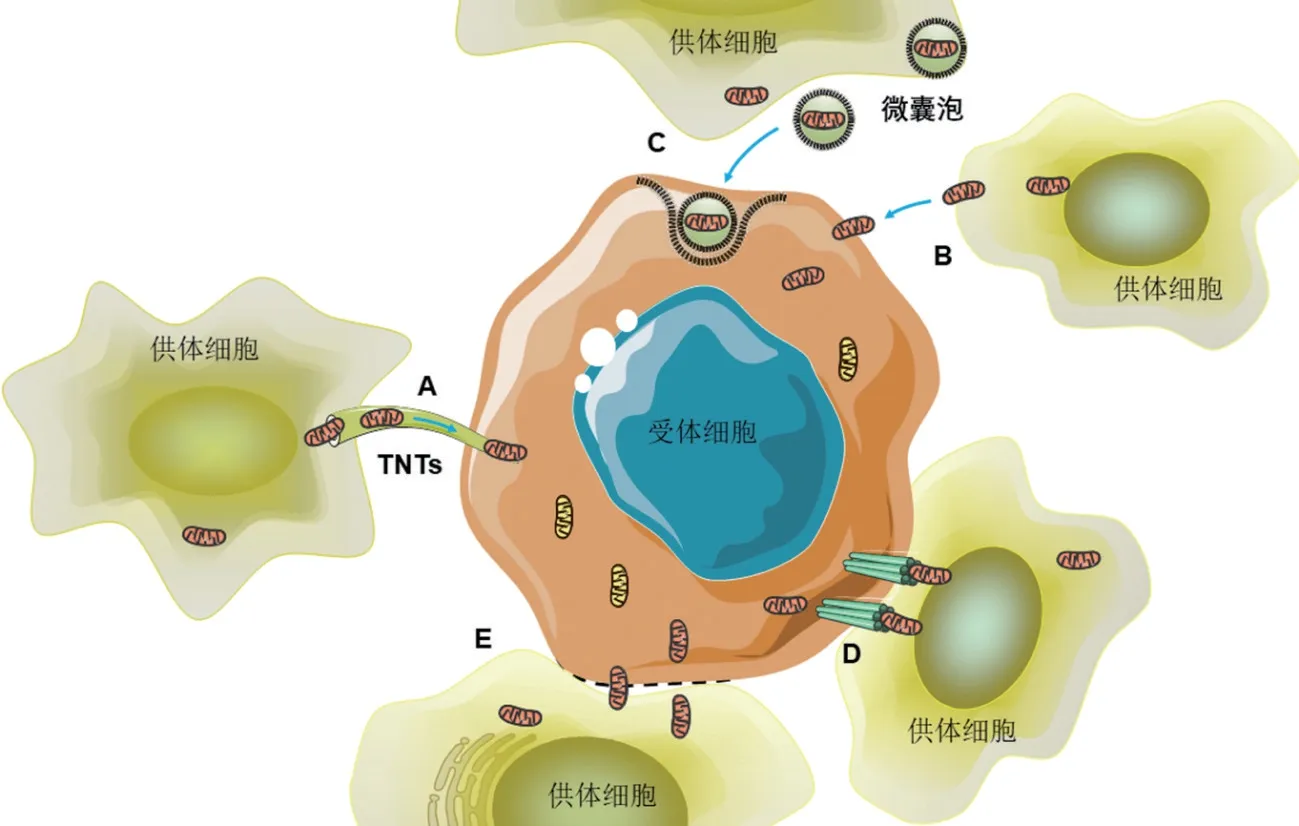
图4 细胞间的线粒体转移途径
3.1 细胞内吞途径
细胞内吞是通过质膜的变形运动将细胞外物质转入细胞内的过程,MSCs在炎症等因子的刺激下可释放线粒体,并被宿主细胞通过内吞作用摄取[37]。有研究发现,AML中功能性线粒体可通过内吞途径从MS-5 细胞转移至AML 细胞中,在共培养体系中使用内吞抑制剂则减少了AML 细胞与BMSCs 之间的线粒体转移数目[22](图1)。尽管AML 细胞已经被证明能够分化为巨噬样细胞,从而具有吞噬能力,但AML 细胞与BMSCs 的共培养体系中并未发现分化为成熟的单核巨噬细胞标志物,且在人原代AML细胞标本中单核巨噬细胞的比例在AML 共培养前后无明显差异,从而排除吞噬伪影,支持AML 细胞与BMSC之间的线粒体转移途径为AML细胞通过内吞途径吞噬BMSC完整的线粒体[22]。
3.2 TNTs途径
TNTs由细胞膜以及纤维状肌动蛋白(f-actin)和微管(microtubules)蛋白为主的细胞骨架成分组成,代表了一种新的长距离细胞间连接,是介导细胞间信息传递的线状膜性管道[42]。研究表明,线粒体从BMSCs到AML细胞的转移也通过TNT途径[23](图1)。Rustom等[43]在人源性293细胞和大鼠PC12细胞的共培养体系中首次发现TNTs,之后亦在其它多种细胞间观察到TNTs[44]。线粒体、钙、蛋白质、microRNA、细胞器和细胞囊泡等均可通过TNTs进行细胞间转移[45]。MSCs与靶细胞间可通过形成TNTs从而高效地进行细胞器的转运,因此,TNTs 是目前研究发现线粒体转移主要途径[36]。在BMSCs 与AML 细胞共培养实验中加入TNT 抑制剂-细胞松弛素B 后,AML 细胞与BMSCs 之间的线粒体转移被显著抑制;相比于内吞抑制剂,使用TNT 抑制剂对线粒体转移的抑制作用更加明显[23],表明TNTs是BMSCs与AML细胞间线粒体转移的主要方式。Moschoi等[22]的实验中也有观察到MS-5细胞形成许多膜突起,其中明显含有标记的线粒体,在使用微管抑制剂-长春新碱(VCR)后,显著干扰了突起的形成,从而有效抑制了AML细胞线粒体摄取。在CML 细胞与HS-5 细胞之间形成的TNTs 中发现荧光标记的线粒体[24],证明了线粒体通过TNTs 从MSCs 转移至CML 细胞中。Burt 等[25]研究表明,B-ALL中线粒体也是沿TNTs途径转移(图2),阻断TNTs 形成均可显著抑制线粒体的转移。同时,在T-ALL细胞与BMSCs中共培养发现,使用内吞抑制剂、缝隙连接阻断剂对线粒体转移无明显影响,但TNT 抑制剂则明显阻断了线粒体转移,线粒体的转移数目显著降低[26],表明TNTs 亦是T-ALL 细胞与BMSCs之间发生线粒体转移的途径(图3)。
K562 细胞与HS-5 细胞的延时研究揭示了在CML 细胞与MSCs 移位和直接接触后几分钟内形成细胞间TNTs[24]。Moschoi 等[22]所观察到的,与非黏附于BMSCs 的AML 细胞相比,黏附于BMSCs 的AML细胞系和原代AML 细胞在AraC 处理后存活,AML细胞线粒体摄取明显增加;在共培养过程中阻止BMSCs 与AML 细胞或B-ALL 细胞的直接接触阻断了线粒体的转移[23,25]。Wang 等[26]的结果也表明大多数Jurkat细胞与MSCs粘附,进一步实验发现与共培养体系中T 细胞的黏附分子ICAM-1 水平显著升高相关,并且抗ICAM-1处理明显抑制了从Jurkat细胞到MSCs 的线粒体转移。目前关于TNTs 形成的机制有两种,第一种机制高度依赖于细胞的移动性和细胞接触,当细胞在空间上彼此接近,TNTs就会发生,但细胞的反向运动可能导致TNTs断裂。这一过程也可以在时间上进行调节,因为TNTs的形成需要持续几分钟的细胞间接触[46]。第二种机制是含有肌动蛋白细丝的膜突起从供体细胞延伸和融合到靶细胞的细胞膜上,不依赖于细胞移动性或密切接触[47]。目前认为,白血病细胞与MSCs直接接触介导了细胞间线粒体转移,可能与TNTs形成的第一种机制相关。
4 BMSCs 线粒体转移与白血病细胞耐药
AML 细胞与BMSCs 共培养时,LIC 可从BMSCs中摄取线粒体,与非LIC 亚群相比,LIC 生存能力更高,对AraC 诱导的凋亡表现出抵抗力,具有更好的复制潜能;并用AraC、ETO、Doxo 作用于BMSCs 与AML细胞共培养体系,部分AML细胞可抵抗化疗药物的细胞毒性作用,并且能够继续复制存活[22]。对于有线粒体的普通体细胞,由葡萄糖转变而来的丙酮酸在氧含量正常时进入三羧酸循环,在缺氧时转变为乳酸来产生三磷酸腺苷(ATP),但对于肿瘤细胞,无论氧含量如何,丙酮酸主要转变为乳酸来产生ATP,由此获得更高的糖酵解能力,即Warburg 效应[48]。一般认为Warburg效应让肿瘤细胞获得生长优势并逃避凋亡、促进肿瘤转移[49],但是癌细胞也可通过“逆Warburg 效应”诱导基质细胞产生肿瘤代谢物,以促进其新陈代谢[50]。AML 细胞被证实通过“逆Warburg效应”,依赖线粒体氧化磷酸化(OXPHOS)代谢诱导BMSCs 产生肿瘤代谢物,以促进其代谢生长[51-52]。在AML 细胞与MS-5 细胞共培养后,AML 细胞ATP 总量增加了4.5倍,而与线粒体缺陷和呼吸干扰处理的MS-5 细胞共培养后其ATP 总量并未发生改变;此外,即使AML细胞在与MS-5细胞分离后的24 h内,这种代谢仍保持不变;然而,当阻断线粒体转移时,AML细胞ATP产量则未发生改变[22]。另外,与BMSCs共培养后,AML细胞与对照细胞相比基础和最大线粒体呼吸增加[23]。证实了通过将BMSCs 中线粒体转移至AML 细胞中,AML 细胞OXPHOS 增加,促进其代谢生长,有助于快速增殖的AML 细胞的能量需求。
同时在建立的NOX-2 敲除的人AML 细胞小鼠模型中,因为线粒体转移数目较未敲除NOX-2显著减少,AML细胞骨髓植入减少,疾病进展减缓,小鼠的存活率显著提高[23]。表明线粒体转移促进了AML细胞的存活、增殖、复发和对化疗药物的耐药性。在CML中,研究证实从MSCs中摄取线粒体与增强对伊马替尼诱导的凋亡的保护相关,但在线粒体转移的CML 细胞中使用伊马替尼,CML 细胞存活的比率仍然很低(低于4%),这表明线粒体转移可能不是伊马替尼应答的关键救援机制[24]。研究发现线粒体可从BMSCs转移至B-ALL细胞中,降低AraC、DNR、VCR驱动的细胞死亡;然而,阻断BMSCs 向B-ALL 细胞的线粒体转移可以恢复化疗药物对B-ALL 细胞的细胞毒性作用[25]。在T-ALL中,已有研究证实,MSCs通过ERK途径降低T-ALL细胞线粒体ROS水平,从而保护T-ALL细胞免受化疗药物的影响;抑制ERK的激活则会增加线粒体ROS 水平和T-ALL 细胞的细胞死亡率[53],表明MSCs可通过降低T-ALL细胞线粒体ROS水平来保护T-ALL细胞。同样在Wang等[26]的研究中发现,在AraC、MTX 作用的条件下T-ALL细胞与BMSCs 共培养时,随着线粒体从Jurkat 细胞转移到BMSCs中,化疗药物诱导的T-ALL细胞中升高的ROS 水平也随之降低,DNA 损伤也减少;阻断T-ALL 细胞与BMSCs 间的线粒体转移,则增加了AraC、MTX 作用下T-ALL 细胞中线粒体ROS 水平,细胞凋亡率增加,细胞活力降低,说明了线粒体转移增加了BMSCs 保护T-ALL 细胞免受化疗药物细胞毒性的能力。
BMME可为白血病细胞在化疗药物作用下提供庇护环境,BMSCs 支持白血病细胞的存活并导致化疗耐药[18,21],其中的一个机制可能就是BMSCs 与白血病细胞之间的线粒体转移,从而保护其免受化疗药物影响。此外,这也可能与化疗后微小残留疾病(minimal residual disease,MRD)相关,存在于MRD中的具有干细胞特征的LSC被认为是复发起始的起点[54-55]。可以假设白血病在化疗后,MDR中LSC发生了线粒体转移,从而导致化疗耐药并进一步增殖、复发。这些研究表明线粒体转移是导致白血病细胞化疗耐药的一种新机制,但具体分子生物学机制尚不明确。
5 结语
综上,BMSCs与白血病细胞间存在线粒体转移。化疗药物及化疗药物作用于白血病细胞引起的氧化应激增加、以及NOX-2驱动线粒体ROS增加均是线粒体转移的触发信号,但具体触发转移的详细机制及下游信号是如何进行转导的,目前仍不清楚。目前研究发现白血病细胞与BMSCs 之间的线粒体转移的方式主要为黏附介导的TNTs及细胞内吞途径。线粒体不仅从BMSCs转移至白血病细胞中,增加其呼吸代谢能力,同时白血病细胞中功能障碍的线粒体亦可转移至BMSCs 中,从而降低白血病细胞内的ROS水平,并均可导致白血病细胞的存活、增殖能力增加和对化疗的耐药性,但如何介导耐药的具体分子生物学机制仍不明确,待进一步研究。研究发现达雷妥尤单抗(daratumumab)可阻断BMSCs 中线粒体向AML 细胞中转移,抑制AML 的代谢能力,从而抑制AML细胞的增殖,并在AML小鼠模型中得以证明[56],因此,可以从驱动因素、转移途径等方面靶向阻断BMSCs与白血病细胞之间的线粒体转移从而达到逆转白血病细胞耐药的目的。

