新型降糖化合物LSM-13在大鼠肝微粒体中的稳定性研究及代谢产物分析
杜瑶 陈瑞 朱高峰 张吉泉 汤磊

中圖分类号 R917;R969.1 文献标志码 A 文章编号 1001-0408(2021)17-2059-07
DOI 10.6039/j.issn.1001-0408.2021.17.03
摘 要 目的:考察新型降糖化合物LSM-13在大鼠肝微粒体中的代谢稳定性,并分析其可能的代谢产物。方法:将LSM-13溶解于由还原型烟酰胺腺嘌呤二核苷酸磷酸启动的大鼠肝微粒体孵育体系中,置于37 ℃水浴中进行孵育,分别于孵育0、5、10、15、20、30、45、60 min时用乙腈终止反应。以吲哚美辛为内标,采用高效液相色谱法测定孵育体系中LSM-13的质量浓度。以孵育0 min时LSM-13的质量浓度为参照,计算其在不同孵育时间下的剩余百分比和酶动力学参数。采用超高效液相色谱-串联四极杆飞行时间质谱法检测并定性分析LSM-13在大鼠肝微粒体中的代谢产物。结果:孵育60 min时,LSM-13在大鼠肝微粒体中的剩余百分比为(56.07±0.95)%,半衰期为42.78 min,固有清除率为0.032 4 mL/(min·mg)。与大鼠肝微粒体空白样品的总离子流图比较,孵育60 min样品中新增了3个色谱峰,对应的准分子离子峰分别为m/z 505.133 8、417.102 4、293.111 7[M+H]+,可能是LSM-13脱氢、O-脱苄基、水解的产物。结论:化合物LSM-13在大鼠肝微粒体中的稳定性为中等,并可能发生了脱氢、O-脱苄基和水解反应。
关键词 降糖化合物;LSM-13;大鼠肝微粒体;稳定性;代谢产物
Stability Study of Novel Hypoglycemic Compound LSM-13 in Rat Liver Microsomes and Its Metabolites Analysis
DU Yao1,CHEN Rui2,ZHU Gaofeng2,ZHANG Jiquan1,2,TANG Lei2( 1. College of Pharmacy,Guizhou Medical University, Guiyang 550004, China; 2. Guizhou Provincial Engineering Technology Research Center for Chemical Drug R&D, Guiyang 550004, China)
ABSTRACT OBJECTIVE: To investigate the metabolism stabilities of novel hypoglycemic compound LSM-13 in rat liver microsomes, and to analyze the possible metabolites. METHODS: LSM-13 was dissolved in rat liver microsome incubation system initiated by reduced nicotinamide adenine dinucleotide phosphate, and was incubated in water at 37 ℃. The reaction was terminated with acetonitrile at 0,5,10,15,30,45 and 60 min, respectively. Using indomethacin as internal standard, the concentration of LSM-13 in incubation system was determined by HPLC. The residual percentage and enzyme kinetic parameters of LSM-13 were calculated at different incubation time points with the concentration of LSM-13 incubated for 0 min as reference. UPLC-Q-TOF/MS was used to analyze and speculate the metabolites of LSM-13 in rat liver microsomes. RESULTS: After 60 min incubation, the remaining percentage of LSM-13 was (56.07±0.95)%, the half-life was 42.78 min, and the intrinsic clearance was 0.032 4 mL/(min·mg). Compared with total ion flow diagram of rat liver microsome blank samples, three chromatographic peaks were added in the samples incubated for 60 min; the corresponding molecular ion peaks were m/z 505.133 8, 417.102 4, 293.111 7
[M+H]+; the possible metabolites may be dehydrogenation, O-debentylation and hydrolysis products of LSM-13. CONCLUSIONS: The compound LSM-13 has moderate stability in rat liver microsomes, and may undergo dehydrogenation, O-debentylation and hydrolysis.
KEYWORDS Hypoglycemic compound; LSM-13; Rat liver microsomes; Stability; Metabolites
近年来,新型降糖药物的研究与开发已成为创新药物研究的热点。腺苷酸激活蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)是治疗2型糖尿病的一个重要靶点[1-2]。该激酶是机体的能量感受器与代谢调节稳态中心,可通过激活下游关键蛋白的磷酸化来调节糖脂的代谢平衡[3]。据文献报道,激活AMPK不仅能降低患者的血糖水平,而且还对糖尿病并发症(如糖尿病肾病、糖尿病心血管疾病等)具有潜在的治疗作用[3]。目前,临床上使用的2型糖尿病一线治疗药物二甲双胍和噻唑烷二酮类药物吡格列酮等均被证实为AMPK间接激动剂,虽有很好的降糖作用,但对糖尿病并发症的治疗效果有限[4-5],加之迄今仍未有更具特异性的AMPK直接激动剂上市,因此研发新型、高效的AMPK直接激动剂具有重要的临床意义。
ZG02的化学名为6-苄氧基-9-(4-氯苯甲酰基)-四氢咔唑-3-羧酸(结构式见图1A),是一个结构新颖的四氢咔唑类降糖化合物,可通过激活AMPK通路来降低db/db小鼠的血糖与血脂水平[6]。本课题组前期利用ACD/Labs软件对该化合物进行初步类药性评估,发现其具有较高的计算模拟值(CLogP=5.75),但体内代谢不稳定。为了进一步寻找药动学性质更佳且降糖活性更优的AMPK直接激动剂,本课题组前期以ZG02为先导化合物设计合成了一系列衍生物,并通过葡萄糖消耗模型筛选发现LSM-13{化学名为8-(苄氧基)-5-(4-氯苯甲酰基)-7-氟-1,3,4,5-四氢-2H-吡啶并[4,3-b]吲哚-2-羧酸乙酯,结构式见图1B}能显著促进HepG2细胞对葡萄糖的消耗,促葡萄糖消耗率达44.78%,显著高于ZG02(P<0.05);同时,在动物体内实验中也证实了LSM-13具有很好的降糖活性。可见,LSM-13作为一个潜在的AMPK直接激动剂,具有进一步研发的价值。
新药从发现到上市需要经过临床前研究、临床试验、报批和上市等4个阶段,其中药物代谢研究对前两个阶段具有重要的指导意义[7]。药物经过代谢可能使其活性丧失或者生成具有毒性的代谢产物,将直接影响药物的有效性与安全性[8]。肝脏含有丰富的药物代谢酶系统,是药物代谢和生物转化的主要器官,因此探讨药物在肝脏中的稳定性及代谢情况显得尤为重要[9]。本研究采用体外肝微粒体温育法,以高效液相色谱法(HPLC)考察LSM-13在SD大鼠肝微粒体中的稳定性;采用超高效液相色谱-串联四极杆飞行时间质谱法(UPLC-Q- TOF/MS)并根据二级质谱中的碎片离子信息推测LSM-13在肝微粒体中的可能代谢产物,旨在初步探讨该化合物在肝微粒体中的代谢规律,为后续LSM-13的体内代谢研究以及临床研究奠定基础。
1 材料
1.1 主要仪器
本研究所用主要仪器包括:e2695型HPLC仪、 XevoG2-XS型UPLC-Q-TOF/MS仪(美国Waters公司),JN300-2型氮气吹扫仪(苏州吉米诺仪器有限公司),AUW220D型电子天平(日本Shimadzu公司),X1型高速离心机(香港基因有限公司),HC-100型恒温混匀仪(杭州佑宁仪器有限公司),DRHH-2型数显恒温水浴锅(上海双捷实验设备有限公司)等。
1.2 主要药品与试剂
LSM-13原料药(批号20201123,纯度>99%)由本课题组合成;吲哚美辛对照品(内标,批号J0526A5,纯度>98%)购自大连美仑生物技术有限公司;烟酰胺腺嘌呤二核苷酸磷酸二钠(NADP-Na2,批号1011L024)、葡萄糖-6-磷酸-二钠(G-6-P-Na2,批号407H033)、葡萄糖-6-磷酸脱氢酶(G-6-P-DH,批号20180725)均购自北京索莱宝科技有限公司;甲醇、乙腈为色谱纯;氯化镁、柠檬酸钠等其余试剂均为分析纯,水为蒸馏水。
1.3 大鼠肝微粒体
雄性SD大鼠肝微粒体(批号MIC254034)购自武汉普莱特生物医药技术有限公司。
2 方法与结果
2.1 LSM-13定量分析的HPLC条件
以Waters XBridge C18(250 mm×4.6 mm,5 μm)为色谱柱,以Waters Symmetry C18 VanGuard Cartidge(5 mm×3.9 mm,5 μm)为保护柱,以乙腈(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱(0~6 min,75%A;6~7.5 min,75%A→90%A;7.5~13.5 min,90%A;13.5~15 min,90%A→75%A;15~16 min,75%A);检测波长为265 nm;流速为1 mL/min;柱温为35 ℃;进样量为20 μL。
2.2 代谢产物定性分析的UPLC-Q-TOF/MS条件
以Waters BEH C18(50 mm×2.1 mm,1.7 μm)为色谱柱,以0.01%甲酸溶液(A)-0.01%甲酸乙腈溶液(B)为流动相进行梯度洗脱(0~1 min,95%A;1~5 min,95%A→60%A;5~10 min,60%A→40%A;10~17 min,40%A→2%A;17~18 min,2%A;18~19 min,2%A→95%A;19~20 min,95%A);流速为0.30 mL/min;柱温为35 ℃;进样量为5 μL;采集时间为20 min。离子源为电喷雾离子源(ESI);扫描模式为正离子模式;毛细管电压为1.5 kV;离子源溫度为120 ℃;脱溶剂气温度为400 ℃;脱溶剂气流量为800 L/h;锥孔气流量为50 L/h;扫描模式为“MSE continuum”模式;扫描范围为m/z 50~1 200;碰撞能量为20~40 V。
2.3 溶液的制备
2.3.1 LSM-13与内标贮备液 精密称取LSM-13原料药适量,以乙腈溶解并定容,混匀,制得质量浓度为1 mg/mL的LSM-13贮备液;精密称取内标对照品适量,同法制得质量浓度为1 mg/mL的内标贮备液。两者均于4 ℃保存,备用。临用前,取内标贮备液适量,以甲醇稀释至质量浓度为0.5 μg/mL,备用。
2.3.2 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅酶溶液 分别称取NADP-Na2 200 mg、G-6-P-Na2 200 mg、氯化镁133 mg,加水溶解并定容至10 mL,混匀,得A液;分别称取柠檬酸钠44 mg、G-6-P-DH 1 000 U(相当于1.36 mg),加水溶解并定容至25 mL,混匀,得B液。两者均于-20 ℃下保存,备用。临用前,将A、B液按体积比5 ∶ 1混合,得浓度为1 mmol/L(按反应产物NADPH计)的辅酶溶液[10]。
2.4 样品的孵育与处理
2.4.1 孵育体系的建立 取大鼠肝微粒体,用pH 7.4的磷酸盐缓冲液(PBS)稀释至5 mg/mL;取上述肝微粒体溶液20 μL,加入“2.3.1”项下的LSM-13贮备液2 μL和Tris-HCl缓冲液148 μL。将上述混合溶液置于37 ℃水浴锅中孵育5 min后,加入“2.3.2”项下的NADPH辅酶溶液30 μL以启动反应。该孵育体系的总体积为200 μL,其中LSM-13的质量浓度为5 μg/mL,NADPH的终浓度为1 mmol/L,有机溶剂体积分数不超过1%[11]。
2.4.2 样品孵育与处理 将上述孵育体系继续置于37 ℃水浴锅中,分别在孵育0、5、10、15、20、30、45、60 min时加入含0.5 μg/mL内标的乙腈800 μL(温度4 ℃)以终止反应。将上述混合物涡旋混匀1 min后,于4 ℃下以13 000 r/min高速离心10 min,收集上清液以氮气流吹干,残渣用乙腈200 μL复溶,按“2.1”项下色谱条件进样分析。每个时间点的孵育样品平行3份操作。
2.5 生物样品中LSM-13的定量分析方法学考察
2.5.1 专属性考察 分别取适量空白溶剂(乙腈)、LSM-13+内标标准溶液(分别含LSM-13和内标5、2 μg/mL,按“2.3.1”项下方法以乙腈配制)、空白孵育样品(不含待测物和内标,按“2.4.2”项下方法孵育15 min制得)、在大鼠肝微粒体孵育体系中孵育15 min时的孵育样品(按“2.4.2”项下方法孵育并处理所得),按“2.1”项下色谱条件进样分析,记录色谱图(图2)。结果,化合物LSM-13的保留时间约为13.4 min,内标的保留时间约为7.1 min;两者可同时被检出且互不干扰,同时不受内源性物质的影响,提示该方法专属性良好。
2.5.2 线性关系考察 精密量取“2.3.1”项下的LSM-13贮备液适量,加至经高温灭活的大鼠肝微粒体孵育体系中,制得质量浓度为0.5、1、2、5、10、20、40 μg/mL的LSM-13系列工作溶液,按“2.4.2”项下方法孵育15 min并处理后,再按“2.1”项下色谱条件进样测定,记录峰面积。以LSM-13质量浓度为横坐标(x)、LSM-13与内标的峰面积比值为纵坐标(y)作线性回归,得回归方程为y=0.997 1x-0.526 6(R2=0.999 1)。结果,LSM-13检测质量浓度的线性范围为0.5~40 μg/mL,定量下限为0.5 μg/mL。
2.5.3 基质效应与提取回收率试验 精密量取“2.3.1”项下的LSM-13贮备液适量,加入乙腈稀释,制得低、中、高质量浓度(1、5、30 μg/mL)待测样品,按“2.4.2”项下方法孵育15 min并处理后,再按“2.1”项下色谱条件进样测定,记录LSM-13与内标的峰面积比值(A1);取未加药的灭活的肝微粒体适量,按“2.4.2”项下方法孵育15 min并处理,随后加入“2.3.1”项下LSM-13贮备液适量,使最终质量浓度与上述待测样品对应,再按“2.1”项下色谱条件进样测定,记录LSM-13与内标的峰面积比值(A2);精密量取“2.3.1”项下的LSM-13贮备液适量,加至灭活的大鼠肝微粒体孵育体系中,配制成与上述待测样品质量浓度对应的质控(QC)样品,按“2.4.2”项下方法孵育15 min并处理后,再按“2.1”项下色谱条件进样测定,记录LSM-13与内标的峰面积比值(A3)。每个质量濃度平行5份操作。按以下公式计算:基质效应=(A2/A1)×100%;提取回收率=(A3/A2)×100%。结果,提取方法和基质效应均不会影响LSM-13质量浓度的测定,详见表1。
2.5.4 准确度与精密度试验 精密量取“2.3.1”项下的LSM-13贮备液适量,加至灭活的大鼠肝微粒体孵育体系中,制得LSM-13定量下限质量浓度(0.5 μg/mL)和低、中、高质量浓度(1、5、30 μg/mL)的QC样品,均平行5份操作。各样品按“2.4.2”项下方法孵育15 min并处理后,再按“2.1”项下色谱条件重复进样3次,考察日内精密度;连续进样3 d,考察日间精密度。将实测质量浓度与理论质量浓度进行比较,考察准确度。结果,定量下限质量浓度和低、中、高质量浓度QC样品的日内、日间RSD均小于5%,准确度(以平均值计)为94.30%~110.08%,符合生物样品定量分析的要求[12]。
2.5.5 稳定性试验 精密量取“2.3.1”项下的LSM-13贮备液适量,加至灭活的大鼠肝微粒体孵育体系中,制得LSM-13低、中、高质量浓度(1、5、30 μg/mL)的QC样品,均平行5份操作。各样品按“2.4.2”项下方法孵育15 min并处理,处理后的样品分别于室温放置12 h、4 ℃放置24 h、反复冻融3次(-80 ℃~室温)后,再按“2.1”项下色谱条件进样测定,考察样品的稳定性。结果,在上述条件下,各样品实测质量浓度的RSD均小于5%,表明样品的稳定性良好,详见表3。
2.6 LSM-13在SD大鼠肝微粒体中的稳定性考察
按“2.4”项下方法进行体外代谢稳定性研究,采用底物消除法[9]考察LSM-13的代谢情况。将孵育0 min时LSM-13的质量浓度记为100%,计算不同孵育时间点LSM-13在大鼠肝微粒体中的剩余百分比。每个时间点平行3次操作,结果见表4。由表4可知,在大鼠肝微粒体中孵育60 min后,LSM-13的剩余百分比为(56.07±0.95)%。
将各孵育时间点LSM-13的平均剩余百分比的自然对数对孵育时间作线性回归,求得斜率k;根据k可计算出LSM-13在大鼠肝微粒体中的酶动力学参数[半衰期(t1/2)与固有清除率(CLint)]。其中,t1/2=-0.693/k,CLint=[0.693/t1/2×孵育液体积(mL)]/肝微粒体质量(mg)[10]。结果,LSM-13的t1/2为42.78 min,CLint为0.032 4 mL/(min·mg)。肝微粒体代谢稳定性的评价标准如下:t1/2<30 min,表明受试化合物不稳定;t1/2为30~90 min,表明受试化合物稳定性为中等;t1/2>90 min,表明受试化合物稳定[10]。由此可见,LSM-13在大鼠肝微粒体中具有中等稳定性。
2.7 LSM-13代谢产物的定性分析
收集“2.6”项下孵育60 min时的肝微粒体孵育样品与空白孵育样品(空白大鼠肝微粒体同“2.4”项下方法孵育60 min所得)。由于代谢产物浓度可能较低,故将收集的样品适当浓缩,然后再按“2.2”项下条件进样分析。通过比较空白孵育样品与孵育60 min样品的总离子流图(图3),发现新的色谱峰;再根据各色谱峰的准分子离子及碎片离子信息,推测LSM-13代谢产物的结构。
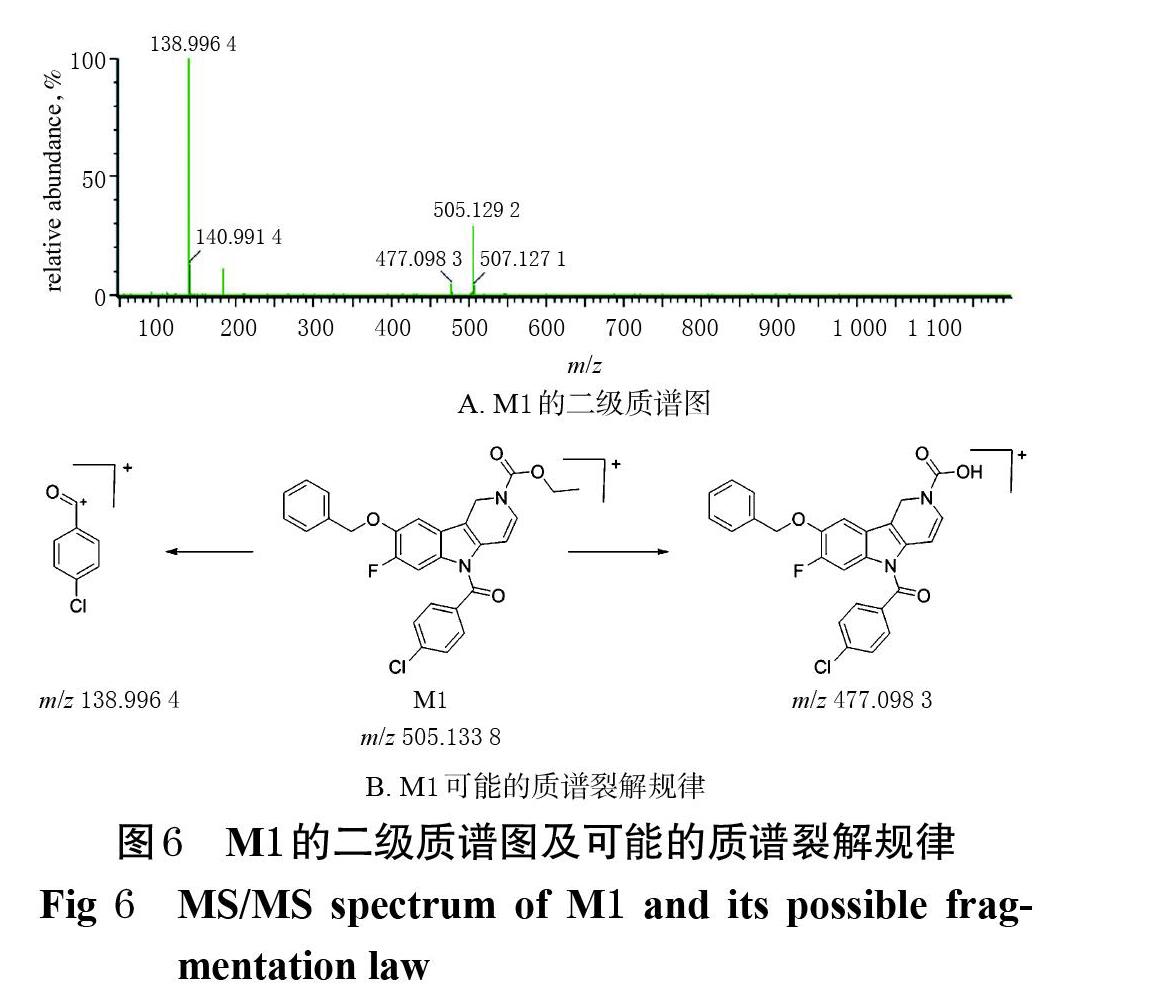
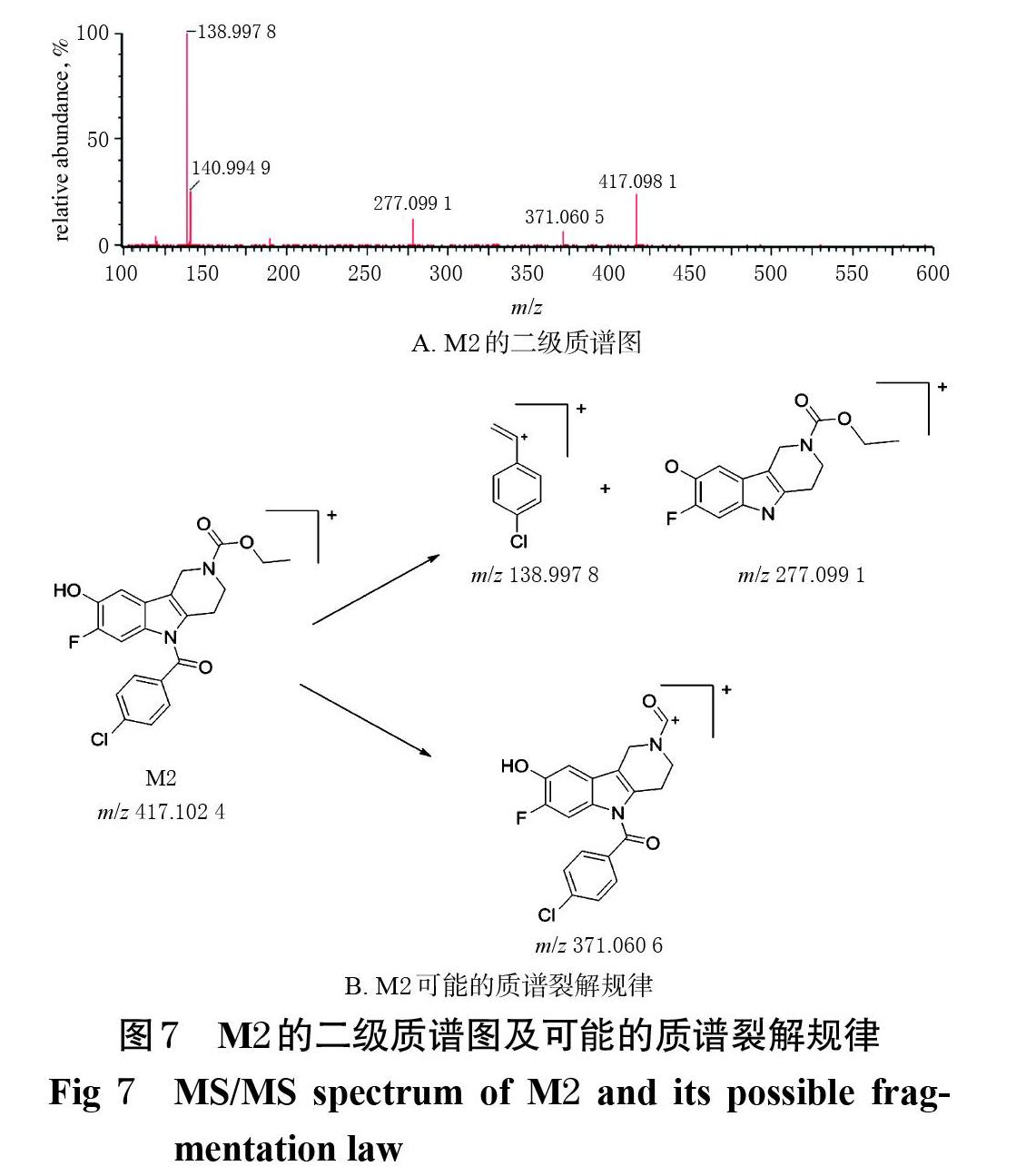
2.7.1 代谢产物的发现 比较空白孵育样品与孵育60 min样品的总离子流图,发现在14.06、12.69、9.93、6.15 min处出现4个色谱峰(M0~M3),其m/z依次为507.150 2、505.133 8、417.102 4、293.111 7(图4)。其中,m/z 507.150 2[M+H]+为LSM-13的准分子离子峰(M0),其余3个(M1~M3)则是LSM-13在大鼠肝微粒体中的代谢产物峰。
2.7.2 LSM-13质谱裂解规律 LSM-13的分子式为C28H24ClFN2O4,分子量为506.140 9,准分子离子峰为m/z 507.150 2[M+H]+。LSM-13的主要二级碎片离子峰有 m/z 138.998 4、280.118 7、418.107 8、461.114 9[M+H]+等,提示其结构中的苄氧基、乙氧基和对氯苯甲酰基可能会在质谱碰撞能量的作用下发生断裂。LSM-13的二级质谱图及可能的质谱裂解规律见图5。
2.7.3 代谢产物结构分析 本研究对代谢产物M1、M2、M3的可能结构进行了初步分析。
(1)代谢产物M1:该化合物的保留时间为12.69 min,准分子离子峰为m/z 505.133 8[M+H]+,与LSM-13相比质量减少了2,推测该代谢产物与原型化合物相比减少了2个H,可能为LSM-13的脱氢产物,结构式可能为C28H22ClFN2O4。M1的主要碎片离子峰有m/z 477.098 3、138.996 4[M+H]+等,提示其脱氢位置可能在LSM-13的吡啶并[4,3-b]吲哚环上;此外,m/z 477.098 3[M+H]+碎片离子与M1相比质量减少了28,提示可能是其在质谱碰撞能量的作用下掉了1个乙基,M1上可能存在乙基。M1的二级质谱图及可能的质谱裂解規律见图6。
(2)代谢产物M2:该化合物的保留时间为9.93 min,准分子离子峰为m/z 417.102 4[M+H]+,与LSM-13相比质量减少了90,推测该代谢产物与原型化合物相比减少了1个苄基,可能为LSM-13的O-脱苄基产物,结构式可能为C21H18ClFN2O4。M2的主要碎片离子峰有m/z 138.997 8、277.099 1、371.060 5[M+H]+等,提示其结构中的碳氮键、碳氧键可能会在质谱碰撞能量的作用下发生断裂。M2的二级质谱图及可能的质谱裂解规律见图7。
(3)代谢产物M3:该化合物的保留时间为6.15 min,准分子离子峰为m/z 293.111 7[M+H]+,与LSM-13相比质量减少了214,提示可能为LSM-13的2个酰胺键水解加四氢咔唑环2次脱氢的产物,结构式可能为C18H13FN2O。M3的主要二级碎片离子为m/z 202.056 9[M+H]+,与M3相比质量减少了91,提示可能是结构中的碳氧键在质谱碰撞能量的作用下发生了断裂。M3的二级质谱图及可能的质谱裂解规律见图8。
3 讨论
与体内代谢研究相比,体外代谢研究可排除内源性物质的干扰,具有简单快速、结果重现性好等优点,有助于直接观察药物的代谢特征,适用于体内代谢转化率低的成分以及候选化合物的早期代谢研究及筛选[13-14]。为此,本研究采用体外肝微粒体温育法,考察了LSM-13在大鼠肝微粒体中的稳定性及代谢情况。
在体外代谢研究中,药物浓度会影响酶代谢稳定性的评价:若药物浓度过低,则可能在很短时间内被代谢完全,不便于检测;若药物浓度过高,则代谢酶将达饱和状态,无法反映真实的代谢状态[15-16]。因此,本实验前期考察了LSM-13在1、5、10 μg/mL等3个质量浓度条件下的代谢情况。结果发现,当药物质量浓度为5 μg/mL时,LSM-13在孵育60 min时能达到底物20%的清除率,故确定5 μg/mL为最终试验质量浓度。
本研究借助HPLC法检测发现,LSM-13在大鼠肝微粒体孵育体系中反应60 min后,剩余百分比为(56.07±0.95)%,t1/2为42.78 min,CLint为0.032 4 mL/(min·mg),表明LSM-13在体外大鼠肝微粒体孵育体系中的稳定性为中等。此外,本研究利用UPLC-Q-TOF/MS检测以及二级质谱的碎片离子信息分析,初步推测了3个代谢产物的化学结构,并发现LSM-13在肝微粒体代谢酶的作用下主要发生了脱氢、O-脱苄基、水解反应。
综上所述,本研究建立了定量分析大鼠肝微粒体中LSM-13的HPLC法,并初步明确了LSM-13在大鼠肝微粒体中的代谢稳定性为中等;同时,利用UPLC-Q-TOF/MS技术,通过二级质谱的碎片离子信息初步推测了LSM-13在大鼠肝微粒体中的Ⅰ相代谢产物的结构,为LSM-13后期的药动学研究及结构改造提供了一定的参考依据。
参考文献
[ 1 ] 黄壮壮,刘峰,丁腾,等.糖尿病并发症的发病机制及其药物治疗研究进展[J].西北药学杂志,2019,34(6):848- 851.
[ 2 ] 马宇航,彭永德. 2型糖尿病降糖药物治疗进展[J].中国临床保健杂志,2020,23(4):437-445.
[ 3 ] STEINBERG G R,CARLING D. AMP-activated protein kinase:the current landscape for drug development[J]. Nat Rev Drug Discov,2019,18(3):527-551.
[ 4 ] ZHOU G,MTERS R,LI Y,et al. Role of AMP-activated protein kinase in mechanism of metformin action[J]. J Clin Invest,2001,108(8):1167-1174.
[ 5 ] QUARESMA P G F,REENCOBER N,ZANOTTO T M,et al. Pioglitazone treatment increases food intake and decreases energy expenditure partially via hypothalamic adiponectin/adipoR1/AMPK pathway[J]. Int J Obes (Lond),2016,40(1):138-146.
[ 6 ] ZHANG J Q,LI S M,MA X,et al. Discovery of tetrahydrocarbazoles with potent hypoglycemic and hypolipemic activities[J]. Eur J Med Chem,2018,150:102-115.
[ 7 ] 吴慧,彭英,孙建国,等.体外代谢在新药早期评价中的应用与发展[J].药学学报,2013,48(7):1071-1079.
[ 8 ] KERNS E H.类药性质:概念、结构设计与方法:从ADME到安全性优化[M].钟大放,译.北京:科学出版社,2011:163-164,329.
[ 9 ] 张丽,蔡进,班玉娟,等.采用UPLC-MS/MS法研究树豆酮酸A在不同种属肝微粒体中的代谢差异[J].中国药房,2019,30(18):2497-2502.
[10] 陈瑞,张丽,蔡进,等.新型胰岛素增敏剂ZG02在大鼠肝微粒体中的代谢稳定性研究[J].中国药房,2018,29(24):3359-3364.
[11] WANG Y,HE S,CHENG X,et al. UPLC-Q-TOF-MS/MS fingerprinting of traditional Chinese formula SiJunZiTang[J]. J Pharm Biomed Anal,2013,80:24-33.
[12] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-472.
[13] 夏媛媛,杨沮勤,朱伊婷,等. UPLC-MS/MS研究抗肿瘤化合物HK-7在不同种属肝微粒体中的代谢稳定性和代谢酶表型[J].中国新药杂志,2018,27(2):178-183.
[14] 杨增艳,张颖,李嘉,等.东莨菪内酯在大鼠肝微粒体孵育体系中的代谢产物分析及其含药血清对大鼠肝星状细胞的影响[J].中国比较医学杂志,2020,30(2):9-14.
[15] MA H Y,YANG J D,HOU J,et al. Comparative metabolism of DDAO benzoate in liver microsomes from various species[J]. Toxicol In Vitro,2017,44:280-286.
[16] 刘昌孝.發展药物代谢和药物动力学,迎接生物技术发展新时代的挑战[J].药学进展,2018,42(8):4-6.
(收稿日期:2021-03-17 修回日期:2021-07-26)
(编辑:张元媛)

