我国鼓励仿制药品目录政策趋势研究
王圣鸣 田侃 王紫红

中圖分类号 R95 文献标志码 A 文章编号 1001-0408(2021)17-2053-06
DOI 10.6039/j.issn.1001-0408.2021.17.02
摘 要 目的:了解我国鼓励仿制药品目录政策的现状和趋势,并为鼓励仿制药品目录政策更好地落实提出对策和建议。方法:对我国鼓励仿制药品目录政策的演变、两批鼓励仿制药品目录纳入品种的特点、第一批鼓励仿制药品目录的实施效果、鼓励仿制药品目录政策的发展趋势与存在问题等进行分析,并提出相应建议。结果与结论:我国鼓励仿制药品目录政策的演变大致分为雏形阶段、政策设计阶段以及政策执行和调整阶段。相较于第一批鼓励仿制药品目录纳入的品种主要以专利即将过期且竞争不充分的药品和临床必需、疗效确切、供应短缺的药品为主,兼顾重大传染病防治和罕见病治疗所需、儿童使用等特殊临床用途的品种;第二批鼓励仿制药品目录纳入的品种主要以专利(即将)过期且竞争不充分的品种为主,兼顾特殊临床用途的品种。第一批鼓励仿制药品目录品种的仿制药申请(ADNA)新增数为18个,共涉及8个品种;其中仅3个ADNA被纳入优先审评,占16.67%。2019、2020年医保目录新纳入品种分别有218个、119个,其中分别新纳入鼓励仿制药品目录内品种各3个(占比分别为1.4%和2.5%)。当前我国鼓励仿制药品目录存在专利导向回归、优先审评审批制度缺失、与医保目录联动性增强的趋势和特点。建议坚持2017年国务院《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的初衷,继续坚持鼓励仿制药品目录的专利导向,完善目录内品种仿制药的优先审评制度,探索以美国FDA竞争性仿制疗法指南为参考的、符合我国鼓励仿制药品目录政策特点的“首仿市场独占期”制度,并进一步加强鼓励仿制药品目录政策执行时的政府部门间合作。
关键词 鼓励仿制药品目录;政策;专利;仿制药
Study on the Policy Trends of Encouraged Generic Drug Catalogue in China
WANG Shengming,TIAN Kan,WANG Zihong(College of Health Economics and Management, Nanjing University of TCM, Nanjing 210023, China)
ABSTRACT OBJECTIVE: To know about the current situation and trend of encouraged generic drug catalogue policy in China, and to put forward countermeasures and suggestions for the better implementation of the policy. METHODS: The evolution of encouraged generic drug catalogue policy in China, the characteristics of 2 batches of included types in encouraged generic drug catalogue, the implementation effect of the first batch of encouraged generic drug catalogue, the development trend and existing problems of encouraged generic drug catalogue policy were analyzed to put forward corresponding suggestions. RESULTS & CONCLUSIONS: The evolution of encouraged generic drug catalogue policy in China can be roughly divided into embryonic stage, policy design stage and policy implementation and adjustment stage. The first batch of included types in encouraged generic drug catalogue are mainly drugs whose patents are about to expire and the competition is insufficient, drugs with clinical necessity, definite curative effect and short supply, and varieties for special clinical purposes such as the prevention and treatment of major infectious diseases and rare diseases, and childrens use. The second batch of included types in encouraged generic drug catalogue are mainly those with expired patents (about to expired) and insufficient competition, and also those with special clinical uses. Among the types of the first batch of encouraged generic drug catalogue, the number of abbreviated new drug application (ADNA) increased by 18, involving a total of 8 varieties; only 3 ADNA were included in the priority review, accounting for 16.67%. In 2019 and 2020, 218 and 119 varieties were newly included in the medical insurance catalogue, and 3 varieties were newly included in the encouraged generic drugs catalogue (accounting for 1.4% and 2.5% respectively). At present, encouraged generic drug catalogue policy in China has the trend and characteristics of patent oriented regression, lack of priority review and approval system, and enhanced linkage with the medical insurance catalogue. It is suggested to adhere to the original intention of the Opinions of the State Council on Deepening the Reform of the Review and Approval System and Encouraging the Innovation of Drugs and Medical Devices in 2017, continue to adhere to the patent orientation of encouraged generic drug catalogue, and improve the priority review system of generic drugs in the catalogue, explore the “first imitation market monopoly period” system in line with the characteristics of encouraged generic drug catalogue policy in China with reference to the U.S. FDA competitive imitation therapy guidelines, and further strengthen the cooperation between government departments in the implementation of the encouraged generic drug catalogue policy.
KEYWORDS Encouraged generic drug catalogue; Policy; Patent; Generic drug
为进一步提高我国药品供应保障能力,满足我国日益增长的临床用药及公共卫生安全需求,我国鼓励仿制药品目录政策应运而生。截至2021年3月,国家卫生健康委已累计发布了两批鼓励仿制药品目录,累计纳入品种49个。为促进鼓励仿制药品目录及其配套政策更好地落地见效,本文拟对我国鼓励仿制药品目录政策的现状和趋势进行分析,以期发现当前鼓励仿制药品目录政策执行中存在的不足,并提出对策和建议。
1 我国鼓励仿制药品目录政策的演变
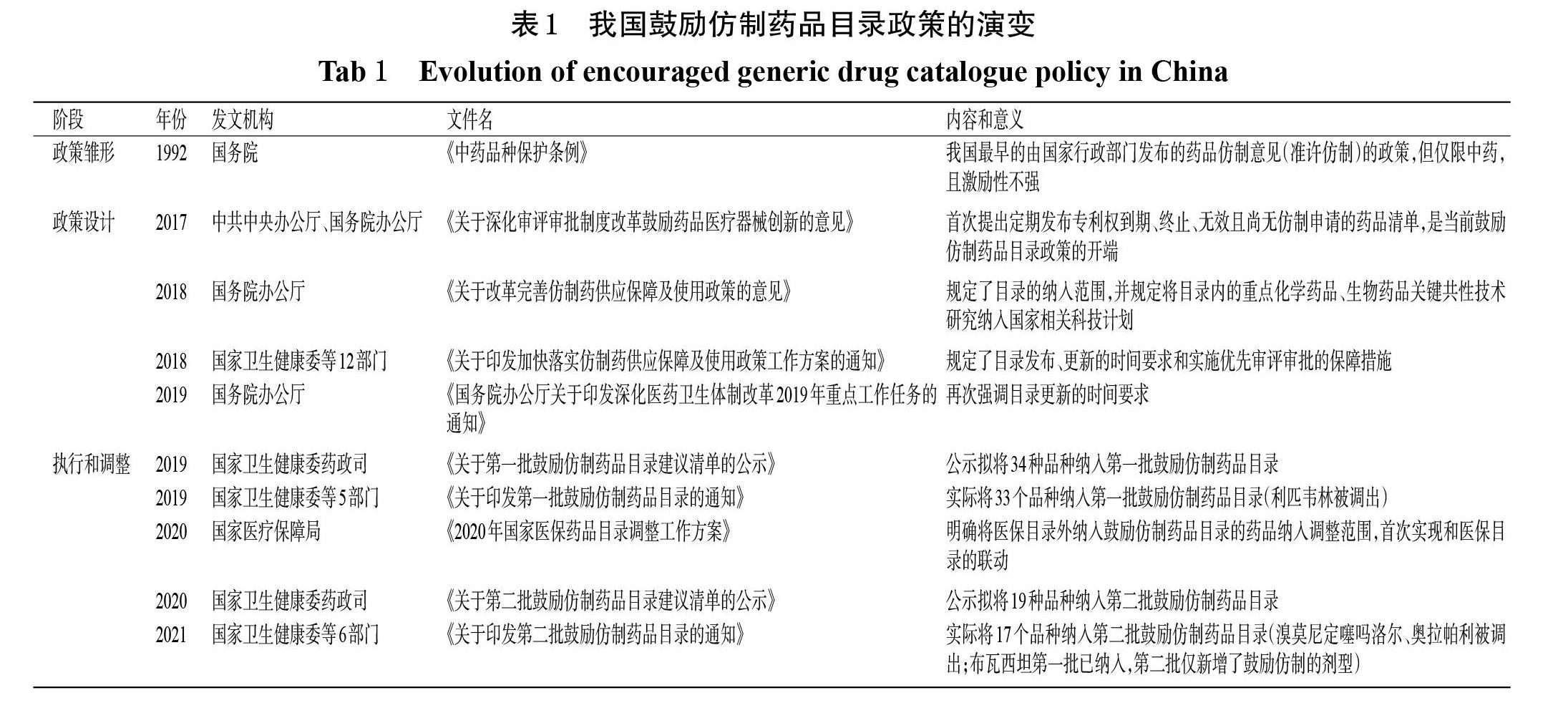
回顾我国鼓励仿制药品目录政策的演变,大致可分为3个阶段,如表1所示。一是雏形阶段:1992年发布的《中药品种保护条例》第十九条规定,“对临床用药紧缺的中药保护品种,根据国家中药生产经营主管部门提出的仿制建议,经国务院卫生行政部门批准,由仿制企业所在地的省、自治区、直辖市卫生行政部门对生产同一中药保护品种的企业发放批准文号”[1],该规定可视为我国鼓励仿制药品目录政策的雏形。二是政策设计阶段:根据2017年中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称“2017年《意见》”)中“定期发布专利权到期、终止、无效且尚无仿制申请的药品清单”的要求[2],国务院办公厅《关于改革完善仿制药供应保障及使用政策的意见》(以下简称“2018年《意见》”)和国家卫生健康委等12个部门《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》(以下简称“《通知》”)于2018年相继出台[3-4],并作为关键性指导文件,基本完成了以临床必需、疗效确切、供应短缺以及重大传染病防治和罕见病治疗所需、处置突发公共卫生事件所需、儿童使用、专利到期前一年尚没有提出注册申请的药品为纳入条件[3],以纳入鼓励仿制药品目录的仿制药按规定予以优先审评审批和将目录内的重点化学药品、生物药品关键共性技术研究纳入国家相关科技计划为主要保障、激励措施[3-4],自第二批鼓励仿制药品目录起每年年底更新一次鼓励仿制药品目录政策的制度设计。三是以2019年下半年第一批鼓励仿制药品目录发布为标志的政策执行和调整阶段:在政策执行过程中,除发布了两批鼓励仿制药品目录外,鼓励仿制药品目录政策还与其他政策产生关联,其中以国家医保局《2020年国家医保药品目录调整工作方案》为代表。
2 鼓励仿制药品目录纳入品种特点与实施效果
2.1 两批鼓励仿制药品目录纳入品种的特点
目前,已有学者对第一批鼓励仿制药品目录的纳入品种进行了分析,并指出该批鼓励仿制药品目录纳入的品种主要以专利即将过期(仅氟维司群、布瓦西坦、利匹韦林的药品化合物专利尚未过期)且竞争不充分的药品和临床必需、疗效确切、供应短缺的药品为主,兼顾重大传染病防治和罕见病治疗所需、儿童使用等特殊临床用途的品种[5]。
相比第一批鼓励仿制药品目录纳入品种类型丰富的特点,第二批鼓励仿制药品目录纳入品种的类型更为集中。在专利和竞争方面,第二批鼓励仿制药品目录在公示阶段已明确,纳入的17个品种均为2021-2022年专利即将到期的品种,且均无国产药品批文(仅糠酸氟替卡松维兰特罗等4个品种拥有进口药品批文),市场竞争不充分。在特殊临床用途方面,检索各品种的药品说明书发现,全部17个品种均非传染病用药。其中仅依利格鲁司他的适应证戈谢病为国家卫生健康委《第一批罕见病目录》认定的罕见病;吡仑帕奈适用于12岁及以上癫痫患者,为儿童用药。在临床必需、疗效确切、供应短缺等方面,将第二批鼓励仿制药品目录内的品种与国家卫生健康委2020年12月30日发布的《国家短缺药品清单》和《临床必需易短缺药品重点监测清单》内的品种进行对照[6],未发现有匹配的品种,即无明显临床必需、疗效确切但供应短缺的品种。综上,第二批鼓励仿制药品目录纳入的品种主要以专利(即将)过期且竞争不充分的品种为主,同时兼顾特殊临床用途的品种。第二批鼓励仿制药品目录中17個品种的基本情况见表2。
2.2 第一批鼓励仿制药品目录的实施效果
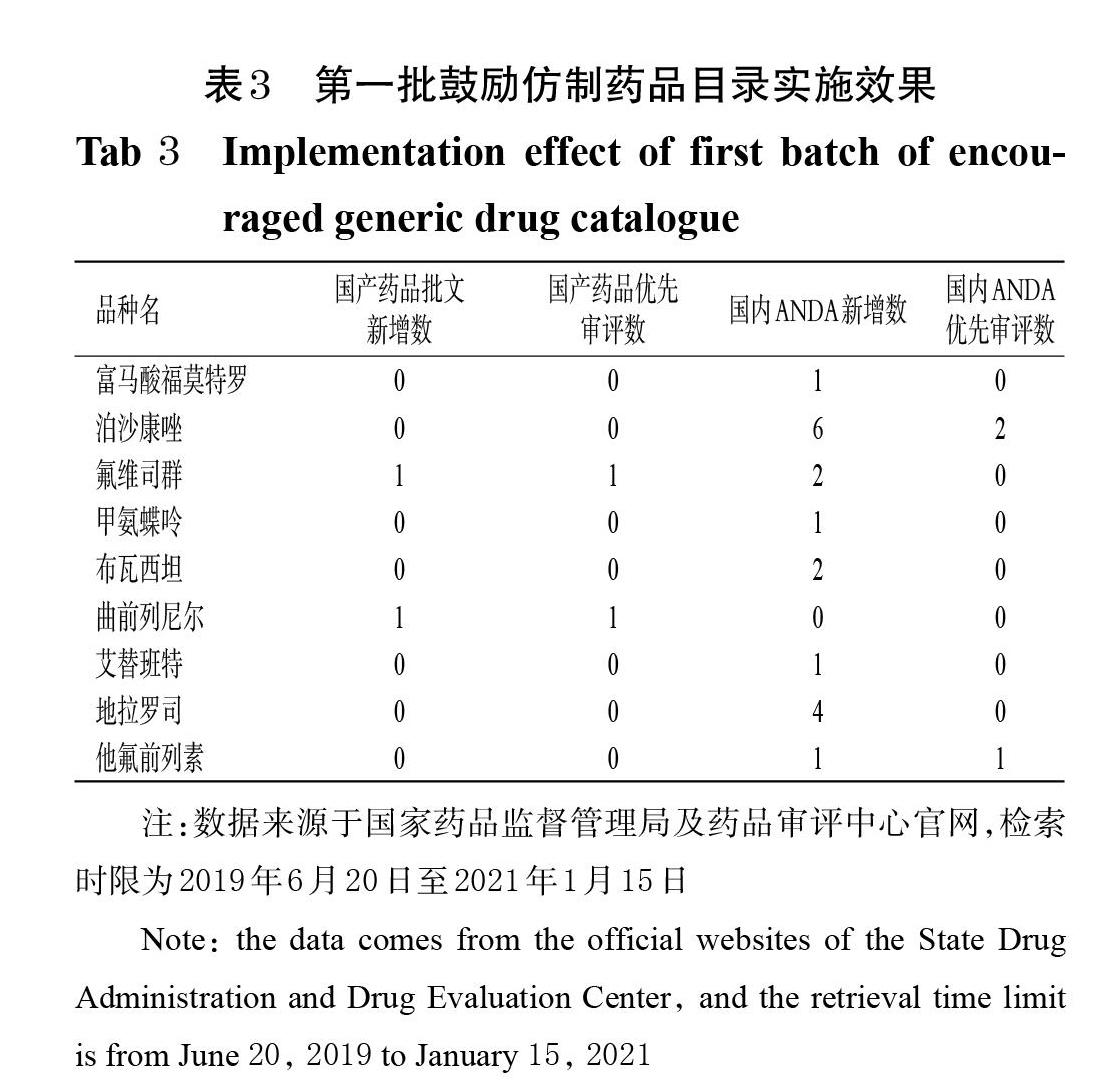
基于结果导向,笔者认为鼓励仿制药品目录品种仿制药的国产药品批文新增数和仿制药申请(ANDA)新增数可代表政策的实施效果。据此,本文对第一批鼓励仿制药品目录品种中的国产药品批文新增数和国内ANDA新增数进行了统计,结果见表3。
如表3所示,从2019年6月20日至2021年1月15日,在仿制药获批上,仅氟维司群和曲前列尼尔各新增国产药品批文1个,但二者ANDA时间均在2019年6月20日《关于第一批鼓励仿制药品目录建议清单的公示》发布前。在ANDA上,同期第一批鼓励仿制药品目录品种的ANDA新增18个,共涉及8个品种,其中新增最多的为泊沙康唑,累计6个;在优先审评方面,鼓励仿制药品目录内品种的ANDA并未全部被纳入优先审评,除已获批的氟维司群和曲前列尼尔外,仅3个ADNA被纳入优先审评,占比仅16.67%。此外,在品种特点上,除甲氨蝶呤因被纳入《国家短缺药品清单》体现出了其临床必需、疗效确切但供应短缺的特点外,其余6个品种均为专利(即将)到期但竞争不充分的品种[5];其中地拉罗司因适用于儿童、曲前列尼尔因其适应证肺动脉高压为国家卫生健康委《第一批罕见病目录》认定的罕见病[7],故二者皆为特殊临床用途的品种。
2.3 鼓励仿制药品目录品种纳入医保情况分析
国家医疗保障局发布的《2020年国家医保药品目录调整工作方案》明确将医保目录外的在“临床急需境外新药名单、鼓励仿制药品目录或鼓励研发申报儿童药品清单中,且于2020年8月17日前经国家药监部门批准上市的药品”纳入2020年药品目录调整范围[8],首次实现了医保目录和鼓励仿制药品目录政策层面的联动。从实际看,第一批鼓励仿制药品目录涉及的33个品种中,有12个为2017年版国家医保药品目录已纳入品种。2019、2020年医保目录分别新纳入品种218个、119个[9-11],其中分别新纳入鼓励仿制药品目录内品种各3个(占比分别为1.4%和2.5%),占比略有上升。鼓励仿制药品目录内品种新纳入国家医保目录情况见表4。
3 鼓励仿制药品目录政策发展趋势与存在问题
3.1 專利导向的回归
相较于第一批鼓励仿制药品目录中仅3个品种的化合物专利尚未过期,第二批鼓励仿制药品目录纳入品种最大的不同点在于纳入品种均为2021-2022年专利即将到期的品种,且临床必需但供应短缺类和特殊临床用途类的药品占比大幅下降,表明鼓励仿制药品目录的专利导向显著增强,这更为契合2017年《意见》中指出的“定期发布专利权到期、终止、无效且尚无仿制申请的药品清单”的初衷[2]。第一批鼓励仿制药品目录纳入品种类型的多样性则更多地体现出了政府对该目录功能多样化的探索。
在鼓励仿制药品目录政策的效果上,本文通过分析第一批鼓励仿制药品目录的实施情况后可发现,企业对专利(即将)到期但竞争不充分的品种更具仿制热情。此类品种因具备市场独家性、临床和市场价值较高、首仿药潜在的先发优势等特点,加之专利壁垒即将到期,在理论上对企业更具吸引力。用于传染病防治、罕见病治疗、儿童使用的特殊临床用途的品种和临床必需、疗效确切但供应短缺的品种,因市场空间相对狭小和中标价过低、缺乏利润空间、采购方式不健全[12],若仅以优先审评审批为主要的鼓励仿制激励措施,并不能解决企业研发积极性差的问题,仍需其他政策的合力。
在外部政策上,第一批鼓励仿制药品目录发布后,对仿制药品而言,影响最为直接的专利纠纷处置问题得到了进一步明确。2020年10月,全国人民代表大会常务委员会通过了《专利法》的第4次修改,并在其中的第七十六条对药品专利链接制度进行了原则性规定[13]。2021年7月,国家药监局发布《药品专利纠纷早期解决机制实施办法(试行)》,标志着我国药品专利链接制度的正式建立,并将进一步打破专利问题对鼓励仿制药品目录政策的掣肘。
综上,鼓励仿制药品目录政策回归专利导向是政策初衷回归、实施效果反馈和政策大环境演变导致的必然趋势。
3.2 优先审评制度的缺失
根据2018年《意见》和《通知》,鼓励仿制药品目录政策的激励措施主要包括2个方面:一是给予优先审评审批;二是将目录内的重点化学药品、生物药品的关键共性技术研究纳入国家相关科技计划。因后者仅针对共性技术,优先审评实际上成为了针对企业仅有的直接激励性措施,但当前制度的落实和实际的执行情况均不甚理想。
在制度落实上,继2019年版《药品管理法》后,2020年新发布的《药品注册管理办法》再次以部门规章的形式明确了包括优先审评在内的4类药品加快上市的注册程序。2020年7月,国家药监局发布的《药品上市许可优先审评审批工作程序(试行)》规定了优先审评审批程序实施办法的适用范围仅限于创新药、改良型新药、符合条件的疫苗、儿童用药品新品种、剂型和规格及纳入突破性治疗药物程序或符合附条件批准的药品[14],不含鼓励仿制药品目录内品种的仿制药。可见,《药品上市许可优先审评审批工作程序(试行)》并未体现2018年《意见》和《通知》的要求,鼓励仿制药品目录内品种的仿制药优先审评的制度实际上仍未建立。
在实际执行上,以第一批鼓励仿制药品目录为例,18个新增的ANDA中仅3个被纳入优先审评。进一步检索发现,因制度缺失,被纳入优先审评的品种均在2020年7月前获得承办和公示,且均以2020年7月废止的《总局关于鼓励药品创新实行优先审评审批的意见》中的其他标准为纳入优先审评的依据,如“在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请”[15],并存在不同公司仿制同一品种、仅部分公司的仿制药被纳入优先审评的情况。整体而言,给予鼓励仿制药品目录内品种ANDA优先审评政策的实际落实情况不佳。
3.3 与医保目录联动性的增强
就理论上而言,鼓励仿制药品目录政策可进一步改变我国“专利悬崖”现象不明显的现状,并对鼓励仿制药品目录内非医保品种进入医保目录具有间接推动作用[16]。当专利过期或即将过期的某品种被纳入鼓励仿制药品目录,且有企业递交ANDA后,原研企业为应对利润急剧下降的“专利悬崖”现象,将会有更大的动力在仿制药即将上市前通过以量换价的形式使其进入医保,借此巩固和扩大市场,进而实现鼓励仿制药品目录和医保目录实践层面的联动。2019年、2020年医保目录顺应了这一思路,并且在实践中也取得了一定效果。以第一批鼓励仿制药品目录中的他氟前列素为例,谈判进入2019年医保目录后,他氟前列素支付价格为74.8元,对比进入医保目录前的价格(310元)[17],降幅达75.8%。随着鼓励仿制药品目录政策执行的延续,更多企业开展了目录内品种的仿制,预计后期鼓励仿制药品目录品种通过谈判降价进入医保目录的趋势将更为明显。
4 讨论
4.1 坚持鼓励仿制药品目录的专利导向
鼓励仿制药品目录政策回归专利导向是政策初衷回归、实施效果反馈和政策大环境演变所导致的必然趋势。在理顺专利纠纷处置问题的基础上,以第二批鼓励仿制药品目录为参照,坚持2017年《意见》的初衷,坚持鼓励仿制药品目录的专利导向,将目录纳入重点集中于专利(即将)到期且竞争不充分的品种,通过发布鼓励仿制药品目录、明确鼓励企业仿制、完善审批等环节给予的优惠待遇,将更有利于充分发挥鼓励仿制目录政策的优势。
4.2 完善鼓励仿制药品目录的配套激励措施
为落实2018年《意见》和《通知》要求,进一步提升鼓励仿制药品目录政策实施效果,应进一步完善鼓励仿制药品目录的配套激励措施。首先,应填补《药品上市许可优先审评审批工作程序(试行)》鼓励仿制药品目录品种ANDA优先审批资格的空白。此外,还可进一步探索给予率先仿制并获批上市的鼓励仿制药品目录内品种“首仿市场独占期”。给予“首仿市场独占期”意味着药品监管部门在特定期限内将不再受理其他ANDA,直至独占期结束或资格被取消。以美国为例,其授予独占期的对象不仅包括罕见病用药、新化学实体、儿科用药、补充新药申请和专利挑战成功的首仿药,还包括基于美国FDA竞争性仿制疗法指南、由企业申请并经FDA认定的竞争不足的仿制药[18-19]。当前,我国的《药品专利纠纷早期解决机制实施办法(试行)》仅对首个挑战专利成功且首个获批上市的化学仿制药品授予“首仿市场独占期”,条件较为苛刻,鼓励仿制药品目录内品种难以满足上述两个“首个”要求。基于此,笔者认为可借鉴美国竞争性仿制疗法指南,探索符合鼓励仿制药品目录政策特点的“首仿市场独占期”制度,给予经政府部门认定的市场竞争不充分品种的仿制药一定的市场独占期,加大政策激励力度。
4.3 加强鼓励仿制药品目录的政府部门间合作
国家卫生健康委是当前鼓励仿制药品目录的发布部门,但鼓励仿制药品目录政策的执行依然需要多个政府部门的合作与协调。当前,鼓励仿制药品目录政策的政府部门间合作主要体现在以科技部、工业和信息化部、知识产权局等有关部门和国家卫生健康委在制定目录时筛选专利(即将)过期药物为代表的政策和目录制定环节,但在政策执行环节的合作仍需加强。国家药监局的《药品上市许可优先审评审批工作程序(试行)》并未贯彻落实《通知》要求给予鼓励仿制药品目录品种仿制药以优先审评待遇,这背后折射出的问题即为鼓励仿制药品目录的部际间合作与协调不畅。国家医疗保障局《2020年国家医保药品目录调整工作方案》明确了鼓励仿制药品目录向医保目录的转化路径,是当前少有的政策执行层面的多部门政策联动,有助于进一步发挥鼓励仿制药品目录的功能作用,但是否能成为常态化举措也需进一步观察。在未来,为进一步促进仿制药研发、提升仿制药质量疗效、提高药品供应保障能力,更好地满足临床用药及公共卫生安全需求,除了进一步推动鼓励仿制药品目录、仿制药质量和疗效一致性评价等政策的实施外,还应进一步加强政府部门间协调和合作。
5 结语
近年来,我国仿制药行业取得了快速发展,但广大人民群众对高质量仿制药的需求与现行药品可及性和可负担性相比,还有一定差距。为更好地满足我国日益增长的临床用药及公共卫生安全需求、加快市场竞争不充分等类型药品的仿制、实现仿制药行业高质量发展,应在认识和把握我国鼓励仿制药品目录政策专利导向回归、优先审评审批制度缺失、与医保目录联动性增强的趋势和特点基础上,继续完善我国鼓励仿制药品目录政策,进一步坚持鼓励仿制药品目录的专利导向、完善鼓励仿制药品目录的配套激励措施、加强鼓励仿制药品目录的政府部门间合作,充分发挥鼓励仿制药品目录的引导作用,促进我国由仿制药大国向仿制药强国转变。
参考文献
[ 1 ] 国务院.中药品种保护条例:国务院令第106号[EB/OL].(1992-10-14)[2021-03-10]. http://www.nhc.gov.cn/fzs/s3576/201808/8ad11ae7578441589e7cea5beecdcb94.shtml.
[ 2 ] 中共中央办公厅,国务院办公厅.中共中央办公厅国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[EB/OL].(2017-10-08)[2021-03-10]. http://www.gov.cn/gongbao/content/2017/content_5232362.htm.
[ 3 ] 国务院办公厅.关于改革完善仿制药供应保障及使用政策的意见:国办发〔2018〕20号[EB/OL].(2018-04-03)[2021-
01-30]. http://www.gov.cn/zhengce/content/2018-04/03/content_5279546.htm.
[ 4 ] 国家卫生健康委,国家发展改革委,教育部,等.关于印发加快落实仿制药供应保障及使用政策工作方案的通知:国卫体改发〔2018〕53号[EB/OL].(2018-12-29)[2021-01-
30]. http://www.gov.cn/xinwen/2019-01/03/content_5354-
543.htm.
[ 5 ] 王圣鸣,田侃,文庆,等.中国第一批鼓励仿制药品目录的纳入品种分析[J].卫生经济研究,2020,37(7):26-30.
[ 6 ] 国家卫生健康委办公厅,国家发展改革委办公厅,工业和信息化部办公厅,等.关于印发国家短缺药品清单的通知:国卫办药政发〔2020〕25号[EB/OL].(2020-12-30)
[2021-01-30]. http://www.nhc.gov.cn/yaozs/s7653/202012/f30aad8ec4ba48a9afa2e559f4d20e7c.shtml.
[ 7 ] 高红英,李其,陈娟娟,等.地拉罗司治疗重型β-地中海贫血铁过载患儿临床疗效及安全性研究[J].中国当代儿科杂志,2011,13(7):531-534.
[ 8 ] 国家医疗保障局.国家医疗保障局关于公布《2020年国家医保药品目录调整工作方案》和《2020年国家医保药品目录调整申报指南》的公告[EB/OL].(2020-08-17)[2021-
01-30]. http://www.nhsa.gov.cn/art/2020/8/17/art_37_3407. html.
[ 9 ] 国家医疗保障局.国家基本医疗保险、工伤保险和生育保险药品目录解读[EB/OL].(2019-08-22)[2021-01-30]. http://www.nhsa.gov.cn/art/2019/8/22/art_38_1677.html.
[10] 國家医疗保障局. 《关于将2019年谈判药品纳入<国家基本医疗保险、工伤保险和生育保险药品目录>乙类范围的通知》政策解读[EB/OL].(2019-11-28)[2021-01-30].http://www.nhsa.gov.cn/art/2019/11/28/art_38_2056.html.
[11] 国家医疗保障局.《国家医保局人力资源社会保障部关于印发<国家基本医疗保险、工伤保险和生育保险药品目录(2020年)>的通知》政策解读[EB/OL].(2020-12-28)
[2021-01-30]. http://www.nhsa.gov.cn/art/2020/12/28/art_38_4219.html.
[12] 盛亚楠,李勇,马爱霞,等.我国短缺药品供应保障政策研究[J].卫生经济研究,2017,34(8):57-60.
[13] 全国人民代表大会常务委员会.中华人民共和国专利法[EB/OL].(2020-11-19)[2021-01-30]. http://www.npc.gov.cn/npc/c30834/202011/82354d98e70947c09dbc5e4ee-
b78bdf3.shtml.
[14] 國家药监局.关于发布《突破性治疗药物审评工作程序(试行)》等三个文件的公告:2020年第82号[EB/OL].(2020-07-01)[2021-03-15]. https://www.nmpa.gov.cn/zhuanti/ypqxgg/ggzhcfg/20200708151701834.html.
[15] 国家食药监总局.总局关于鼓励药品创新实行优先审评审批的意见:食药监药化管〔2017〕126号[EB/OL].(2017-12-21)[2021-01-30]. https://www.nmpa.gov.cn/xxgk/ fgwj/gzwj/gzwjyp/20171228172301452.html.
[16] 陈志洪,张洲驰.带量采购下中国药品市场变局:以降血脂药为例[J].价格理论与实践,2019(12):19-22,111.
[17] 赵亮,林其敏,韩晟等.他氟前列素等前列腺素类药物用于青光眼治疗的药物经济学分析[J].中国医疗保险,2016(2):56-59.
[18] 董丽,杨悦.美国药品专利期延长与市场独占期规定研究[J].中国医药导刊,2006,8(5):384,391-392.
[19] FDA. Competitive generic therapies[EB/OL].(2020-03-16)
[2021-07-08]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/competitive-generic-the- rapies.
(收稿日期:2021-03-22 修回日期:2021-07-08)
(编辑:林 静)

