18F-FDG PET/CT对淋巴瘤治疗后股骨头坏死的评估
宋乐,张卫方
北京大学第三医院核医学科,北京 100191;*通信作者 张卫方 tsy1997@126.com
股骨头坏死是股骨头血液循环障碍引起骨组织坏死、修复,导致股骨头结构改变及塌陷,引起髋关节疼痛及功能障碍。非创伤性股骨头坏死的主要病因包括应用皮质类固醇激素、长期过量饮酒、减压病、血红蛋白病、自身免疫性疾病等[1]。淋巴瘤化疗过程中常规使用大剂量糖皮质激素,容易出现股骨头坏死,发生率约为15%[2]。股骨头坏死早期通过保守治疗,能够改善或者延缓病情进展,晚期需要关节置换手术治疗[3-4]。对于淋巴瘤化疗或随访过程中出现髋部疼痛的患者,髋关节MRI检查有助于及时诊断股骨头坏死[5]。然而,40%的股骨头坏死缺乏相应的临床症状[2]。18F-FDG PET/CT是淋巴瘤分期及疗效评估的重要影像学检查[6],而股骨头坏死的18F-FDG PET/CT研究仅见个案报道[7-8]。本研究拟回顾性分析淋巴瘤患者股骨头坏死的临床及18F-FDG PET/CT表现,以提高对本病的认识,帮助患者及时诊断和治疗。
1 资料与方法
1.1 研究对象 回顾性收集淋巴瘤化疗后,并于2014年9月—2020年12月在北京大学第三医院行18F-FDG PET/CT检查,诊断为股骨头坏死的患者。股骨头坏死的影像学诊断标准[1]:MRI示股骨头T1WI局限性软骨下线样低信号或T2WI“双线征”;CT示股骨头呈现以下征象之一:①正常的星芒状结构缺失,负重区骨小梁缺失断裂;②骨硬化带包绕囊变区或软骨下骨断裂;③坏死骨与修复骨交错存在。查询患者病历资料或电话随访,记录患者是否存在髋部、臀部疼痛、酸胀不适等症状及后续治疗、随访情况。排除标准:临床资料缺失或既往确诊股骨头坏死的患者。共纳入12例,其中男9例,女3例,中位年龄29.0(25.0~38.0)岁。本研究经北京大学第三医院伦理委员会审批通过(伦理号:LM2020001),患者均知情同意。
1.2 PET/CT检查 患者空腹6 h以上,检查前血糖低于11.1 mmol/L,按照3.7~5.5 MBq/kg静脉注射18FFDG(北京原子高科股份有限公司,放化纯度>95%)。注射后60 min左右,应用Siemens Biograph 64 PET/CT扫描仪进行图像采集。CT扫描参数:管电压120 kV,有效管电流100 mAs,螺距0.9。PET采集5~6个床位,每个床位采集2 min,True X方法重建,迭代3次,子集21,高斯滤波,半峰宽5.0,放大倍数1.4。
1.3 图像分析 由2名具有10年以上工作经验的核医学科副主任及以上职称的医师共同阅片,应用北京麦迪克斯影像工作站进行PET/CT图像分析,必要时请第3名副主任医师讨论达成一致意见。根据2019年国际骨微循环研究协会方案对股骨头坏死进行分期[1]:1期,MRI示股骨头低信号带,CT未见异常;2期,CT示骨硬化、局部骨质疏松;3期,CT示软骨下骨折,股骨头塌陷;4期,髋关节骨关节炎伴关节间隙狭窄,髋臼改变及破坏。与邻近相对正常区域股骨头对比,观察股骨头坏死病变区域FDG代谢情况,测量病变最大标准化摄取值(SUVmax)。分析股骨头坏死FDG代谢与分期、患者症状的关系。
1.4 统计学分析 采用SPSS 18.0软件,患者年龄、病变SUVmax的分布状态以M(Qr)表示。应用Mann-WhitneyU检验比较不同分期股骨头坏死SUVmax的差异。P<0.05为差异有统计学意义。
2 结果
2.1 股骨头坏死的PET/CT表现 12例患者共22个股骨头受累(累及双侧10例,单侧2例),其中2期17个,3期5个,无1期或4期病变。PET/CT检查前,5例患者表现为髋部、臀部间断或持续疼痛、酸胀或不适1周~2个月,其中3例PET/CT检查后1周内行MRI检查确诊股骨头坏死,见表1。

表1 12例股骨头坏死的18F-FDG PET/CT表现
2期病变SUVmax中位值0.93(0.67~1.48),3期病变SUVmax中位值4.91(3.50~8.48)。不同分期的股骨头病变SUVmax差异有统计学意义(Z=3.173,P<0.01)。与邻近正常股骨头区域对比,3期病变均呈FDG代谢增高,高代谢位于溶骨性破坏区、高密度区或髋关节囊(图1);2期病变中5个FDG代谢增高,高代谢位于高密度区或其边缘(图2),12个病变FDG代谢未见增高(图1)。4例(编号1~4)双侧股骨头病变FDG代谢差异较大(图1),高代谢侧病变均为3期(SUVmax 4.52~9.13);对侧病变为2 期3 例(SUVmax 0.85~3.81),3 期1 例(SUVmax 2.49)。
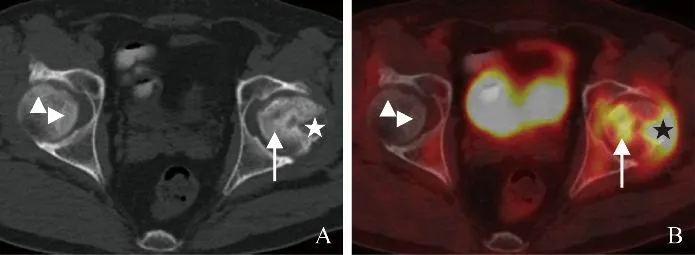
图1 男,55岁,双侧股骨头坏死。CT示左侧股骨头变形,内部见硬化(箭)及软组织密度影(星号),髋关节间隙未见狭窄,符合3期改变(A);PET/CT融合图像示股骨头病变FDG代谢不均匀增高,软组织密度区代谢增高为著,SUVmax 9.13(星号),右侧股骨头见多发环状稍高密度带,符合2期改变,FDG代谢不高,SUVmax 0.85(箭头,B)
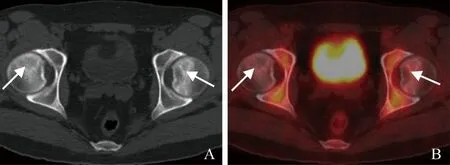
图2 男,25岁,双侧股骨头坏死。CT(A)及PET/CT融合图像(B)示双侧股骨头环状、条状高密度带,均符合2期改变,FDG代谢略增高,左侧SUVmax 1.72,右侧SUVmax 1.10(箭)
2.2 股骨头坏死PET/CT与临床对比 7例无症状患者的股骨头坏死均为2期。5例髋部不适患者中,股骨头坏死3期4例,2期1例,其中4例在15~36个月前行PET/CT检查,当时患者均未诉髋部疼痛等不适,但PET/CT可见股骨头局部密度增高,符合2期股骨头坏死表现,FDG摄取亦未见增高。
3 讨论
3.1 淋巴瘤化疗相关股骨头坏死的临床特点 淋巴瘤化疗相关股骨头坏死多累及双侧,男性多于女性。Ratcliffe等[2]分析100例(男48例,女52例)淋巴瘤化疗后患者的临床及MRI资料,诊断股骨头坏死15例,其中双侧受累10例;男性总体发病率为20.8%,女性为9.6%。本研究中双侧股骨头坏死10例(10/12),男性9例(9/12),与相关研究一致。Ratcliffe等[2]报道40%的股骨头坏死无髋部症状,且均为1~2期病变。本研究结也发现股骨头坏死大部分(7/12)无症状,均为2期,有症状者中大部分(4/5)为3期。此外,本组4例双侧股骨头坏死FDG代谢差异较大,表明双侧病变的发展并不同步,单侧受累的股骨头坏死可能发展为双侧病变,需要随访观察。
3.2 淋巴瘤化疗相关股骨头坏死的PET/CT表现 本研究显示:股骨头坏死的不同阶段FDG代谢水平有差异,与邻近正常股骨头部位对比,3期病变代谢均增高,而2期病变仅少部分(5/22)代谢增高。股骨头坏死SUVmax中位值3期病变高于2期病变,该差异与股骨头坏死不同阶段的病理生理改变有关。股骨头坏死早期为骨细胞和骨髓坏死,FDG代谢不高;随着坏死组织周围骨质修复,炎症细胞浸润,肉芽组织生长,FDG代谢显著增高;晚期软骨下骨折、关节面塌陷、骨性关节炎亦可促进骨质修复、增生,导致FDG代谢增高[9]。因而,通过显示股骨头坏死的形态及FDG代谢情况,PET/CT能够在一定程度上反映其病理生理过程。
3.3 PET/CT的临床应用 PET/CT可以诊断无症状性股骨头坏死。中国成人股骨头坏死临床诊疗指南推荐股骨头坏死高危人群或临床表现为髋部疼痛者进行髋部X线检查,仍然无法诊断者行MRI检查[1]。尽管淋巴瘤患者属于股骨头坏死的高危人群,但对所有无症状的淋巴瘤患者行髋部X线或MRI检查的可行性、检查时间、频次选择等问题均需要综合考虑,而如果仅对已有髋部症状的患者进行X线或MRI检查,部分股骨头坏死已经比较严重,失去保髋治疗的机会。18FFDG PET/CT已成为大部分淋巴瘤患者初始分期、疗效评估及再分期、复发监测的重要检查方法[6]。PET/CT容易检出FDG代谢增高的股骨头坏死,并且不难与淋巴瘤浸润鉴别,前者CT呈高密度或伴囊变、塌陷;后者多见软组织肿块,而无明显骨质破坏[10-11]。对于FDG代谢不高的股骨头坏死则需避免漏诊,尤其是对于无症状患者。Barille等[12]回顾性分析22例由于其他原因行盆腔CT后确诊股骨头坏死患者的病例资料,发现当时的CT诊断报告对于股骨头坏死的漏诊率高达89%。本组有症状的4例患者在既往PET/CT检查中发现了无症状性2期股骨头坏死,而当时的PET/CT报告均未给予诊断。因此,应用PET/CT评估淋巴瘤时,需观察双侧股骨头的密度、形态及代谢改变,寻找股骨头坏死的征象,为患者赢得早期治疗的机会。
股骨头坏死的演变存在个体差异,影像学检查有助于预测股骨头坏死的预后,以更好地指导临床治疗,帮助患者选择适宜的生活方式[13-15]。Karimova等[13]回顾性分析80例儿童及青少年患者血液系统疾病伴发股骨头坏死的临床资料及MRI图像,发现病变大小是评估预后的最佳指标,病变超过股骨头30%的患者很可能发生进展,需要关节置换手术。Kubota等[14]报道18F-氟化钠PET/CT显像以SUVmax 6.45为阈值,预测股骨头坏死发生塌陷的敏感度、特异度分别为0.80、0.92。本组病例中股骨头坏死的演变存在个体差异,由于病例较少,未进行深入探索。
3.4 本研究的局限性 本研究为回顾性分析,纳入病例较少,存在选择偏倚。此外,仅少部分入组患者在PET/CT提示股骨头坏死后才行髋关节MRI检查,其余大部分患者均无同期MRI检查结果,因而无法诊断1期股骨头坏死,未能评估18F-FDG PET/CT对于1期股骨头坏死的诊断价值。
总之,淋巴瘤化疗后发生的股骨头坏死大多累及双侧,3期病变FDG代谢增高,伴有髋部疼痛等不适症状;2期病变大部分FDG代谢不高,亦无症状。PET/CT在评估淋巴瘤的同时,有助于诊断股骨头坏死。

