黑参煎剂对小鼠下肢缺血模型血管新生影响的机制研究
李世征,贾轶东,袁 媛
(1.辽宁中医药大学附属医院,辽宁 沈阳 110033;2.辽宁中医药大学,辽宁 沈阳 116600)
下肢缺血性疾病是由下肢动脉狭窄或闭塞所致的严重的肢体血液循环障碍,可引起溃疡、坏疽、跛行等症状,致残率、病死率高[1-2]。缺血区血管新生不足是缺血性疾病的主要病理改变,因此促进血管新生、恢复血供是实现损伤修复的关键[3-4]。西医促血管新生技术,虽可有效重建缺血部位的侧支循环,但存在诸多不确定因素,短期内难以在临床中广泛应用,探讨有效、简便可行的防治方法是临床研究的重要课题。中医药以多靶点、多效应、整体调节为特点,在缺血性疾病的防治中具有独特优势。中医认为,下肢动脉硬化闭塞是元气亏虚,气血相失,血运不畅所致,气滞、血瘀、痰凝、壅滞经络是主要的病理表现,气虚为发病之根本,因此应重视补气[5-7]。人参大补元气,主补五脏,固脱生津,通血脉,主治病症符合动脉硬化的病因病机及相关表现[8-9]。黑参是九蒸九晒炮制的人参,是一种人参的新炮制品[10]。本研究旨在探讨黑参煎剂对小鼠下肢缺血模型血管新生的影响及可能的作用机制,为黑参煎剂在下肢缺血性疾病临床防治中的应用提供一定理论依据。
1 材料与方法
1.1 实验动物 购入雄性载脂蛋白E(Apolipoprotein E,ApoE)基因敲除小鼠84只和雄性C57野生小鼠42只后,饲养于辽宁中医药大学实验动物中心SPF级动物室内[许可证号:SYXK(辽)2013-0009]。本项目严格遵循动物福利伦理相关法规和各项规定开展研究。
1.2 试剂与仪器 黑参煎剂由辽宁省中医药研究院自制。水合氯醛(江西德成制药有限公司,国药准字H36022087)。 CD34、α-平滑肌肌动蛋白(α-smooth muscleactin,α-SMA)一抗及相应二抗均购自北京百奥莱博科技有限公司。激光多普勒血流仪(吉安德尔科技有限公司);轮转式切片机(德国leica公司);E-Gel Imager凝胶成像仪、Fisher Biotech电泳仪均为美国Thermo Fisher Scientific公司生产。
1.3 实验方法
1.3.1 小鼠下肢缺血模型的建立:4周龄雄性ApoE基因敲除小鼠84只和4周龄雄性C57野生小鼠42只,购入后适应性饲养1周。观察小鼠状态良好后,ApoE基因敲除小鼠和C57野生小鼠,分别以高脂饮食和正常饲料喂养。饲养环境为恒温21~22 °C,湿度55%~65%,同时保持安静通风,所有小鼠自由食水,12 h昼夜节律。喂养4周后,采用改良缩窄股动脉法复制小鼠右下肢动脉慢性缺血模型,具体方法如下:在室温(22℃)条件下,给予小鼠10%水合氯醛(3 ml/kg)腹腔注射麻醉后,仰卧固定于手术台上,用酒精消毒皮肤,并剪开2~2.5 cm的纵形切口。在大腿表面可看到一条红色血管,循向上血管隐没,在隐没处剪开1个小口,向下沿着血管剪开1 cm,根据血管走形再向上剪开1.5 cm。分离显露游离股动脉,4-0丝线结扎时连同7号细注射器系牢后抽出注射器针头,缝合切口。C57野生小鼠只切开并分离动静脉后缝合,不结扎缩窄,作为假手术组。ApoE基因敲除小鼠右下肢动脉缩窄术后进行激光多普勒血流测定,散光强度降低而不消失则造模成功。评价模型成功后,将ApoE基因敲除小鼠编号,随机分为模型对照组和黑参煎剂组,每组42只。正品人参炮制后制成黑参,煎煮后浓缩,黑参煎剂组取0.5 ml/次,每日灌胃1次,模型对照组和假手术组取0.9%氯化钠溶液,0.5 ml/次,每日灌胃1次,连续灌胃14 d。
1.3.2 下肢缺血症状观察与评价:利用体式显微镜观察小鼠后肢外观(脱毛、趾甲增厚、坏死)评分。评分标准[11]:0分表示无坏死;1分表示1个脚趾坏死;2分表示2个或多个脚趾坏死;3分表示出现足坏死;4分表示下肢有坏死;5分表示是整个大腿自行离断。注意并记录周边红肿情况。
1.3.3 激光多普勒检测小鼠缺血下肢血流灌:术前及术后即刻、7、14、21、28 d行激光多普勒扫描,观察小鼠下肢血流灌注情况。
1.3.4 HE染色病理检测:术后28 d处死小鼠,取右下肢腓肠肌,放置到4%多聚甲醛中固定,然后依次常规行脱水包埋、切片烤片、脱蜡、染色(苏木素-伊红)、脱水封片等,予以显微照像,观察肌肉组织病理。并进行组织病理评价,评定指标包括:肌纤维萎缩是否存在、是否出现变性坏死、是否有炎症反应、是否存在钙化,按由轻至重分别计为0~4分,评分越高说明病变程度越严重。
1.3.5 免疫组化法检测血管新生:取小鼠右下肢腓肠肌,行免疫组化实验,进行CD34、α-SMA表达检测。常规石蜡切片、脱蜡至水,行抗原修复,利用5% BSA进行封闭,滴加一抗,于4 ℃条件下孵育过夜,然后再予以二抗滴加,采用DAB显色,用苏木精进行复染,脱水透化,予以封片,显微照像,并观察记录CD34、α-SMA表达。
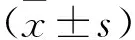
2 结 果
2.1 各组小鼠下肢缺血症状评分比较 观察发现,下肢缺血模型建立以后,小鼠右下肢出现无法站立、步态异常等行为表现。假手术组右下肢无任何异常现象,模型对照组与黑参煎剂组右下肢足部出现不同程度发黑、坏死,其中黑参煎剂组的症状优于模型对照组。各组小鼠右下肢缺血症状评分比较,差异有统计学意义(P<0.05)。与假手术组相比,模型对照组与黑参煎剂组右下肢缺血症状评分均高,差异有统计学意义(P<0.05),提示下肢缺血模型构建成功。与模型对照组相比,黑参煎剂组下肢缺血症状评分低,差异具有统计学意义(P<0.05)。见表1。
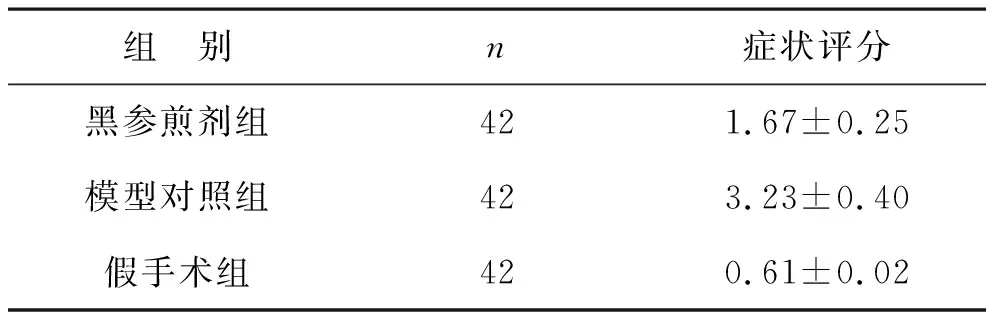
表1 各组小鼠右下肢缺血症状评分比较(分)
2.2 各组小鼠激光多普勒图像分析 高脂喂养的黑参煎剂组和模型对照组,右后肢动脉结扎缩窄手术结束即进行多普勒检测,结果显示术侧基本无血流灌注,对侧血流灌注良好,表明造模成功。术后即刻、7、14、21、28 d进行激光多普勒检测,监测小鼠右后肢血流变化情况,黑参煎剂组术后下肢血流恢复情况优于模型对照组(图1)。
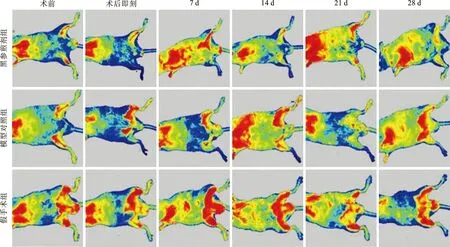
图1 各组小鼠右后肢激光多普勒扫描图
2.3 各组小鼠HE染色分析 HE染色光镜下观察假手术组动脉壁三层结构界限清晰,结构完整;黑参煎剂组与模型对照组相比,内皮细胞水肿程度、管壁增厚、中性粒细胞浸润均有所减轻(图2)。右下肢HE染色病理评分比较,黑参煎剂组与模型对照组的评分均高于假手术组(P<0.05);黑参煎剂组右下肢HE染色病理评分低于模型对照组(P<0.05)。
图2 各组小鼠右下肢动脉病理图(HE染色,×200)

表2 各组小鼠右下肢HE染色病理评分比较(分)
2.4 各组小鼠右下肢腓肠肌CD34、α-SMA表达比较 见表3。与假手术组、模型对照组相比,黑参煎剂组的右下肢腓肠肌 CD34、α-SMA表达均高,差异有统计学意义(P<0.05)。
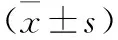
表3 各组小鼠右下肢腓肠肌CD34、α-SMA表达比较
3 讨 论
采用下肢股动脉结扎法构建下肢缺血模型,可较好地模拟该类疾病患者下肢缺血的病理改变,呈现下肢缺血发生、演变及修复等多个过程[12-15]。本实验根据以往研究经验,成功构建了小鼠右下肢缺血模型,利用显微镜观察小鼠右下肢缺血症状并进行量化积分,结果显示,黑参煎剂能够明显改善下肢缺血症状;激光多普勒图像分析显示,黑参煎剂能够有效促进缺血下肢血流恢复;同时HE染色结果表明,黑参煎剂能够改善下肢缺血组织病理改变,缓解炎症反应。
黑参煎剂中的有效成分主要有皂苷类、多糖类挥发性油、氨基酸、维生素、微量元素等。已有研究表明[16-17],皂苷类具有抗肿瘤、抗炎、抗氧化、降低血糖等作用,与传统的白参和红参相比较,黑参的炮制方法使抗衰老、抗氧化和提高机体免疫力的作用增强[18-21]。前期研究结果显示,在肾上腺素加冷刺激导致的急性血瘀的大鼠模型中,黑参可以显著降低大鼠全血黏度,具有改善血液流变学的作用,同时能够抑制血栓形成。本研究表明,黑参煎剂对小鼠下肢缺血具有保护作用,能够促进血管新生。
CD34+是一种跨膜糖蛋白,作为内皮祖细胞(Endothelial progenitor cells,EPCs)的表面标志物,其水平能够较好地反映EPCs的数量[22]。机体出现缺血刺激时,CD34+被动员出骨髓,进而参与到血管新生过程,CD34+抗原在新生的血管内皮中大量表达,具有重要标志性意义[23-25]。血管新生过程中,平滑肌细胞大量存在,能够合成弹性蛋白、胶原等多种物质,形成血管基质。α-SMA作为一种血管平滑肌细胞表型标志物,在低氧环境下使血管平滑肌细胞的合成与分泌功能激活,产生许多生长因子,对血管内皮与其他细胞活性发挥保护作用,对缺血血管功能维持及恢复有着重要意义[26-27]。本研究结果显示,黑参煎剂能够增加小鼠右下肢缺血肌肉CD34、α-SMA表达,改善缺血血管侧支生成,促进血管新生。
综上所述,黑参煎剂对小鼠下肢缺血具有一定保护作用,能够改善下肢缺血症状,提高CD34、α-SMA表达,促进缺血后血管生成。

