实时剪切波弹性成像在非酒精性脂肪性肝病临床分型中的应用价值研究
张秋秋,刘学彬,陈思佳,安春音
(1.川北医学院,四川 南充 637000;2.川北医学院第二临床学院·南充市中心医院超声科,四川 南充 637000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种具有代谢应激性的脏器损伤,与人体遗传易感、胰岛素的抵抗均存在着密切相关性,与酒精性肝病的病理变化无明显的差异,但患者无过量饮酒的特点。非酒精性脂肪性肝病诊疗指南(2010年修订版)[1]、非酒精性脂肪性肝病诊断标准[2]中均指出,其临床分型包括非酒精性单纯性脂肪肝(non-alcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、非酒精性脂肪性肝硬化三种类型。2017美国非酒精性脂肪性肝病诊断与管理指南[3]中指出,应该增加诊断 NAFLD 的无创检查方法。超声检查是目前诊断脂肪肝的首选无创影像学检查方法[4],而传统超声检查判断脂肪肝及其病变的程度具有一定的主观性[5],且与NAFLD的临床分型并不完全对应,所以无法有针对性地进行诊断和治疗。本文旨在探索应用实时剪切波弹性成像(real-time shear wave elastography,SWE)对NAFLD进行定量评价的方法,以达到应用SWE技术对NAFLD进行临床分型的目的。
1 资料与方法
1.1 一般资料选取2019年10月至2020年10月在南充市中心医院经过超声或者CT诊断为NAFLD131例:其中NAFL组71例,男40例,女31例,年龄28~60岁[(51.0±11.1)岁];NASH组60例,男28例,女32例,年龄25~63岁[(49.5±10.3)岁]。选取同时期在本院体检中心行检查的77例健康志愿者作为对照组。其中男47例,女30例,年龄23~59岁[(48.2±13.8)岁]。诊断标准参照中华医学会肝病学分会、脂肪肝和酒精性肝病学组2010年修订的“非酒精性脂肪性肝病诊断标准”[1],同时满足:①无饮酒史或饮酒折合乙醇量<140克/周(女性<70克/周);②除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;③其中静脉血正常的纳入NAFL组,血清丙氨酸氨基转移酶(ALT)水平高于正常值上限的2倍,纳入NASH组。对照组均排除其他全身性疾病可能累及肝脏者,女性无妊娠,且静脉血肝功能各项指标正常。
1.2 仪器与方法采用PHILIPS EPIQ7彩色多普勒超声诊断仪进行检查,C5-1 超声探头。被检者左侧卧位,右手上举置于头后,充分暴露肝右叶区域肋间隙,取得清晰的二维图像后启动弹性成像模式。避开肝内血管、胆管等。将取样框置于肝右叶包膜下1 cm处,患者屏住呼吸数秒,冻结稳定的图像,选取直径1 cm 的区域(图1),系统自动测量弹性模量值(Emean),测量5 次取平均值。以上述相同方法,选择右肾肾实质,选取直径5 mm 的感兴趣区进行肾实质Emean测量,见图2。计算每位受检者肝脏Emean平均值与肾脏Emean平均值的比值。所有检测均由同 1 名超声医师在同一台彩色超声检查仪上进行。
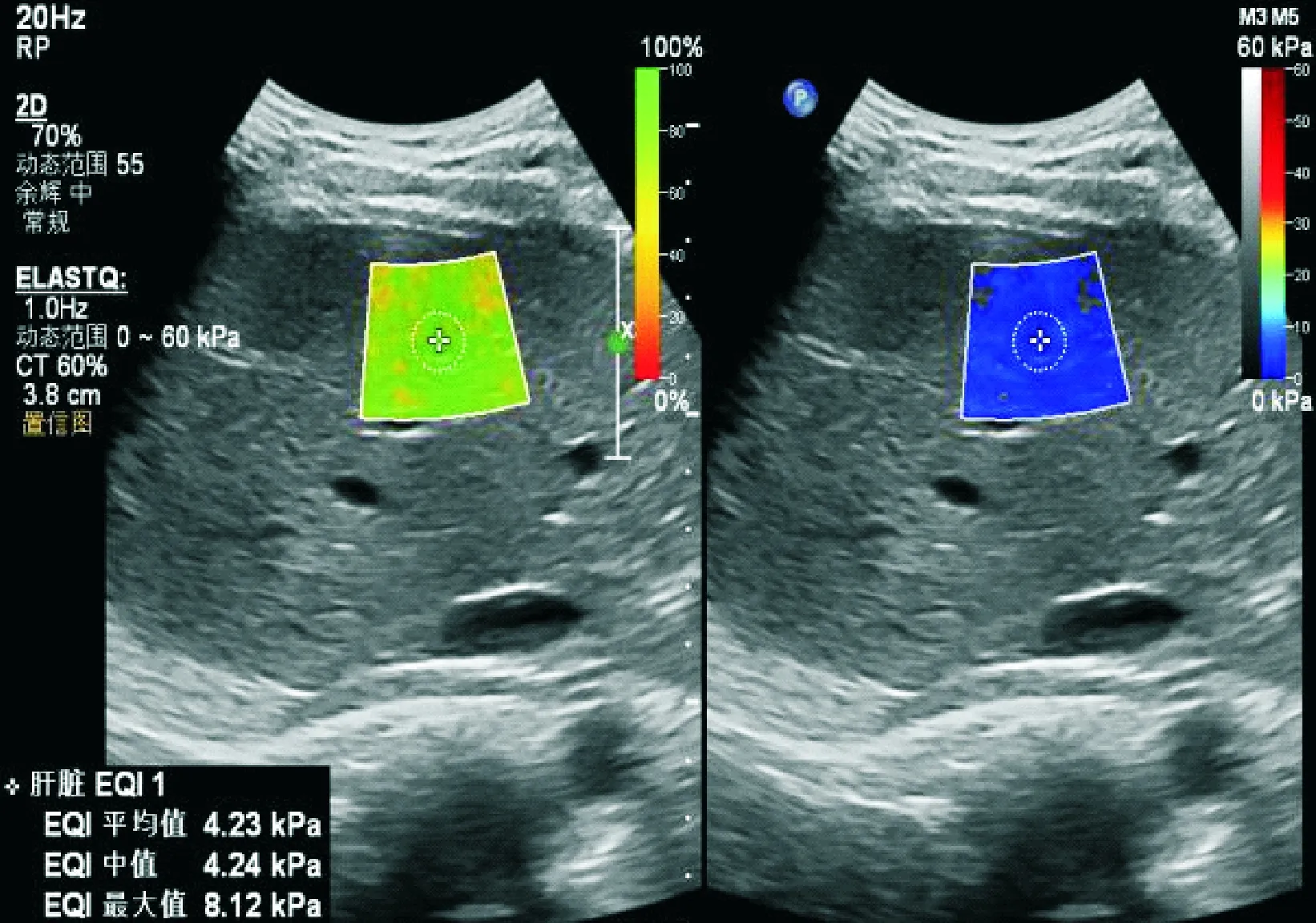
图1 肝脏Emean测量

图2 肾脏Emean测量
1.3 统计学方法应用SPSS 25.0统计软件进行统计学分析。计量资料以均数±标准差表示,两组间比较采用t检验,以肝脏杨氏模量值与肝肾杨氏模量比值分别计算诊断NASH的 ROC 曲线下面积,诊断阈值依据约登指数的最高临界点确定。P<0.05为差异有统计学意义。
2 结果
2.1 三组Emean比较NAFLD组及NAFL组肝脏Emean、肝脏Emean/肾脏Emean均高于正常对照组,差异均有统计学意义(P<0.001);NAFL组肝脏Emean低于NASH组,肝脏Emean/肾脏Emean低于NASH组,差异有统计学意义(P<0.05)。以上各组间肾脏Emean比较,差异均无统计学意义(P>0.05)。见表1。
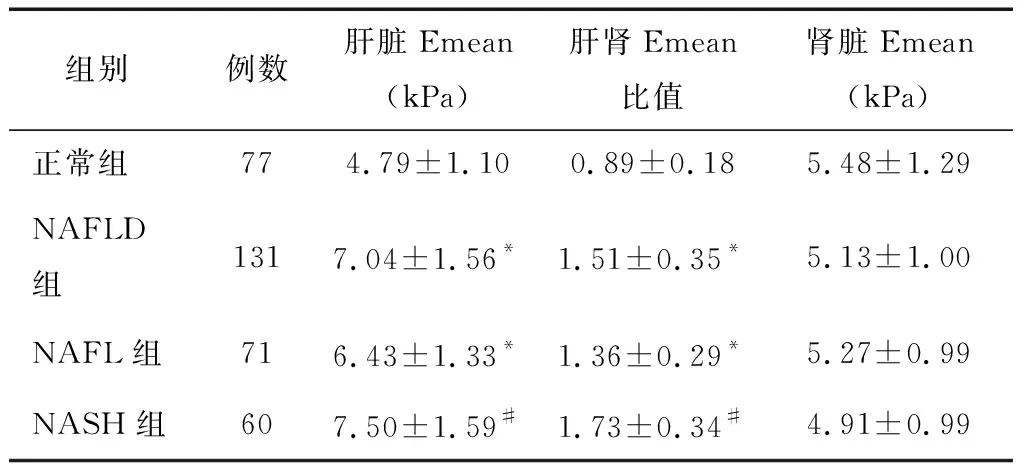
表1 各组间Emean比较
2.2 肝脏杨氏模量值与肝肾杨氏模量比值对NAFL、NASH的诊断价值用肝脏杨氏模量值绘制ROC 曲线,NASH曲线下面积为0.728,敏感度为68.2%,特异度为71.9%,截断值为7.130 kPa。以肝肾杨氏模量比值绘制 ROC 曲线,获得诊断NASH曲线下面积为0.817,敏感度为81.8%,特异度为78.1%,截断值为1.535(图3)。

图3 诊断NASH的ROC曲线 a:肝脏杨氏模量值;b:肝肾杨氏模量比值
3 讨论
随着人们生活水平的提高,脂肪肝的发病率也呈逐年增长的趋势,现已成为我国仅次于病毒性肝炎的第二大肝病[6]。非酒精性脂肪性肝病诊疗指南(2010年修订版)[1]表明:虽然NAFL、NASH都并未发生肝纤维化这一不可逆的病理变化,但是二者的治疗方式不同,NAFL只需要改变生活方式,NASH则同时需要药物的辅助治疗。因此,为了达到及时且有效治疗的目的,对NAFLD 进行早期的诊断、严重程度的评估十分重要。目前只有肝脏活检能对NAFLD进行分级和分期,但因其是有创检查,难以在临床推广。超声检查安全且经济,但无法进行定量诊断。因此,我们需要一种简便、无创、可重复性高的方法对NAFLD进行定量诊断,并进行准确的临床分型。
近年来,由于弹性成像技术的不断发展,用其定量诊断脂肪肝也成为了研究的热点,众多研究[7~10]表明,不同的超声弹性成像技术对于脂肪肝的定量诊断均有重要的意义。如声辐射力脉冲成像技术、瞬时弹性成像技术及 SWE 等。其中前两种技术只能检测距离肝包膜固定深度的肝实质[11,12];而SWE 技术是一种能进行定量以及定性分析的成像技术,能有效的避开管道结构,可自由选择测量的区域,减少了取样的误差,在临床上已得到广泛的应用[13]。
本研究应用SWE 技术测量正常成人以及NAFLD患者的肝脏杨氏模量值,结果表明,NAFLD患者肝脏杨氏模量值明显高于正常对照组,说明脂肪肝患者肝脏弹性值会增加,即肝脏的硬度会增高。吴玉莲等[13~15]都在自己的研究中证明了这一点。但也有研究结果表明,杨氏模量测值与NAFLD病变程度呈负相关,杨氏模量值随着NAFLD病变程度的增加而减低[16,17]。分析造成该结果的原因,考虑超声对轻度脂肪肝的检测不如中重度脂肪肝,因此入选对象中、重度脂肪肝偏多,且高脂饮食所导致的脂肪肝多是以大泡性为主的混合性脂肪变[2],最后测量的数据有一定的偏差。笔者认为,对NAFLD进行超声定量评价的意义在于指导临床分期分型,达到准确诊断,指导精准治疗的目的。其中最为重要的在于识别NASH阶段患者,积极治疗可达到逆转肝功能的目的。与此前研究的不同之处还有,笔者将肝肾Emean比值纳入了研究之中,将NAFLD组与正常组比较、NAFL组与正常组比较、NASH组与NAFL组比较,发现:三组肝脏Emean、肝肾Emean比值差异均有统计学意义(P<0.001),各组间肾脏Emean差异均无统计学意义(P>0.05),证明了不同的病理分期的脂肪肝肝硬度之间有显著差异。进而说明,超声SWE技术测量肝脏Emean能够对NAFL与NASH进行定量鉴别,从而为临床医生提供更准确的NAFLD临床分型参考依据。用肝脏杨氏模量值绘制 ROC 曲线,获得诊断NASH曲线下面积为0.728,敏感度为68.2%,特异度为71.9%。以肝肾杨氏模量比值绘制 ROC 曲线获得诊断NASH曲线下面积为0.817,敏感度为81.8%,特异度为78.1%。表明用肝肾杨氏模量比值来预测NASH,其敏感度及特异度均高于仅用肝脏杨氏模量值来预测。由此可见,如果使用肝脏Emean及肝肾Emean比值共同对NAFLD进行定量临床分型,可能会对该检查方法敏感度的提高有所帮助,也为未来的进一步研究提供了方向。
本研究未将NAFLD的第三种临床分型肝纤维化和肝硬化纳入研究,原因在于:已有众多研究[18,19]表明肝纤维化、肝硬化患者的杨氏模量值会显著增加,弹性值是会大于NASH、NAFL的。且脂肪肝是一种可逆的非特异性反应的肝脏损伤[20],而第三种临床分型已经不可逆转,本研究旨在识别NASH、NAFL阶段,以达到早干预,早治疗,防止其继续发展成肝纤维化甚至肝硬化的结局。
本研究的不足之处在于,未对一些干扰因素(如年龄、性别等)进行控制;检查时,难以控制呼吸的患者,测量的数据会有一定的误差。另外,本研究样本量较少,还无法得出NAFLD中各临床分型的截断值,无法将其直接应用于平时的检查工作中。
综上,SWE 技术获得的Emean,在 NAFLD的定量诊断中具有较好的实用价值,可应用于临床对NAFLD 进行诊断,通过测量肝脏的Emean,计算肝肾Emean的比值,为NAFLD的临床分型提供可靠的量化指标,为NAFLD的治疗提供依据。

