外源镍与氮素互作对番茄幼苗生长及光合特性的影响
杨丹青 何晓丽 李佳 厉书豪 杜志杰 张昆 钟凤林
摘要: 本研究以Micro Tom番茄(Solanum lycopersicum L.)为试验材料,设3个外源镍(Ni2+)质量浓度:0 mg/L、0.1 mg/L和1.0 mg/L,2个施氮量:112.0 mg/L、22.4 mg/L,研究外源镍与氮素互作对番茄幼苗生长和光合特性的影响。结果表明,外源施加适量Ni2+(0.1 mg/L)可以增加低氮条件下番茄幼苗叶面积和叶绿素含量,提高番茄叶片的净光合速率和光合活性,促进番茄幼苗生长和干物质的积累从而缓解低氮对番茄幼苗造成的不利影响,使番茄幼苗维持在一个较好的生长状态。
关键词: 番茄;镍;氮素;生长;光合特性
中图分类号: S641.2 文献标识码: A 文章编号: 1000-4440(2021)04-0936-08
Effects of interaction between exogenous nickel and nitrogen on growth and photosynthetic characteristics of tomato seedlings
YANG Dan-qing, HE Xiao-li, LI Jia, LI Shu-hao, DU Zhi-jie, ZHANG Kun, ZHONG Feng-lin
(College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350000, China)
Abstract: In this study, Micro Tom tomato (Solanum lycopersicum L.) was used as the test material, and three exogenous nickel (Ni2+) concentrations (0 mg/L, 0.1 mg/L, 1.0 mg/L) and two nitrogen application rates (112.0 mg/L, 22.4 mg/L) were set to explore the effects of interaction between exogenous nickel and nitrogen on growth and photosynthetic characteristics of tomato seedlings. The results showed that external application of appropriate amount of Ni2+ (0.1mg/L) could increase the leaf area and chlorophyll content of tomato seedlings under low nitrogen conditions, increase the net photosynthetic rate and photosynthetic activity of tomato leaves, promote the growth of tomato seedlings and the accumulation of dry matter, alleviate the adverse effects of low nitrogen on the tomato seedlings, and maintain the tomato seedlings, in a better growth state.
Key words: tomato;nickel;nitrogen;growth;photosynthetic characteristics
番茄(Solanum lycopersicum L.)是中国主要的园艺作物之一,也是深受消費者喜爱的蔬菜[1]。充足的氮肥供应对提高番茄产量和品质有重要作用,但盲目增施氮肥反而会降低其产量和品质[2-3]。中国传统的农业生产模式中,农民为了蔬菜有较高的品质和产量往往会加大氮肥的施用量。过量施加氮肥不但增加了农业成本还会对环境造成污染,影响农业的可持续发展[4-5]。因此,在既能提高番茄的产量和品质,又能维持土壤肥力的基础上,研究如何减少氮肥施用量,提高作物的氮素利用率,对以节本增效、减少环境污染为主要目标的农业可持续发展和农业高产高效具有重要意义[6-7]。
镍(Ni)已经被确认是植物生长发育必需的营养元素[8-9]。有研究结果表明,施加适量的Ni2+能提高植物氮同化和氮代谢水平并对植物的生长发育有一定的促进作用[10-13]。Douglas等[14]的研究结果表明,合适浓度的Ni2+可对大豆的光合作用产生积极的影响并使大豆具有更高的产量。目前中国对Ni2+促进植物生长方面的研究较少。本研究通过对常规施氮和减施氮肥2种状态下生长的番茄幼苗施加不同浓度的Ni2+,观察Ni2+对常规施氮和减施氮肥这2种状态下番茄幼苗生长和光合作用的影响。
1 材料与方法
1.1 试验材料和试验设计
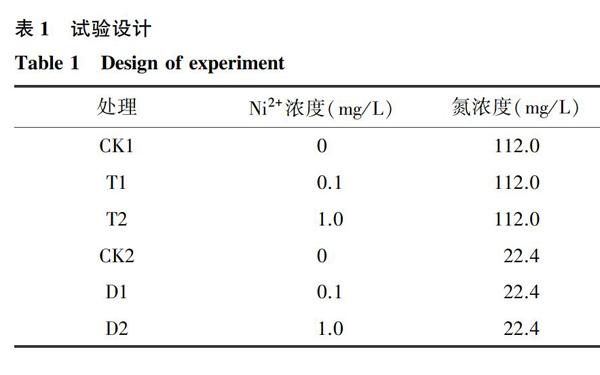
供试材料为Micro Tom番茄。试验在福建农林大学园艺科技楼蔬菜研究所植物培养室进行。采用穴盘育苗,待幼苗长至5叶1心时,定植于水培箱,缓苗3 d。设置不同的Ni2+(Ni2+由NiSO4提供,1 mg/L的NiSO4中S含量仅占营养液中S含量的0.7%,所以NiSO4中S含量的影响可忽略)质量浓度和氮素质量浓度共6个处理(表1)。其中,CK1 采用全氮营养液,营养液的配方为改良版山崎营养液配方。试验以缓苗完毕为第0 d,每3 d取样1次,共4次,进行相关指标的测定,每个指标的测定均3次重复。
1.2 测定项目及方法
1.2.1 生物量及形态指标的测定 用直尺测定番茄幼苗株高。取幼苗地上部和地下部,用蒸馏水冲洗干净,擦干水分后分别称鲜质量,105 ℃杀青15 min,80 ℃烘至恒质量并称干质量。
取不同处理下的番茄幼苗,用蒸馏水洗净叶片和根系,采用Epson Perfection 4990 PHOTO扫描仪对不同处理下番茄植株的叶片和根系进行扫描,应用Win-RHIZO 分析系统对根系的总长度、总表面积、总体积、分根数和叶面积等形态参数进行分析。
1.2.2 光合指标的测定 采用王学奎[15]的方法测定叶片中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量。
选取番茄生长点以下第 3 片完全展开的功能叶,用CIRAS-3型便携式光合仪(汉莎科学仪器有限公司产品) 在晴天上午10∶00-11∶00测定其净光合速率(Pn) 、 气孔导度 (Gs) 、胞间CO2浓度 (Ci) 和蒸腾速率 ( Tr) 。
在暗适应30 min后,采用SYE-YHO2叶绿素荧光成像仪,测定最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)。
1.3 数据处理
采用Excel软件整理数据,用GraphPad Prism 8.0作图,采用Data Processing System进行数据方差分析(α=0.05)。
2 结果与分析
2.1 外源镍与氮素互作对番茄生物量及形态指标的影响
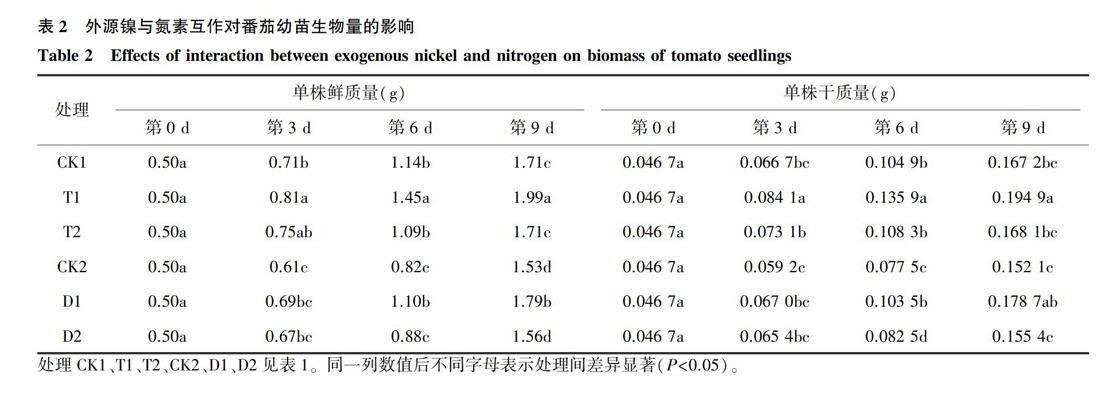
由表2可知,番茄幼苗的鲜质量和干质量随着处理天数的增加而增加。其中,在常规施氮增施镍处理(CK1、T1、T2)中,T1处理植株的鲜质量和干质量显著高于CK1,T2处理植株的鲜质量和干质量与CK1差异不显著。在减氮处理(CK2、D1、D2)中,D1处理的植株在处理天数为第6 d、第9 d与CK2相比鲜质量分别增加了34.1%和 16.9%,并存在显著差异。D1处理的植株干质量在处理天数为第6 d、第9 d时与CK2差异显著。D2处理植株在处理时间为第 6 d时,其干质量与CK2差异显著。
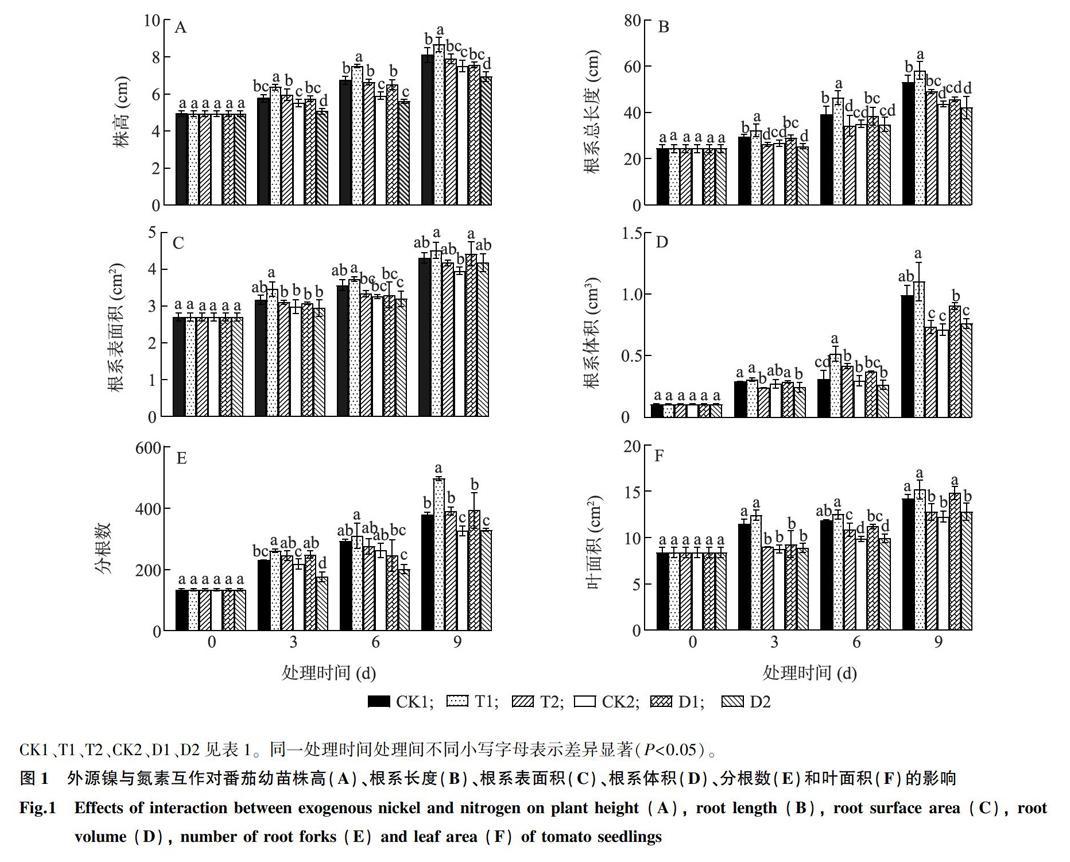
番茄幼苗的形态学指标随着生长进程的推进而增加(图1)。与CK1相比,T1处理显著增加了番茄幼苗的株高(图1A)。在减氮处理中,在处理天数为第 6 d时D1处理幼苗的株高较CK2增加幅度最大,具有显著差异。
如图1B所示,T1处理的根系总长度最长,显著高于CK1处理,T2处理的根系总长度显著低于CK1。在减氮处理下施Ni2+,D1处理的根系总长度与CK2差异不显著。
如图1C、图1D所示, T1处理的根系表面积和根系体积均高于CK1,除了处理天数为第 6 d时根系体积T1显著高于CK1,T1处理的其他处理时间的根系表面积和根系体积与CK1差异不显著。减氮施镍的番茄幼苗,在处理天数为第9 d时,D1处理无论是根系表面积还是根系体积均显著高于CK2。如图1E所示,常规施氮增施镍处理的番茄幼苗,T1处理番茄幼苗的分根数分别在第3 d、第9 d高于CK1。减氮施镍处理的番茄幼苗,在处理时间为第3 d、第9 d时,D1处理番茄幼苗的分根数显著高于CK2。
如图1F所示,T1处理的番茄叶表面积最大,但是与CK1处理没有显著差异。减氮施镍处理的番茄幼苗在处理天数为第6 d、第9 d时D1处理的叶面积均显著高于CK2。
2.2 外源镍与氮素互作对番茄叶片叶绿素含量的影响
如图2A所示,常规施氮增施镍处理的番茄幼苗,T1与T2处理的番茄叶绿素a与CK1差异不显著。减氮处理的番茄幼苗中,施加镍可以促进叶绿素a的合成,D1处理的番茄叶片叶绿素a在处理第9 d时,显著高于CK2。
如图2B所示,常规施氮增施镍处理的番茄幼苗,T1处理的番茄叶片叶绿素b含量显著高于CK1。减氮施镍处理的番茄幼苗中,D2处理的番茄幼苗叶片叶绿素b含量低于CK2,并且差异显著。
如图2C所示,常规施氮增施镍处理的番茄幼苗,T1处理的叶片类胡萝卜素含量显著高于CK1,T2处理的叶片类胡萝卜素含量也略高于CK1,但两者的差异不显著。减氮施镍处理的番茄幼苗,D1处理在处理天数为第3 d、第6 d 時叶片类胡萝卜素含量显著高于CK2,第9 d时,D1处理叶片类胡萝卜素含量与CK2差异不显著。
如图2D所示,常规施氮增施镍处理的番茄幼苗,T1处理的番茄叶片总叶绿素含量均高于CK1,差异显著。减氮施镍处理的番茄幼苗,D1处理与CK2相比叶片总叶绿素含量增加,D2处理叶片总叶绿素含量显著低于CK2。
由图2可知,0.1 mg/L的Ni2+可以促进叶片中叶绿素a、叶绿素b和类胡萝卜素含量的增加。减氮会使番茄幼苗叶片中叶绿素的合成受到抑制,番茄幼苗叶片的叶绿素a、叶绿素b和类胡萝卜素含量会有不同程度的下降,但施用0.1 mg/L Ni2+,可以促进减氮处理下番茄幼苗叶片中叶绿素a和类胡萝卜素的合成。
2.3 外源镍与氮素互作对番茄叶绿素荧光参数的影响
如图3A所示,常规施氮增施镍的处理中,T1处理在处理天数为第3 d、第6 d时,与CK1相比实际光化学效率显著增加;在处理天数为第9 d 时,T1处理的实际光化学效率与CK1差异不显著。D1、D2处理的番茄幼苗实际光化学效率在处理天数为第 6 d时高于CK2,并且差异显著。如图3B所示,T1、D1的最大光化学效率在处理天数为第3 d时均显著高于CK1和CK2。
如图3C所示,非光化学淬灭系数随番茄幼苗生长进程的推进整体呈下降趋势。其中,T1处理的下降趋势最明显,在处理天数为第 9 d时与CK1相比有显著差异。在减氮施镍处理的番茄幼苗中,D1处理与CK2之间没有显著差异,而D2处理在处理时间为第 6 d时与CK2相比有显著差异。由图3D可知,T1处理的光化学淬灭系数显著高于CK1,这表明在常规施氮下增施0.1 mg/L的Ni2+可以提高番茄幼苗的光合活性。同样的,在处理天数为第3 d、第9 d时,D1处理的番茄幼苗光化学淬灭系数也显著高于CK2。在处理天数为第6 d时,D1处理的光化学淬灭系数与CK2没有显著差异,这可能与番茄幼苗个体之间的差异有关。
2.4 外源镍与氮素互作对番茄幼苗叶片光合气体交换参数的影响
如图4A、图4B、图4C所示,常规施氮增施镍处理的番茄幼苗,T1处理显著提高了番茄幼苗叶片的净光合速率(Pn)、胞间二氧化碳浓度(Ci)和气孔导度(Gs)。在处理天数为第9 d时,三者相较于CK1显著提高44.1%、21.1%和34.6%。减氮施镍处理的番茄幼苗,D1处理与CK2相比,D1处理的番茄幼苗叶片的Pn显著提高。CK2、D1、D2 3个处理番茄幼苗叶片的胞间二氧化碳浓度在处理天数为第3 d时D1处理番茄幼苗叶片的胞间二氧化碳浓度与CK2差异不显著,到处理天数为第6 d、第9 d时,D1处理番茄幼苗叶片的胞间二氧化碳浓度较CK2显著增加。D2处理番茄幼苗叶片的胞间二氧化碳浓度在处理天数为第9 d时较CK2 也有显著提高。D1处理番茄幼苗叶片的叶片气孔导度在处理天数为第6 d、第9 d时较CK2、D2有显著差异。
如图4D所示,常规施氮增施镍处理的番茄幼苗叶片在处理天数为第3 d、第6 d时T1处理的蒸腾速率与CK1差异不显著,处理天数为第9 d时,T1处理的蒸腾速率显著高于CK1。减氮施镍处理的番茄幼苗在处理天数为第3 d时,D1处理番茄幼苗叶片的蒸腾速率显著高于D2,在处理天数为第6 d、第9 d时,三者之间的差异不显著。
由图4可知,施加0.1 mg/L的镍可以显著增加番茄叶片净光合效率、胞间二氧化碳浓度和气孔导度。同时,随着处理天数的增加,施加微量的镍也可以促进番茄幼苗叶片的蒸腾速率。在减氮的条件下,番茄幼苗叶片的净光合速率会受到一定程度的抑制,但是施0.1 mg/L的镍可以改善这一情况并且显著增加番茄幼苗叶片的净光合速率。而在胞间二氧化碳浓度、蒸腾速率方面,施加微量的镍可以缓解减氮给番茄幼苗光合作用带来的影响。
3 讨论
镍(Ni)作为脲酶[16]和氢化酶[17]这2种直接参与氮代谢金属酶的金属辅基,是植物代谢所必需的微量元素。而氮素是植物生理代谢中的重要组成部分,对植物的生长发育有重大影响[18]。因此,探究Ni2+与氮在植物生长中的协调作用,对提高植物氮素利用的研究和解决氮肥施用过量的问题具有重要意义。本研究结果表明,常规施氮增施镍处理的番茄幼苗在施加了2个不同浓度的Ni2+后,番茄幼苗的鲜质量和干物质积累有一定的增加。并且T1(0.1 mg/L Ni2+,112.0 mg/L N)处理的番茄幼苗的形态学指标与CK1相比有明显提升。说明施加微量的 Ni2+可以一定程度地促进番茄幼苗的生长,这与Hosseini等[19]和Tabatabaei[20]在莴笋和黄瓜上的研究结果一致。在施加0.1 mg/L Ni2+时,番茄幼苗的形态学指标达到最大值,可能是因为Ni2+对番茄幼苗形态学指标的促进已经趋于饱和,再继续添加Ni2+反而会对番茄幼苗部分形态学指标有抑制作用。这也是本试验中T2(1.0 mg/L Ni2+,112.0 mg/L N)处理番茄幼苗的形态学指标低于T1处理的原因。本研究观察到,减氮条件下施加微量的Ni2+可以促进番茄幼苗生物量和相关形态学指标的增长,尤其是叶面积,而叶片是作物吸收、利用光能的主要场所,叶面积增加等于光能有效接受面积增加,所以D1处理与CK2相比可以更好地进行光合作用并且有更高的光合性能[21]。由于Ni2+直接参与氮代谢,所以施加适量的Ni2+很有可能通过促进氮素在番茄幼苗中的利用,使番茄幼苗在减氮的条件下仍可以维持较好的生长状态。在减氮条件下,CK2、D1、D2处理间在大多数指标中刚开始的变化并不明显,随着处理天数的增加,D1处理与其他处理相比才有了比较明显的变化,这可能是因为减氮给番茄幼苗造成养分不足导致番茄幼苗需要更长的时间来适应施加Ni2+对它造成的影响。
叶绿素含量与植物光合能力密切相关[22],前人的研究结果表明氮素营养对叶片光合作用的调控表现在诸多方面,包括叶面积大小、光合色素含量、光合强度等[23-24]。本研究结果表明,常规施氮增施镍处理的番茄幼苗在施加了2个不同浓度的Ni2+后叶片的叶绿素含量有一定的增加。这表明施加适量浓度Ni2+可以促进番茄叶片中叶绿素的合成,这与Gheibi等[25]和Douglas等[14]的研究结果一致。减氮条件下CK2番茄幼苗植株的叶绿素a、叶绿素b及类胡萝卜素含量相对于CK1来说有一定程度减少,而施加适量的Ni2+可以促进减氮处理中番茄叶片叶绿素a和类胡萝卜素的合成。由于氮素也是氨基酸和核酸的必要组成成分之一,植物叶片的氮素绝大部分都存在于叶绿体中,而叶绿体又是光合作用的主要场所,因此氮素含量的变化在一定程度上影响着植物的光合作用[26]。因此,当对番茄幼苗进行减氮处理时,其净光合速率显著降低,但是施加适量的Ni2+大幅提升了番茄幼苗叶片的Pn,并且将Pn维持在一个比较高的水平上。另外,在减氮条件下施加适宜浓度的Ni2+的处理初期,CK1、D1处理、D2处理间的气孔导度和胞间二氧化碳浓度没有明显变化。但是在处理的中后期,D1处理的气孔导度和胞间二氧化碳浓度较CK2和D2处理有显著的升高。综上,减氮条件下,施加适量的Ni2+可以提高番茄幼苗叶片的气孔导度,增加番茄幼苗叶片胞间二氧化碳浓度,进而在底物水平提高净光合速率。
叶绿素荧光可以快速反映各种环境因子对光合作用各个过程产生的影响[27-29],因此,被视为研究植物光合作用与环境条件关系的内在探针[30]。实际光化学效率表示了光化学反应的实际转化效率,它反映PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率[31]。减氮处理下番茄幼苗的ΦPS II明显降低,施加Ni2+处理与对照间ΦPS II没有显著差异。最大光化学效率是指開放的 PS II 反应中心捕获激发能的效率,该参数可以反映植物叶片 PS II 受伤害的程度。由于植物叶片的Fv/Fm 比较恒定,并且不受物种和生长条件的影响[32],减氮处理初期,施加适量Ni2+可以提高番茄幼苗叶片的Fv/Fm,提高其适应环境的能力,随着番茄幼苗适应了环境变化,Fv/Fm渐渐变得恒定。光化学淬灭系数即由光合作用引起的荧光淬灭,反映了光合活性的高低。减氮处理后,番茄幼苗的qP显著降低,但施加了Ni2+后,减氮处理的番茄幼苗的光合活性显著提高。非光化学淬灭系数对叶绿体能量状态的改变非常敏感。因此,NPQ可以作为检测植物是否被胁迫的参数之一[33]。本研究中NPQ与qP的变化趋势相反。减氮并施加过量Ni2+时,NPQ在6 d时变幅较大,可见植物耗散光能为热能的比例增加,而用于光化学反应转化的比例减少,PS II反应中心受到一定程度的破坏。综上,对番茄幼苗进行减氮处理,施加适量的Ni2+可以促进番茄幼苗的光合作用,提高其自我保护的能力。
低氮條件下施加0.1 mg/L的Ni2+可以促进番茄幼苗的生长和叶片的增大,促进番茄幼苗的光合作用,并且可以让番茄维持较好的生长状态。通过低氮条件下施镍的研究,可以为解决生产上氮肥使用过量的问题提供参考,实现节约成本和农业生产的可持续发展。
参考文献:
[1] 潘铜华. CO2富集与光强互作对番茄光合碳同化的影响及代谢组研究[D]. 杨凌:西北农林科技大学,2019.
[2] 李 娟,李建设,高艳明. 不同生育期营养液钾氮比对日光温室基质培番茄的影响[J]. 北方园艺,2016,40(17):51-56.
[3] 梁红胜,张子义,王学霞,等. 控释氮肥与水溶肥配施对设施番茄生理特征的影响[J]. 中国土壤与肥料,2020,57(5):70-76.
[4] 马正波,董学瑞,房孟颖,等. 矮壮素配合氮肥全基施对华北夏玉米氮素利用的调控效应[J]. 应用生态学报,2021,32(1): 1-14.
[5] 蒋伟勤,马中涛,胡 群,等. 缓控释氮肥对水稻生长发育及氮素利用的影响[J]. 江苏农业学报,2020,36(3):777-784.
[6] LIU Q, CHEN XB, WU K, et al. Nitrogen signaling and use efficiency in plants: what's new?[J]. Current Opinion in Plant Biology, 2015,27(10): 192-198.
[7] 袁 丹. 不同施氮水平对不同甘蔗品种叶绿体结构和GS表达的影响[D].南宁: 广西大学,2017.
[8] MARSCHNER H. Mineral nutrition of higher plants[M]. 北京:科学出版社,2013.
[9] ESKEW D L, WELCH R M, CARY E E. Nickel: an essential micronutrient for legumes and possibly all higher plants[J]. Science,1983,222(4642):621-623.
[10]KHOSHGOFTARMANESH A H, HOSSEINI F, AFYUNI M. Nickel supplementation effect on the growth, urease activity and urea and nitrate concentrations in lettuce supplied with different nitrogen sources[J]. Scientia Horticulturae, 2011, 130(2): 381-385.
[11]XUE W T, IKEDA H, ODA M. Effects of nickel concentration in the nutrient solution on the nitrogen assimilation and growth of tomato seedlings in hydroponic culture supplied with urea or nitrate as the sole nitrogen source[J]. Scientia Horticulturae, 2000, 84(3/4): 265-273.
[12]DALIR N, KHOSHGOFTARMANESH A H. Root uptake and translocation of nickel in wheat as affected by histidine[J]. Journal of Plant Physiology, 2015, 184: 8-14.
[13]PARLAK U, KADIRIYE. Effect of nickel on growth and biochemical characteristics of wheat (Triticum aestivum L.) seedlings[J]. Njas-Wageningen Journal of Life Sciences, 2016, 76: 1-5.
[14]DOUGLAS S F, BRUNA W R, ANDR R D R, et al. Hidden nickel deficiency? Nickel fertilization via soil improves nitrogen metabolism and grain yield in soybean genotypes[J]. Frontiers in Plant Science, 2018, 9: 614.
[15]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006.
[16]DIXON N E, GAZZOLA C, BLAKELEY R L, et al. Jack bean urease (EC 3.5.1.5). a metalloenzyme. a simple biological role for nickel[J]. Journal of the American Chemical Society, 1975, 97(14): 4131-4133.
[17]EVANS H J, HARKER A R, PAPEN H, et al. Physiology, biochemistry, and genetics of the uptake hydrogenase in rhizobia[J]. Annual Review of Microbiology, 1987, 41(1): 335.
[18]刘明月,严逸男,尚春雨,等. 镍离子对尖叶莴苣氮素吸收和生长生理的影响[J]. 西北植物学报,2018,38(11): 2060-2071.
[19]HOSSEINI H, KHOSHGOFTARMANESH A H. The effect of foliar application of nickel in the mineral form and urea-Ni complex on fresh weight and nitrogen metabolism of lettuce[J]. Scientia Horticulturae, 2013, 164: 178-182.
[20]TABATABAEI S J. Supplements of nickel affect yield, quality, and nitrogen metabolism when urea or nitrate is the sole nitrogen source for cucumber[J]. Journal of Plant Nutrition, 2009, 32(5): 713-724.
[21]李 静,王洪章,刘 鹏,等. 夏玉米不同栽培模式花后叶片光合性能的差异[J]. 作物学报,2021,71(1): 1-11.
[22]郭 雯,徐瑞晶,漆良华,等. 竹类植物光合特性与叶片功能性状研究[J]. 世界林业研究,2018,31(4): 29-35.
[23]MONNEVEUX P, ZAIDI P H, SANCHEZ C. Population density and low nitrogen affects yield-associated traits in tropical maize[J]. Crop Science, 2005, 45(2): 535-545.
[24]王红娟,於 春,路献勇,等. 不同氮浓度对薏苡幼苗生长和光合特性的影响[J]. 南方农业学报, 2020, 51(8): 1925-1931.
[25]GHEIBI M N, MALAKOUTI M J, KHOLDEBARIN B, et al. Significance of nickel supply for growth and chlorophyll content of wheat supplied with urea or ammonium nitrate[J]. Journal of Plant Nutrition, 2009, 32(9): 1440-1450.
[26]馬宗桓,毛 娟,魏居灿,等. 施氮时期对葡萄叶片光合生理及内源激素水平的影响[J]. 干旱地区农业研究,2020, 38(5): 86-93.
[27]金星宇,马 佳,冯 美.盐胁迫对酸柚苗光合作用和荧光特性的影响[J].江苏农业科学,2020,48(8):159-163.
[28]李 君,娄运生,马 莉,等. 夜间增温和水分管理耦合对水稻叶片光合作用和荧光特性的影响[J].江苏农业学报, 2019,35(3):506-513.
[29]曾继娟,种培芳,朱 强. 外源脱落酸对荒漠植物红砂幼苗光合及叶绿素荧光特性的影响[J].江苏农业科学,2020,48(7):136-141.
[30]白文玉. 不同种源四川桤木嫁接幼苗光合及叶绿素荧光特征研究[D]. 雅安:四川农业大学, 2019.
[31]张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,17(4): 444-448.
[32]白文玉,铁烈华,冯茂松,等. 不同种源桤木嫁接幼苗光合和叶绿素荧光特征[J]. 四川农业大学学报, 2020, 38(6): 670-676.
[33]钱永强,周晓星,韩 蕾,等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报,2011,31(20): 6134-6142.
(责任编辑:陈海霞)
收稿日期:2021-01-10
基金项目:福建省蔬菜产业技术体系岗位专家项目(KKE19004A);南方特色设施番茄良种高产技术产业化示范项目(102-K6017201A)
作者简介:杨丹青(1996-),女,山东淄博人,硕士研究生,主要从事蔬菜生理生化研究。(E-mail)ydqonh@163.com
通讯作者:钟凤林,(E-mail)zhong591@fafu.edu.cn

