过表达FtbZIP5提高苦荞毛状根黄酮积累及其耐盐性
翁文凤 伍小方 张凯旋 唐宇 江燕 阮景军 周美亮
过表达提高苦荞毛状根黄酮积累及其耐盐性
翁文凤1,2伍小方2张凯旋2唐宇3江燕1阮景军1周美亮2
(1贵州大学农学院,550025,贵州贵阳;2中国农业科学院作物科学研究所,100081,北京;3四川旅游学院食品学院,610100,四川成都)
转录因子不仅在植物盐胁迫网络中起着重要的作用,还可调节植物类黄酮的积累。在苦荞品种川荞1号中克隆了1个具有转录激活活性的家族基因。基因能被NaCl和脱落酸(ABA)诱导表达,在茎和叶中的表达高于根中。对过表达基因毛状根的总黄酮含量进行检测,结果显示,总黄酮含量在过表达株系中显著高于野生株系。同时检测其类黄酮合成途径中关键酶基因的表达量,其中黄烷酮-3-羟化酶基因()的表达量较高。可推测该过表达毛状根株系中总黄酮的积累与的表达有关。在NaCl(100mmol/L)胁迫下,各株系的总黄酮积累受到抑制,过表达株系的含量减少至0.63mg/g。并且,在这种压力下,的表达水平仍然高于对照。植株在受到胁迫后,对照株系的过氧化氢酶(CAT)活性显著低于过表达株系。随着野生型植株受到胁迫的增强丙二醛(MDA)含量增加,但过表达株系的含量趋于稳定。以上结果表明,在过表达毛状根中,总黄酮的积累可能是通过关键酶基因的上调表达来调节的。并且可提高苦荞毛状根耐盐性。通过解析对苦荞毛状根中总黄酮积累及植株耐盐性的影响,为荞麦耐盐性和解析其耐盐机制研究奠定基础。
苦荞;;类黄酮;盐胁迫
苦荞()(2n=16)属蓼科,为一种药食同源作物。苦荞在我国西南等地有较多种植,是经济收入之一[1]。因其较高的药用价值和营养价值被国内外很多学者关注。苦荞富含各种营养物质(如抗性淀粉和蛋白质等),生物活性物质也是苦荞广受关注的原因之一,比如,类黄酮和酚类具有很好的药用疗效[2],有降低高血压和治疗动脉硬化的功效[3]。苦荞生长的环境比较恶劣,常常会受到干旱、冷害和盐害等多种逆境胁迫。而苦荞对盐非常敏感,盐胁迫会抑制苦荞生长发育、减少产量、降低籽粒品质,严重时甚至会导致死亡。有研究[4-5]表明,在适当盐浓度的胁迫下,植物体内通过增加次生代谢物(酚类化合物和萜类化合物)来抵抗逆境。而对于荞麦这种特殊的作物来说,植株体内黄酮类次生代谢物芦丁的大量积累又能增加其药用价值。因此,研究苦荞中黄酮积累和耐盐性之间的关系尤为重要。
是最大的转录因子调控家族之一,由富含碱性氨基酸残基的DNA结合域和亮氨酸拉链二聚结构域相邻的蛋白质组成[6],在植物光信号、种子成熟、花发育、种子积累蛋白、非生物和生物胁迫等生物学过程中发挥重要的作用[7]。转录因子广泛存在于很多物种中,例如:苦荞基因组中有96个基因[7],拟南芥中有75个基因被发现[8],水稻中有89个[9],小麦中约有187个[10]。在植物对逆境调控的机制研究中,的功能已经在国内外都有了一定的报道,如盐胁迫下,植物体内的耐盐基因可以通过转录因子的调节来表达,从而提高植株的耐盐性[7]。
Liu等[11]研究表明,盐胁迫相关基因可被转录因子激活表达,提高植株的抗逆性,如在拟南芥中,激活了盐胁迫响应因子,从而提高了耐盐性。Zhang等[12]研究表明,转录因子可通过脱落酸(ABA)介导的信号途径参与盐胁迫响应,如在水稻遭受盐胁迫后,水稻转录因子通过提高体内ABA含量来增强其耐盐性。植物的耐盐性还可以通过体内渗透调节物质的积累来提高,有研究[13]表明,具有基因的烟草可以在盐胁迫后增加超氧化物歧化酶(SOD)的活性并降低过氧化氢的含量,使得耐盐性提高。有趣的是,有学者[14]发现和转录因子通过与黄酮合成途径的相关酶基因和启动子序列中的光调节单元(LR-Us)协同结合参与黄酮类物质的合成。因此,克隆苦荞转录因子,研究其在盐胁迫下在苦荞毛状根中发挥的作用,为深入了解荞麦的抗逆机理和培育抗逆荞麦品种奠定扎实的基础。
已有研究[15]表明,苦荞中在抗盐抗旱中发挥重要作用,并且也有报道[16]指出转录因子家族中的某些成员具有调节黄酮合成的作用。因此,从川荞1号中克隆得到基因,分析检测其转录活性及FtbZIP5蛋白的理化性质和结构。通过qRT-PCR分析不同浓度NaCl(0、50、100、150mmol/L)诱导下基因的时空表达模式,通过将其整合到过表达载体pCAMBIA1307中,诱导过表达毛状根,检测总黄酮含量,研究基因对苦荞类黄酮合成代谢通路的影响。通过检测在100mmol/L NaCl处理0、1、3、5d的毛状根过氧化氢酶(CAT)活性和丙二醛(MDA)含量,评估其抗盐能力,从而解析基因对苦荞黄酮合成和盐胁迫的协同调节作用。
1 材料与方法
1.1 试验材料与胁迫处理
以川荞1号种子(由中国农业科学院作物科学研究所荞麦基因资源创新组提供)为材料。首先,用镊子剥去浸泡后变软的种皮,加入15~20mL 1% NaClO震荡6min,15~20mL 75%乙醇摇晃3min,用无菌水洗涤5~6次,将其放入MS培养基中,置于组织培养室(光照2000lx,16h/8h)中生长10d。选择生长状态一致的幼苗,移入MS液体培养基中,用摇床120转/min摇24h。分别加入不同浓度(0、50、100、150mmol/L)NaCl和ABA(100µmol/L),在0、1、6和12h将幼苗的根、茎、叶单独取样,然后立即储存在-80℃冰箱用于提取RNA。
1.2 FtbZIP5基因的克隆及qRT-PCR分析
利用诺唯赞相关试剂盒按照说明书立即将提取的RNA反转录为cDNA。利用基因特异性引物,以该cDNA为模板,克隆得到基因,其基因引物见表1。用同源重组的方法构建一个含强启动子35S的过表达载体;以HI和RI为限制性酶切位点,将的编码区()连接到植物过表达载体pCAMBIA1307中。
基因的荧光定量PCR引物在NCBI中设计,以作为内部参考基因,参照卢晓玲等[17]的引物序列。使用TaKaRa, SYBR Premix EXTaqTM(Perfect Real time)(R820A)试剂盒进行qRT-PCR分析。公式为(RQ)=2-ΔΔCT,计算相关基因的相对表达量。
1.3 FtbZIP5的转录激活
使用同源重组法将的插入AS2-1载体的I和I多克隆位点中,并与pACT2空载体共转化PJ69-4A感受态细胞。将其涂板于SD/-Leu-Trp(SD-LT),28℃倒置培养2d,挑单克隆于1×TE buffer液体培养基中,震荡培养12~16h,点于含浓度5和15mmol/L 3-AT的SD/-Leu-Trp-His(SD-LTH)缺陷培养基上,拍照观察。其阴性对照为pAS2-1与pACT2空载体共转化PJ69-4A感受态细胞。其引物见表1。
1.4 FtbZIP5基因的生物信息学分析
利用在线平台(表2)对FtbZIP5蛋白的理化性质及结构进行预测。利用NCBI数据库挑选10个已报道基因功能的同家族基因,使用MegaX软件(邻域连接法)建立关于FtbZIP5蛋白的进化树。
1.5 过表达FtbZIP5毛状根的诱导及总黄酮测定
将含目的片段的过表达载体pCAMBIA1307-通过A4发根农杆菌介导,侵染川荞1号幼苗的茎和叶,诱导毛状根,取主根系进行PCR鉴定,参考谈天斌等[18]的方法。选取阳性根系,培养在MS+100mg/mL头孢霉素的培养基上。然后选择健壮的主根系转移到MS液体(含头孢霉素)培养基中,在黑暗条件下,摇床120转/min培养1个月,并更换1次培养基以保证有充足的营养供毛状根吸收。在波长420nm处,利用AlCl3分光光度法[19]测定过表达毛状根的总黄酮含量,以A4和空载体(1307空)毛状根为对照。制作标准曲线为=19.946+0.5193(2=0.9954),其中,为吸光值,为芦丁浓度。为了研究对黄酮类化合物的调节作用,检测其黄酮合成途径中的关键酶基因是重要的,因此,挑选了基因进行qRT-PCR检测。
1.6 过表达FtbZIP5毛状根耐盐性鉴定
将上述诱导的毛状根转移到MS液体培养基中培养30d,再次转移至MS液体培养基(含100mmol/L NaCl)中,在相同条件下培养。并在培养第0、1、3、5天时取样,并立即储存于-80℃冰箱备用。主要通过过表达毛状根的黄酮合成途径关键酶基因的表达量和检测活性氧代谢相关酶(CAT)活性及物质(MDA)评价毛状根的耐盐性。利用酶活检测试剂盒(索莱宝生化公司)检测相关酶活性。

表1 引物序列汇总

表2 在线平台汇总
1.7 数据分析
使用Microsoft Excel 2010进行数据整理,使用IBM SPSS Statistics 25.0进行显著性分析。
2 结果与分析
2.1 苦荞FtbZIP5基因的鉴定
苦荞基因全长1260bp,共含419个氨基酸。用ExPASy ProtParam进行序列分析,FtbZIP5编码蛋白的等电点5.06,分子量101153.96,分子式C3742H6226N1260O1555S231;共包含4种氨基酸,其含量从高到低依次为Ala(32.0%)、Gly(26.3%)、Thr(23.3%)和Cys(18.3%)。该基因的不稳定指数预测为43.63,为亲水蛋白,相对不稳定。利用Cell-ploc 2.0预测出位于细胞核中。图1a为蛋白二级结构的预测结果,无规则卷曲占比最高,为57.28%;其次为α螺旋,占30.31%;β折叠延伸链和β转角结构分别占10.74%和1.67%。其中,在中间分布的有无规则卷曲和折叠延伸链,两端主要分布α螺旋,β转角结构主要分布在碳端。对其FtbZIP5蛋白的三级结构进行预测,该蛋白具有亮氨酸拉链典型结构(图1b)。将与其他已报道的11个转录因子构建系统发育树(图1c)。结果表明,与小麦耐盐转录因子、和距离较近。从川荞1号中克隆得到(图1d)。
2.2 转录激活活性
如图2所示,pAS2-1-FtbZIP5+pACT2和对照pAS2-1+pACT2的原液和稀释液都能在SD-LT缺陷培养基上生长;只有pAS2-1-FtbZIP5+pACT2能在含5或15mmol/L 3-AT的SD-LTH缺陷培养基上正常生长,对照pAS2-1+pACT2没有生长迹象。表明FtbZIP5在酵母中具有转录激活活性。
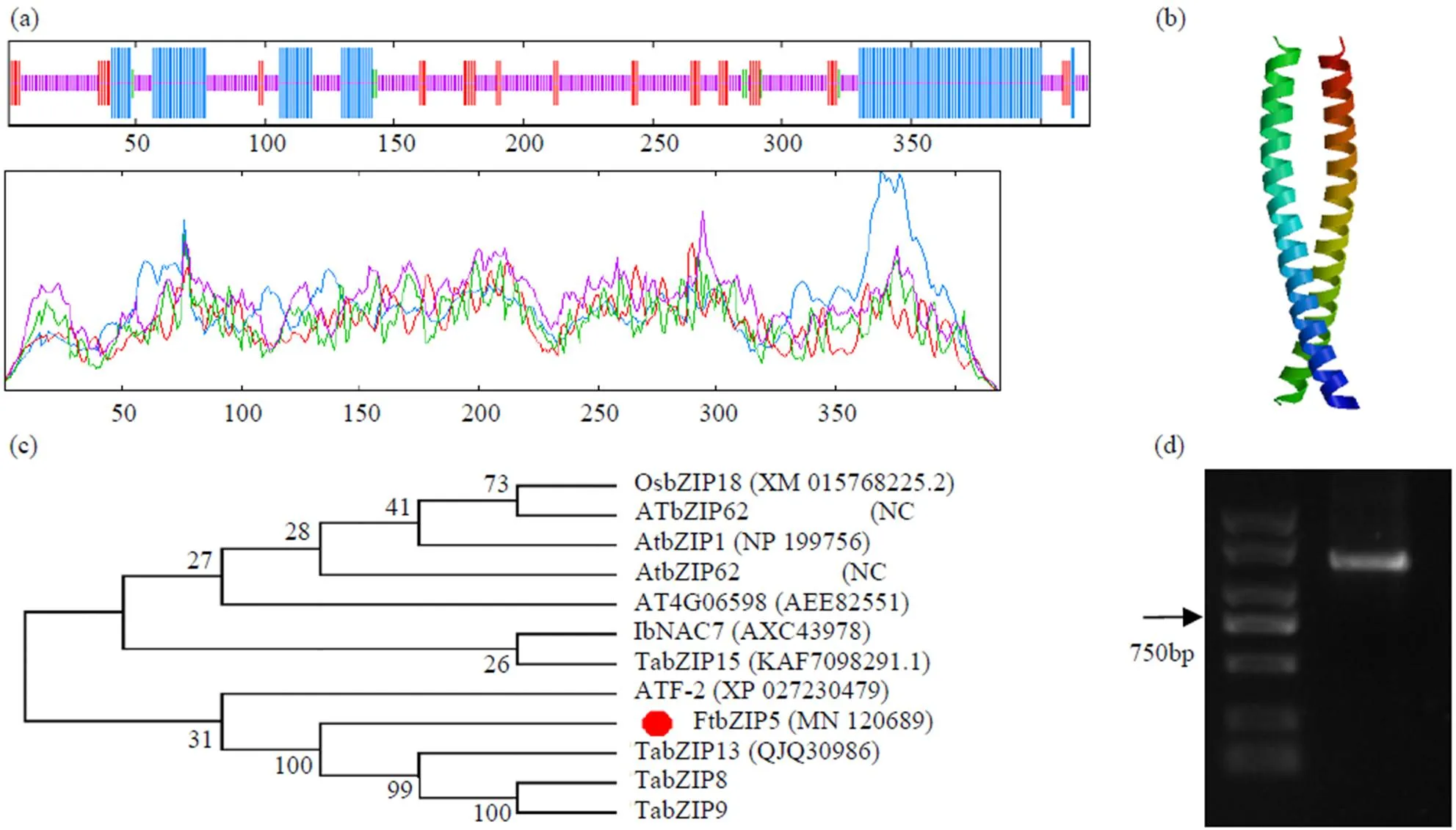
a:FtbZIP5蛋白二级结构预测;α螺旋(蓝色);折叠延伸链(红色);β转角结构(绿色);无规则卷曲(紫色)。b:FtbZIP5蛋白三级结构预测。c:FtbZIP5蛋白系统进化树分析。d:FtbZIP5基因编码区序列扩增

1×:原液;10×:稀释10倍
2.3 FtbZIP5基因在NaCl和ABA诱导下的表达模式
2.3.1 盐胁迫下的组织特异性分析 为了进一步确定是否参与了盐胁迫信号通路,在各组织中,利用qRT-PCR分析了基因受NaCl诱导下的表达情况,并以为内参。结果(图3a)表明,基因对盐胁迫很敏感,在不同浓度NaCl处理1h后,基因在根、茎、叶中的表达水平显著升高。且随着浓度的升高,根中基因的相对表达量也升高,在NaCl 150mmol/L时最高,是CK(NaCl 0mmol/L)的8倍。在茎中,在NaCl 100mmol/L时,表达量升至最高,比CK高出16倍,随后降低。基因在茎中的表达趋势与叶相同。如图3b所示,在用NaCl处理6h以后,在根中的表达受到抑制。在茎和叶中,随着浓度的增加表达量有升高的趋势,在NaCl 150mmol/L时,叶中的表达量高达16.50,约是茎(8.13)中的2倍。这表明植物不同组织受到盐胁迫影响是有先后顺序的,依次是根、茎、叶。
2.3.2 ABA诱导下的组织特异性分析 如图3c所示,ABA(100µmol/L)处理后,在不同组织中的表达量都在1h内迅速增加;且在茎和叶中的表达水平比CK(处理0h)高出40倍以上。在各处理时间段,在根中稳定表达;在茎中随着处理时间的延长,表达量降低;在叶中也是如此。因此,可能参与了苦荞对ABA诱导的外源胁迫反应和盐胁迫反应。
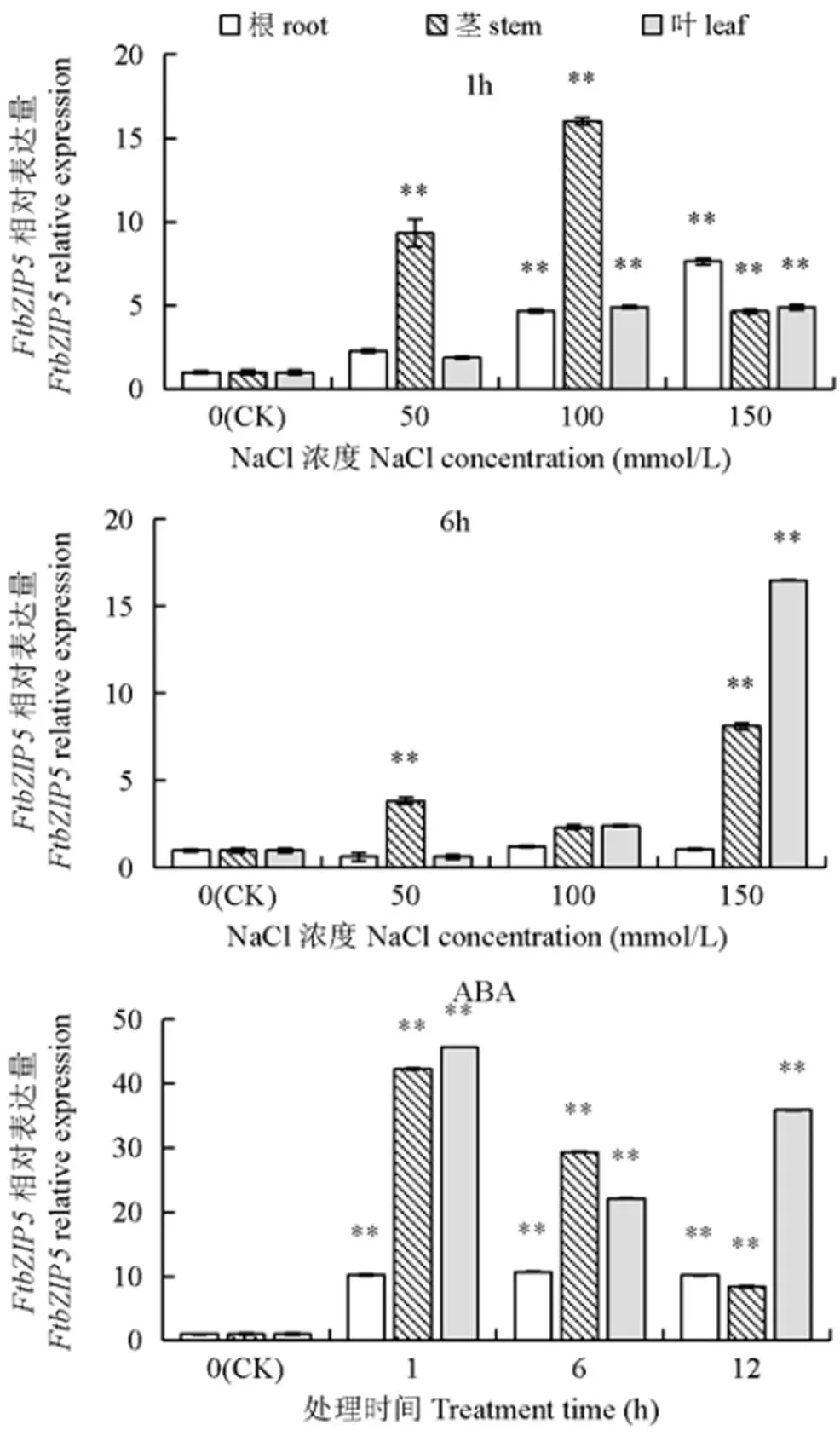
显著差异性用“**”代表,表示P < 0.01,下同
综上所述,基因在茎和叶中都有高表达水平,且受NaCl和ABA诱导时间和浓度的影响。
2.4 过表达FtbZIP5基因对毛状根总黄酮积累的影响
通过对组成型过表达毛状根总黄酮的检测,结果(图4)显示调控毛状根中的黄酮类物质积累。通过成功诱导出基因的过表达植株(图4a),检测了3个过表达毛状根株系和对照(A4和1307空载体毛状根)的基因表达量,结果(图4b)显示,3个株系中的的表达量都比CK高出几十至百倍,说明过表达株系构建是成功的。
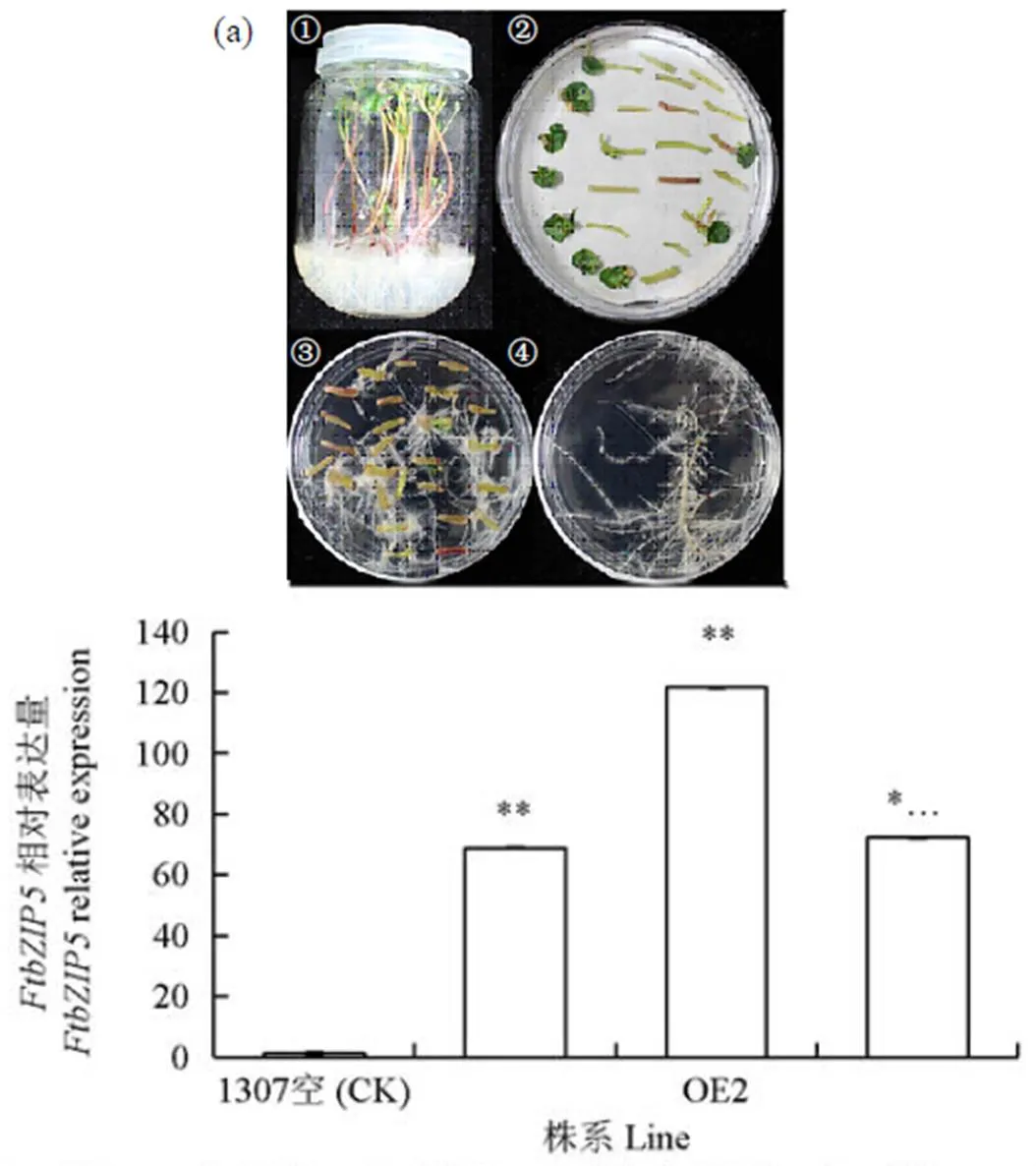
①生长10d后的川荞1号无菌苗;②外植体共培养;③诱导10d后的外植体;④阳性毛状根
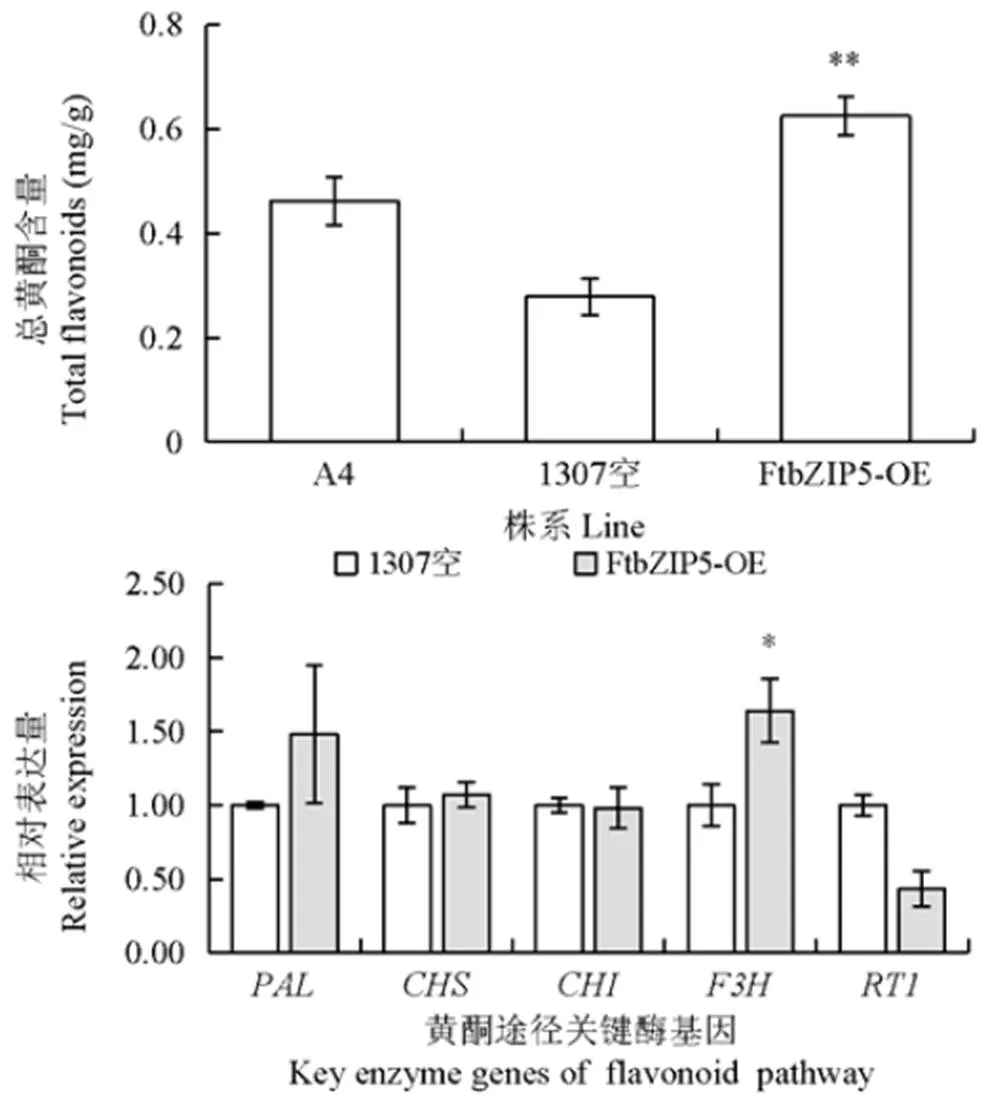
选择3个A4、1307空载体株系和3个过表达转基因株系在同一阶段取样,用分光光度计法测定毛状根总黄酮含量;其标准曲线为=19.946+0.5193(²=0.9954)。结果(图5a)显示,基因过表达株系的总黄酮含量达到0.96mg/g,约是A4野生型株系的2倍,表明基因能够促进黄酮类化合物的合成。用qRT-PCR检测关键酶基因()的表达量,如图5b所示,除了的表达量有升高的趋势外,过表达毛状根中的表达量都没有显著上调甚至是下调。表明基因可能是通过调节黄酮合成途径的关键酶基因来促进黄酮类化合物的合成。
2.5 FtbZIP5的过表达毛状根的抗盐性鉴定
图6a所示,用NaCl(100mmol/L)胁迫毛状根,在7d时,过表达毛状根总黄酮含量为0.63mg/g,显著低于不处理时(0.96mg/g),与1307空毛状根未处理时的含量(0.64mg/g)相差不大。

PAL:苯丙氨酸解氨酶基因;CHS:查尔酮合成酶基因;CHI:查尔酮异构酶基因;F3H:黄烷酮3-羟化酶基因;RT1:鼠李糖基转移酶基因。“*”表示P < 0.05,下同
以1307空为对照,在NaCl(100mmol/L)胁迫毛状根3d后,检测了过表达株系中黄酮合成途径关键酶基因的表达情况。图6b所示,关键酶基因在过表达株系中有升高的趋势,是1307空的1.5倍;而和都是下降的,表明在盐胁迫下,黄酮途径的关键酶基因在黄酮合成途径中发挥着重要作用。
如图6c所示,随着胁迫时间的增长,-OE的CAT活性呈先升高后降低的趋势,并在胁迫3d时最高,为32.26U/g,是对照(1307空)的2倍多;在胁迫5d时,A4毛状根的CAT活性低至6.19U/g,但-OE的CAT活性(24.20U/g)和胁迫0d时(21.39U/g)差异不大。由此可知,在盐胁迫下,毛状根可能通过增加体内的CAT活性来清除过氧化氢等活性氧,从而提高了毛状根的耐盐性。
MDA含量的高低代表了植株体内膜脂受损伤的严重程度,也是一个评价植物耐盐性的指标。由图6d可看出,其含量在NaCl胁迫后先升高后降低。A4和1307空株系毛状根MDA含量升高至3d时达到最高值(A4为14.39nmol/g,1307空为18.50nmol/g),高于FtbZIP5-OE(10.36nmol/g);在NaCl的不断胁迫下,其含量在-OE中趋于稳定,且显著低于另2个株系(<0.01)。由此可以看出,在相同的盐胁迫下,过表达株系膜脂过氧化程度较低,被损害程度低。
3 讨论
本研究从川荞1号中克隆了一个抗盐转录因子基因,它通过调控黄酮合成关键酶基因的表达来调节荞麦类黄酮物质的合成。与其他研究[15]结果类似,该蛋白位于细胞核内,具有转录激活活性。此外,对基因在川荞1号不同组织中的表达进行了检测,结果表明,盐胁迫和外源ABA都诱导的表达,且在茎和叶中表达较明显。通过建立过表达毛状根株系,检测到相关酶基因(黄酮合成途径)在毛状根中的表达,可知基因通过调控黄酮合成关键酶基因来调节黄酮类物质的合成。通过对毛状根进行盐胁迫处理,过表达株系的总黄酮含量显著高于对照。且过表达毛状根可能通过提高CAT活性和降低MDA含量来增强其耐盐性。
在荞麦中,已经有成熟的根癌农杆菌介导的毛状根遗传转化体系,且得到的毛状根遗传稳定性高。它们由同一细胞分化而来,得到的阳性过表达毛状根的概率高,在培养中的增长速度快,且次生代谢产物的产量都高于原植株含量[20]。因此,毛状根是研究荞麦重要生物活性物质积累的代谢途径的理想生物模型。在逆境胁迫下,植株体内次级代谢产物的积累对其耐盐能力有着很重要的影响,如SOD和MDA对植物具有重要的保护作用[21]。因此,本文通过研究荞麦毛状根的耐盐性,为荞麦耐盐生理机制奠定基础。
植物受盐害主要表现为体内的生理干旱和活性氧的过度积累。植物遭受严重的盐害会导致体内细胞和组织的氧化损伤,并降低植物产量和品质[22]。有研究[16]表明,在苯丙素途径中产生的黄酮类代谢产物会在盐胁迫后发生变化。在水稻上,花青素、芹菜素-7-O-葡糖苷和毛地黄皂苷等黄酮类化合物可作为植物体内的抗氧化剂,它们通过除去活性氧和降低氧化损伤程度来保护植物,阻止植株和离体的叶片失水,保证植株正常生长[23-24]。本研究中,过表达能促进总黄酮的积累,推测其毛状根株系具有一定的耐盐性。
在植物体内,黄酮合成受到和等酶基因的调节和光照、温度、逆境胁迫和紫外线等环境因子的影响[14]。之前的研究[25]表明,植物在盐胁迫下,体内会产生茉莉酸等激素来诱导参与苯丙素途径的酶(苯丙氨酸解氨酶),从而导致黄酮类物质的合成。也有研究[26]发现,在用NaCl处理荞麦时,荞麦体内黄酮合成基因的表达量显著增加,导致了黄酮化合物的积累增加。拟南芥中已报道出转录因子协同调节光诱导的类黄酮合成途径,主要是与黄酮合成关键酶基因和启动子结合,参与控制光诱导的类黄酮生物合成[14]。在本研究中,促进过表达毛状根株系的总黄酮积累,且F3H酶基因上调表达。并且在盐胁迫下,黄酮合成关键酶基因的表达没有受到抑制,表明在盐胁迫下,很可能是通过调节黄酮合成关键酶基因的表达来调控黄酮合成。
受到盐胁迫后,植物体内会产生一系列酶清除物质(过氧化物酶)和非酶清除物质(黄酮类物质)来提高植物的耐盐性[27];在本研究中,受到胁迫后的过表达毛状根的总黄酮含量(0.63mg/g)高于对照植株。经过100mmol/L NaCl处理不同时间后,过表达株系的CAT活性呈现先升高后降低的趋势,这表明在适当的盐胁迫诱导下,植物可能通过提高体内的CAT活性来清除活性氧,维持植株正常生长,提高植物耐盐性[28]。在植物中,MDA的积累升高了膜脂过氧化程度,抗逆性降低[29];在文中的过表达毛状根株系中,MDA含量最低,表明该株系体内的过氧化程度低,组织细胞膜损伤程度低,受到的伤害较小,所以耐盐性强。综上所述,基因通过调节黄酮合成途径中关键酶基因来调控黄酮合成。在盐胁迫下,通过过表达,增加了毛状根CAT活性,并降低了MDA含量,从而提高了其耐盐性。因此,基因上调提高了苦荞毛状根黄酮合成并提高其耐盐性。
4 结论
在盐胁迫下总黄酮的积累可能与关键酶基因的上调表达有关。并且在盐胁迫下,可以通过在毛状根中积累次生代谢产物CAT并减少MDA的积累来提高毛状根的耐盐性。据此推测基因上调提高了苦荞毛状根黄酮合成并提高其耐盐性。
[1] 唐宇,邵继荣,周美亮. 中国荞麦属植物分类学的修订. 植物遗传资源学报,2019,20(3):646-653.
[2] Liu Y X,Cai C Z,Yao Y L,et al. Alteration of phenolic profiles and antioxidant capacities of common buckwheat and tartary buckwheat produced in China upon thermal processing. Journal of the Science of Food and Agriculture,2019,99(12):5565-5576.
[3] Kanter M,Aktas C,Erboga M. Protective effects of quercetin against apoptosis and oxidative stress in streptozotocin-induced diabetic rat testis. Food and Chemical Toxicology,2012,50(3/4):719-725.
[4] Wahid A,Ghazanfar A. Possible involvement of some secondary metabolites in salt tolerance of sugarcane. Journal of Plant Physiology,2006,163(7):723-730.
[5] Annamaria G,Marco M,Moira M,et al. Effect of nitrogen starvation on the phenolic metabolism and antioxidant properties of yarrow (Becker ex Rchb.). Food Chemistry,2008,114(1):204-211.
[6] Ariel F D,Manavella P A,Dezar C A,et al. The true story of the HD-Zip family. Trends in Plant Science,2007,12(9):419-426.
[7] Liu M,Wen Y,Sun W,et al. Genome-wide identification,phylogeny,evolutionary expansion and expression analyses oftranscription factor family in tartaty buckwheat. BMC Genomics,2019,20(1):483.
[8] Guo X L,Hou X M,Fang J,et al. The rice GERMINATION DEFECTIVE 1,encoding a B3 domain transcriptional repressor,regulates seed germination and seedling development by integrating GA and carbohydrate metabolism. The Plant Journal,2013,75(3):403-416.
[9] Corrêa L G,Riaño-Pachón D M,Schrago C G,et al. The role oftranscription factors in green plant evolution:adaptive features emerging from four founder genes. PLoS ONE,2008,3(8):e2944.
[10] Li X Y,Gao S Q,Tang Y M,et al. Genome-wide identification and evolutionary analyses oftranscription factors in wheat and its relatives and expression profiles of anther development relatedgenes. BMC Genomics,2015,16:976.
[11] Liu J X,Srivastava R,Che P,et al. Salt stress responses in Arabidopsis utilize a signal transduction pathway related to endoplasmic reticulum stress signaling. The Plant Journal,2007,51(5):897-909.
[12] Zhang S X,Haider I,Kohlen W,et al.Function of the HD-Zip I genein ABA-mediated drought and salt tolerances in rice. Plant Molecular Biology,2012,80(6):571-585.
[13] Lakra N,Nutan K K,Das P,et al. A nuclear-localized histone-gene binding protein from rice () functions in salinity and drought stress tolerance by maintaining chlorophyll content and improving the antioxidant machinery. Journal of Plant Physiology,2015,176:36-46.
[14] Hartmann U,Sagasser M,Mehrtens F,et al. Differential combinatorial interactions of cis-acting elements recognized by,,andfactors control light-responsive and tissue-specific activation of phenylpropanoid biosynthesis genes. Plant Molecular Biology,2005,57(2):155-171.
[15] Li Q,Zhao H X,Wang X L,et al. Tartary buckwheat transcription factor,regulated by,can improve salt/drought resistance in transgenic. International Journal of Molecular Sciences,2020,21(3):1123.
[16] Malacarne G,Coller E,Czemmel S,et al. The grapevinetranscription factor is involved in the regulation of flavonoid biosynthesis. Journal of Experimental Botany,2016,67(11):3509-3522.
[17] 卢晓玲,何铭,张凯旋,等. 苦荞鼠李糖基转移酶基因的克隆与转化毛状根研究. 作物杂志,2020(5):33-40.
[18] 谈天斌,卢晓玲,张凯旋,等.基因的克隆及在苦荞毛状根中的功能分析. 植物遗传资源学报,2019,20(6):1542-1553.
[19] 李为喜,朱志华,李国营,等. AlCl3分光光度法测定荞麦种质资源中黄酮的研究. 植物遗传资源学报,2008,9(4):502-505.
[20] Park N I,Li X H,Uddin R M,et al. Phenolic compound production by different morphological phenotypes in hairy root cultures ofGaertn. Archives of Biological Sciences,2011,63(1):193-198.
[21] 苏文华,张光飞,李秀华,等. 植物药材次生代谢产物的积累与环境的关系. 中草药,2005(9):139-142.
[22] 许盼云,吴玉霞,何天明. 植物对盐碱胁迫的适应机理研究进展. 中国野生植物资源,2020,39(10):41-49.
[23] Zhan X,Shen Q,Chen J,et al. Rice sulfoquinovosyl transferase SQD2.1 mediates flavonoid glycosylation and enhances tolerance to osmotic stress. Plant Cell Environment,2019,42(7):2215-2230.
[24] Dong N Q,Sun Y,Guo T,et al. UDP-glucosyltransferase regulates grain size and abiotic stress tolerance associated with metabolic flux redirection in rice. Nature Communications,2020,11(1):2629.
[25] Pedranzani H,Sierra-de-Grado R,Vigliocco A,et al. Cold and water stresses produce changes in endogenous jasmonates in two populations ofAit. Plant Growth Regulation,2007,52:111-116.
[26] Li X H,Kim Y B,Kim Y,et al. Differential stress-response expression of two flavonol synthase genes and accumulation of flavonols in tartary buckwheat.Journal of Plant Physiology,2013,170(18):1630-1636.
[27] Abdallah S B,Aung B,Amyot L,et al. Salt stress (NaCl) affects plant growth and branch pathways of carotenoid and flavonoid biosyntheses in. Acta Physiologiae Plantarum,2016,38(3):72.
[28] 王琰,陈建文,狄晓艳. 水分胁迫下不同油松种源SOD、POD、MDA及可溶性蛋白比较研究. 生态环境学报,2011,20(10):1449-1453.
[29] 刘会超,贾文庆. 盐胁迫对白三叶茎的POD、CAT的影响研究. 吉林农业科学,2009,34(1):43-46.
The Overexpression ofImproves Accumulation of Flavonoid in the Hairy Roots of Tartary Buckwheat and Its Salt Tolerance
Weng Wenfeng1,2, Wu Xiaofang2, Zhang Kaixuan2, Tang Yu3, Jiang Yan1, Ruan Jingjun1, Zhou Meiliang2
(1College of Agronomy, Guizhou University, Guiyang 550025, Guizhou, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3College of Food Science and Technology, Sichuan Tourism University, Chengdu 610100, Sichuan, China)
Thetranscription factors, with an important role in salt stress network, can regulate flavonoid accumulation in plant. In this paper, thefamily genewith transcriptional activation activity, was cloned from the ‘Chuanqiao 1’. Expression ofgene in stems and leaves was higher than that in root when treated by NaCl and abscisic acid. Flavonoid detection was carried out on hairy roots of overexpressing thegene strain, and results showed that flavonoid accumulation in overexpressing strains was significantly higher than that in wild-type plants. And the expression of key enzyme gene flavanone-3-hydroxylase () in flavonoid synthesis pathway was high, which can speculate that accumulation of total flavonoids in overexpressed hair root strains was associated withexpression. Under the stress of 100mmol/L NaCl, the accumulation of total flavonoids in all lines was suppressed, and the content of total flavonoids in overexpression lines decreased to 0.63mg/g, and the expression ofwas still higher than that of the control. Catalase activity of the control was significantly lower than that of the overexpressing strains after stressing. After stressing by NaCl, the content of malondialdehyde in wild-type plants increased and that in overexpressing strains was stable. The above results indicated that overexpressing thegene in the hairy roots, the increase in total flavonoid content may be regulated by the up-regulation of the key enzyme gene; andalso improved the salt tolerance of tartary buckwheat roots. This paper analyzed the role ofin the accumulation of total flavonoids and salt tolerance in the hairy roots of tartary buckwheat, and laid a foundation of studying the salt tolerance of buckwheat and analyzing the salt tolerance mechanism of buckwheat.
Tartary buckwheat;; Flavonoids; Salt stress
10.16035/j.issn.1001-7283.2021.04.001
翁文凤,主要从事荞麦品质抗逆研究,E-mail:1332721469@qq.com
阮景军为通信作者,研究方向为苦荞种质资源创新和抗逆境关键基因挖掘,E-mail:jjruan@gzu.edu.cn;周美亮为共同通信作者,研究方向为荞麦属植物种质资源与品质抗逆研究,E-mail:zhoumeiliang@caas.cn
国家重点研发计划(2019YFD1001300,2019YFD1001304)
2021-01-12;
2021-05-08;
2021-05-28

