两种石斑鱼性腺分化前后脑垂体中FSHβ和LHβ细胞免疫组织化学及其基因表达
徐文刚,刘立明,王九龙,于文松,孙明,征矢野清,唐永政*
(1.烟台大学 海洋学院,山东 烟台 264005;2.烟台市海洋经济研究院,山东 烟台 264003;3.山东海洋现代渔业有限公司,山东 烟台 264003;4.長崎大学 環東シナ海環境資源研究センター,日本 長崎 851-2213)
大多数雌雄同体的鱼类一生中要经过性腺分化、卵原细胞增殖、卵母细胞发育、性成熟和性逆转阶段[8],而性腺分化作为其中一个关键阶段,研究者已开展了一些相关研究和报道,如利用外源17α-甲基睾酮诱导赤点石斑鱼[9]和褐石斑鱼E.bruneus[10]幼鱼性腺分化为雄性。近期的研究表明,赤点石斑鱼的性细胞起源于胚胎时期的原始生殖细胞(primordial germ cells,PGCs),PGCs分裂和分化并迁移到生殖脊后共同形成原始性腺,原始性腺发育至一定阶段后开始加速有丝分裂,形成卵巢[5,11]。但在石斑鱼性腺分化阶段,有关其内分泌调节机制的报道相对较少。
硬骨鱼类生长发育过程中,内分泌系统受到下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis, HPG轴)的调节。鱼类受到光照和水温等环境因子的刺激后,下丘脑分泌的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)诱导垂体合成分泌促性腺激素(gonadotropins, GtHs)。GtHs中的促卵泡激素(follicle stimulating hormone, FSH)和黄体生成素(luteinizing hormone, LH)随血液到达性腺并促进性腺合成性类固醇激素(雌、雄激素),从而促进鱼类性腺分化及性腺发育与成熟[12-13]。研究表明,FSH和LH是非共价结合的糖蛋白,由一个共同的α亚基和具有特异性的β亚基组成异源二聚体,这表明其具有生物学特异性[14]。对鲑Oncorhynchus[15-18]、星康吉鳗Congermyriaster[19]、日本鳗鲡Anguillajaponica[20]和欧洲鲈Dicentrarchuslabrax[21]的研究表明,FSHβ对性腺早期发育(如精子和卵子的生长)具有重要影响,LHβ主要调控性腺发育的成熟阶段如排卵和排精等行为。而对蜂巢石斑鱼E.merra的研究表明,FSHβ作为一种潜在的雄激素能够诱导雌性逆转为雄性[22]。以上研究表明,FSHβ和LHβ对鱼类性腺生长、发育和成熟具有重要作用。然而在石斑鱼性腺分化阶段,有关其FSHβ和LHβ的角色和功能仅在点带石斑鱼E.malabaricus中运用免疫组织化学(immunohistochemistry,IHC)和分子生物学(qRT-PCR)技术的研究中有少量报道[23]。本试验中,以日本较具代表性的经济鱼类赤点石斑鱼和黑边石斑鱼为研究对象,运用苏木精-伊红染色、免疫组织化学和qRT-PCR技术,对两种鱼类性腺分化前后脑垂体中的FSHβ和LHβ细胞进行免疫识别定位研究,并测定其脑垂体中fshβ和lhβ基因含量,探讨FSHβ和LHβ在其性腺分化过程中的角色,以期为未来石斑鱼在中国的人工繁殖和苗种生产提供科学参考。
1 材料与方法
1.1 材料
2018年6月在日本山口县水产研究所和东京都小笠原水产研究所分别对赤点石斑鱼和黑边石斑鱼亲鱼进行培育、催产、人工授精和鱼苗培育。育苗期间,用水先经沉淀沙滤,再用58 μm筛绢过滤。育苗池水温为23~28 ℃,盐度为29~31,pH为7.9~8.3,溶解氧为5 mg/L以上,保持24 h增氧。育苗池上方用布帘调节光照,避免阳光直射。
饲养期间,每日早晚各投喂一次。仔鱼孵化后3日左右开始开口摄食,投喂体长为100 μm的SS型轮虫(日清丸红饲料, 日本),直至12日龄,保持水体中饵料密度为25~35 ind./mL;12~30日龄的仔鱼投喂体长为200 μm的L型轮虫,保持水体中饵料密度为5~15 ind./mL;30~50日龄的仔鱼投喂配合饲料Ohitome B1(日清丸红饲料, 日本);50~120日龄的稚鱼投喂配合饲料Ohitome C2。
1.2 方法
1.2.1 性腺和脑样品组织的采集 分别取孵化后55、80、120日龄的赤点石斑鱼和黑边石斑鱼幼鱼用于试验,每次采样数量各12尾。将幼鱼用2-苯氧乙醇麻醉后测量其体长和体质量,然后解剖采样。性腺的采集中,由于幼鱼的性腺太小,肉眼无法识别,故将55日龄幼鱼体腔的后半部全部固定在波恩试剂中;80和120日龄的幼鱼,去除体腔后半部的肌肉后将性腺连同内脏一起固定在波恩试剂中,用于性腺组织学观察。脑的采集中,取6尾55日龄幼鱼的头部整个固定在波恩试剂中,各取6尾80、120日龄幼鱼的头盖骨去除外骨骼后,将脑和脑垂体连同部分骨骼一同固定在波恩试剂中,用于脑垂体组织学及免疫组织化学试验。固定在波恩试剂中的样品24~48 h后均需转移至体积分数为70%的酒精中保存,用于试验。再分别另取6尾55、80、120日龄幼鱼的脑垂体保存在RNAlater试剂(Ambion Inc., Invitrogen Life Technologies, Japan)中于4 ℃下低温保存,一周后废弃RNAlater,并转移至-80 ℃超低温冰箱中长期保存,用于分子生物学试验。
1.2.2 切片的制备和组织学试验 将保存在体积分数70%酒精中的体腔、头部和头盖骨用EDTA脱钙液脱钙,对脱钙样品进行常规梯度酒精脱水、二甲苯透明、石蜡包埋和连续切片,切片厚度为5 μm。体腔切片采用苏木精-伊红(H.E.)染色、中性树胶封片,在光学显微镜(Olympus FX380型)下观察并拍照。头部和头盖骨切片用于免疫组织化学试验。参照文献[24-26]中的方法对性腺发育进行分期并描述如下:
1)性腺未分化阶段(undifferentiated gonadal stage, Ug)。生殖脊(gential ridge, Gr)在胚胎阶段由中胚层的体细胞发育而成,位于背肠系膜两侧的腹腔壁膜上。原始生殖细胞(PGCs)在胚胎发育过程中迁移至生殖脊中形成性腺原基。性腺原基成对出现,由肠系膜连接且位于肠道附近,含有性原细胞和血管。
中药产业具有卫生资源、经济资源、科技资源、文化资源和生态资源5大资源优势,同时具有传统和现代产业的特点。从传统产业看,中药产业是中医药体系中不可分割的一部分,其产业特征与化学制药具有明显的不同,中药产业链长,依赖自然资源、农业生产和气候条件,且地域性强[7]。从现代产业看,中药产业是以中药农业为基础、中药工业为核心、中药商业为纽带、中药知识业为动力的完整产业体系,目前各环节日益规模化、标准化,逐步脱离自然经济的特征。
2)性腺分化阶段(differentiated gonadal stage, Dg)。性腺原基两端的结缔组织向前延伸并形成突起,但两端突起部位尚未完全连接在一起,表明性腺分化正在进行,卵巢腔正在形成。
3)卵巢阶段(ovarian stage, Ov)。性腺原基两端的突起完全连接在一起,卵巢腔已经形成,卵原细胞开始出现,具有较大的细胞核且被较薄的细胞质所包围。卵巢腔的形成标志着性腺已分化为卵巢,石斑鱼性腺分化为雌性。
1.2.3 抗原暴露试验 头部和头盖骨固定在波恩试剂后其脑垂体中的蛋白抗原会被封闭,因此,必须进行抗原暴露试验。将头部和头盖骨切片用梯度酒精脱水后浸泡在10 mmol/L柠檬酸溶液中,用微波炉加热至90 ℃并恒温保持15 min。随后将切片置于室温下冷却1 h并用蒸馏水洗净。
1.2.4 脑垂体中FSHβ和LHβ细胞免疫组织化学的识别和定位 细胞免疫组织化学试验采用抗生物素蛋白-生物素过氧化物酶法。将切片浸泡在含0.3% H2O2的甲醇中1 h后,用PBS缓冲液冲洗干净后在体积分数为10%的山羊血清中封闭15 min,分别滴加兔抗底鳉FundulusheteroclitusFSHβ(稀释1 000倍)和LHβ(稀释5 000倍)第一抗体(日本Shimizu博士赠送)在4 ℃下孵育一晚。然后用PBS缓冲液冲洗15 min,用SAB-PO(R)试剂盒(nichirei Biosciences Inc., Japan)中的山羊抗兔IgG第二抗体溶液孵育1 h,在PBS中漂洗15 min后用链霉亲和素-HRP(horseradish peroxidase)溶液孵育30 min。再用PBS缓冲液冲洗10 min,用试剂盒中的DAB辣根过氧化物酶显色液(DAB horseradish peroxidase)观察免疫反应的信号。切片用苏木精复染后在显微镜下观察并拍照。
1.2.5 脑垂体总RNA的提取与反转录 取冻存的石斑鱼脑垂体,参照TRIzol试剂盒(Life Technologies Corp., USA)中的说明书进行总RNA的提取,经10 g/L琼脂凝胶电泳检测RNA完整度,用NanoDrop 2000 分光光度计检测RNA浓度。根据Transcriptor first strand cDNA synthesis(Roche Diagnostic GmbH, Mannheim, Germany)说明书操作,取1 μg总RNA为反转录模板合成第一链cDNA,用于PCR的扩增。
1.2.6 脑垂体中fshβ和lhβ基因的实时荧光定量检测 根据基因库中各基因序列设计荧光定量引物,赤点石斑鱼fshβ和lhβ引物用Primer Express软件设计,由Integrated DNA Technologies公司(USA)合成;黑边石斑鱼fshβ、lhβ和18S引物用Primer 3 Plus软件设计,由Fasmac公司(Kanagawa, Japan)合成(表1)。
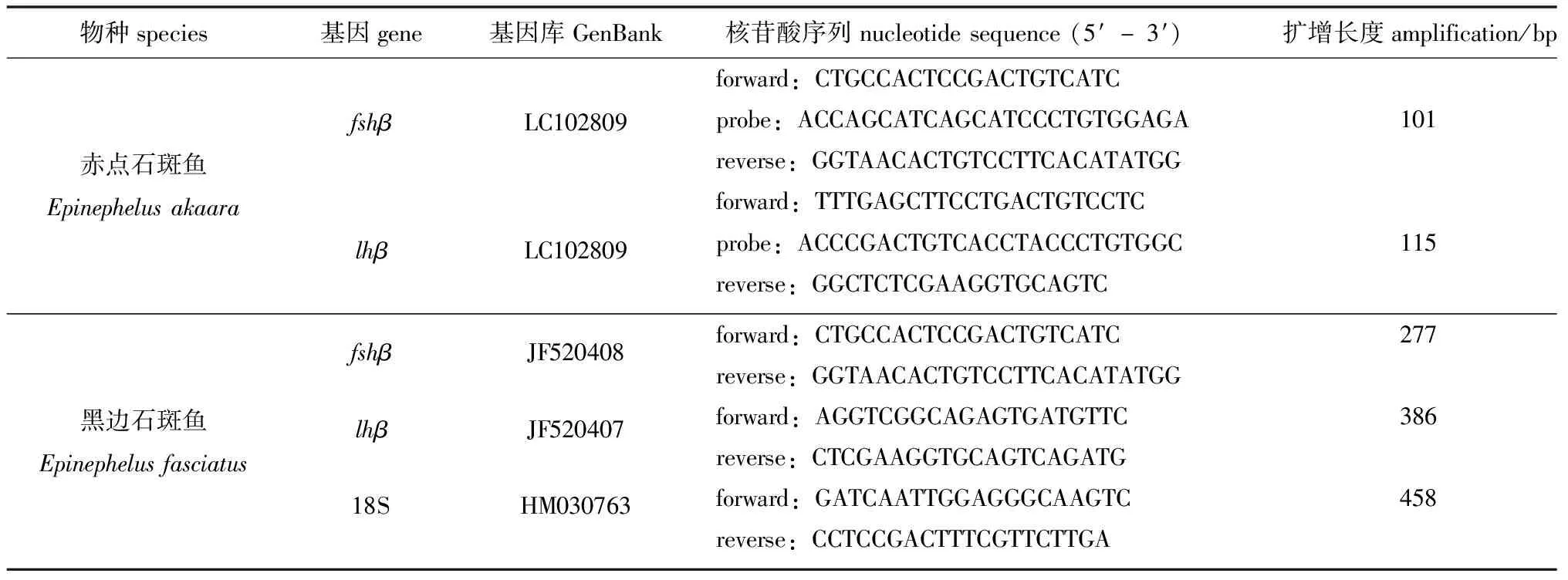
表1 实时荧光定量PCR反应中引物序列
赤点石斑鱼fshβ和lhβ基因测定参照FastStart Essential DNA Probe Master(Roche Diagnostics, Mannheim, Germany)试剂盒说明书操作。PCR反应体系(共10 μL):cDNA 模板2.5 μL,Probe Master(2×concentrate)5 μL,探针引物(Primer F、Primer R 10 pmol/μL,Probe 5 pmol/μL)0.5 μL,灭菌超纯水2 μL。在Light Cycler®480进行PCR反应,条件如下:95 ℃下预变性3 min;95 ℃下循环变性 15 s,60 ℃退火复性1 min,共进行45个循环;95 ℃下熔解5 s,65 ℃下熔解1 min;最后在50 ℃下冷却30 s。PCR反应后获得熔解曲线,基因表达量用绝对定量法进行统计分析。
黑边石斑鱼fshβ和lhβ基因测定参照FastStart Essential DNA Green Master(Roche Diagnostics GmbH, Mannheim, Germany)试剂盒说明书操作。PCR反应体系(共10 μL):cDNA 模板1 μL,Green Master(2×concentrate)5 μL,上、下游引物(10 pmol/μL)各1 μL,灭菌超纯水2 μL。在 Light Cycler®480进行PCR反应,条件如下:94 ℃下预变性5 min;94 ℃下循环变性10 s,60 ℃下退火复性 10 s,72 ℃下延伸 10 s,共进行45个循环;95 ℃下熔解5 s,65 ℃下熔解1 min;最后在50 ℃下冷却30 s。PCR反应后获得熔解曲线,基因表达量用相对定量法进行统计分析,以18S ribosomal RNA作为内参基因。
1.3 数据处理
试验数据均以平均值±标准误(means±S.E.)表示。采用SPSS 22.0软件对试验数据进行单因素方差分析,采用Kolmogorov-Smirnov 法进行正态分布检测,利用Tukey’s HSD 法进行组间差异性比较分析,显著性水平设为0.05。
2 结果与分析
2.1 赤点石斑鱼和黑边石斑鱼的生长指标
从表2可见:试验开始时,55日龄的赤点石斑鱼体长为(25.32±0.48)mm,体质量为(0.32±0.01)g,黑边石斑鱼体长为(21.67±0.32)mm,体质量为(0.25±0.00)g;试验结束时,120日龄的赤点石斑鱼体长为(88.67±2.18)mm,体质量为(11.61±0.59)g,黑边石斑鱼体长为(75.56±1.95)mm,体质量为(9.46±0.44)g。

表2 赤点石斑鱼和黑边石斑鱼在55、80、120日龄时体长和体质量的变化
2.2 赤点石斑鱼和黑边石斑鱼性腺的组织学观察
赤点石斑鱼和黑边石斑鱼性腺发育情况基本一致。55日龄时,性腺位于肠道附近,由一对小叶向前延伸并形成两片突起,性腺内有性细胞、肌肉细胞和血管,性细胞位于中心并被肌肉细胞所包围(图1(a)A、B和图1(b)A、B);80日龄时,性腺两端的结缔组织向前延伸并形成小片突起,但尚未完全闭合在一起,表明卵巢腔正在形成(图1(a)C和图1(b)C);120日龄时,性腺左右两侧的结缔组织进一步向前延伸并完全闭合在一起,形成一个空腔为卵巢腔,卵巢腔的形成标志着性腺分化为雌性,卵原细胞出现在卵巢腔周围(图1(a)D和图1(b)D)。
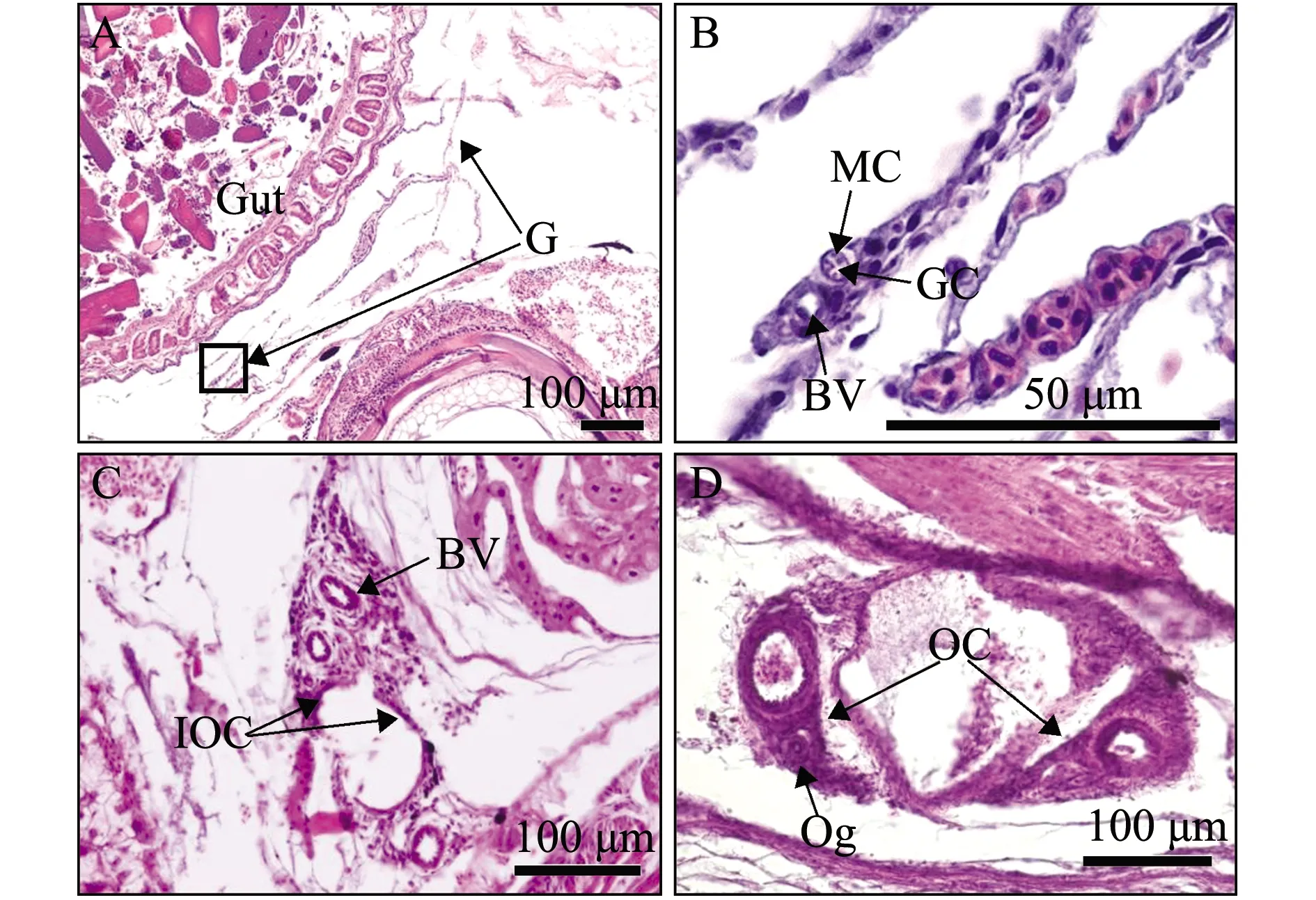
(a)赤点石斑鱼Epinephelus akaara
2.3 脑垂体结构及脑垂体中FSHβ和LHβ细胞免疫组织化学的识别和定位
赤点石斑鱼的脑垂体结构(图2(a)A1~A3)和黑边石斑鱼的脑垂体结构(图2(b)A1~A3)基本一致;脑垂体位于间脑腹侧突起呈漏斗状结构,由神经垂体(neurohypophysis, NH)和腺垂体(adenohypophysis, AH)两部分构成,腺垂体进一步分为3小部分,从左至右分别为前外侧部(rostral pars distalis, RPD)、中外侧部(proximal pars distalis, PPD)和中间部(pars intermedia, PI)。
55日龄时,赤点石斑鱼的FSHβ和LHβ细胞分布在PPD和PI区域(图2(a)B1、C1),黑边石斑鱼的FSHβ和LHβ分布在RPD和PPD区域(图2(b)B1、C1);80日龄时,赤点石斑鱼和黑边石斑鱼的FSHβ和LHβ均分布在PPD区域,LHβ分布在PPD区域(图2(a)B2、C2和图2(b)B2、C2);120 日龄时,赤点石斑鱼的FSHβ分布在PPD和PI区域(图2(a)B3、C3),黑边石斑鱼的FSHβ和LHβ均分布在PPD区域(图2(b)B3、C3)。
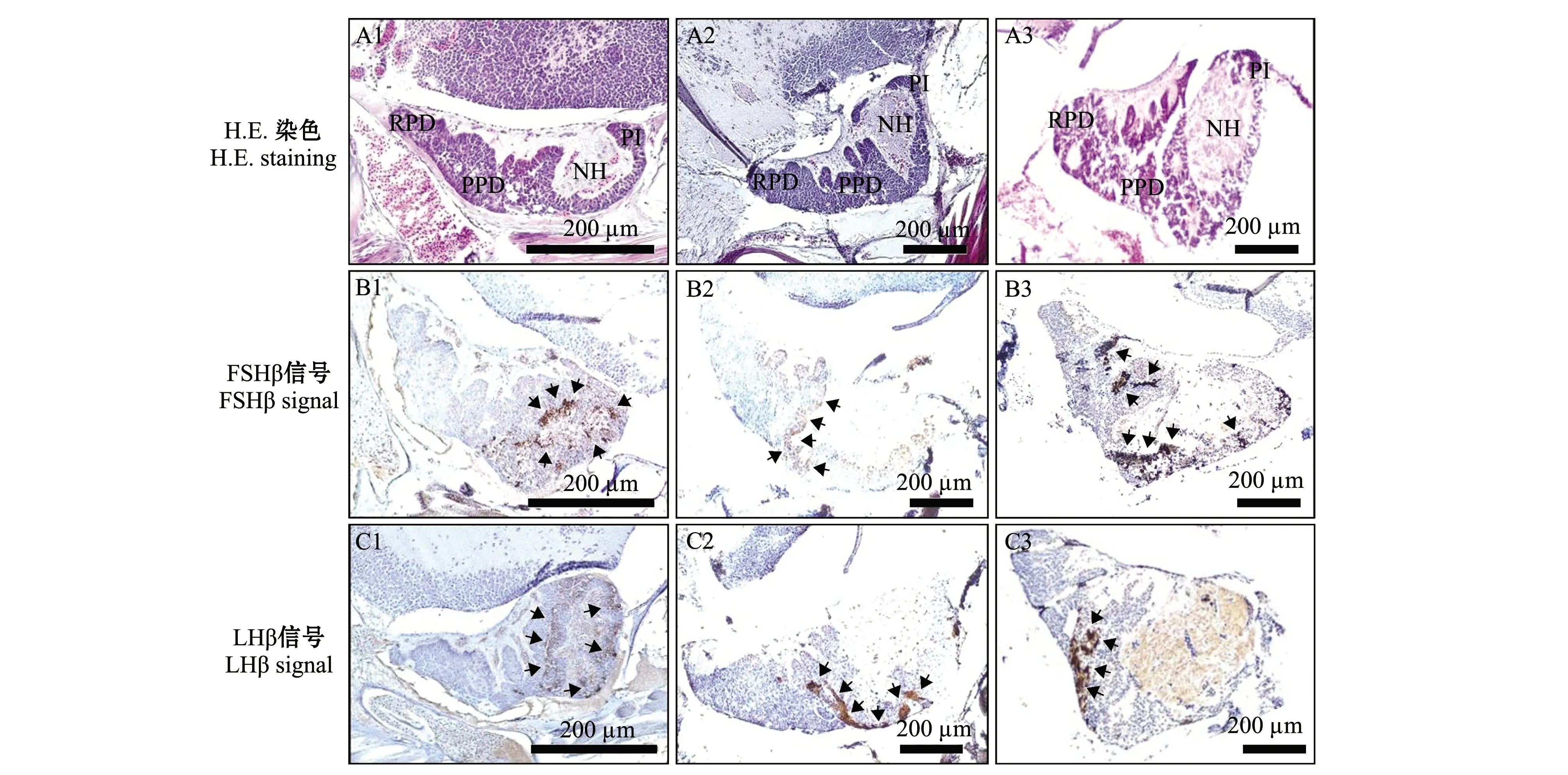
(a)赤点石斑鱼Epinephelus akaara
2.4 脑垂体中fshβ和lhβ基因表达量的变化
从图3可见:赤点石斑鱼脑垂体中fshβ基因含量在120日龄时显著高于55、80日龄(P<0.05),但lhβ基因含量无显著性差异(P>0.05);黑边石斑鱼脑垂体中fshβ和lhβ基因含量在120日龄时均显著高于55和80日龄(P<0.05)。
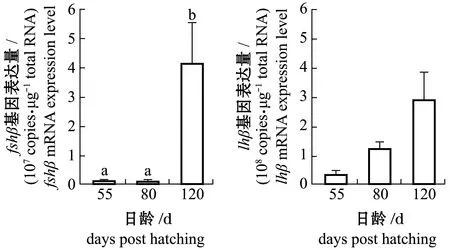
(a)赤点石斑鱼Epinephelus akaara
3 讨论
3.1 赤点石斑鱼和黑边石斑鱼性腺分化的过程
本试验表明,赤点石斑鱼和黑边石斑鱼性腺发育在55日龄时为未分化阶段,80日龄时为分化阶段,120日龄时为卵巢阶段。已有研究表明,褐石斑鱼在60日龄时性腺两端结缔组织突起并延伸,卵巢腔雏形开始形成,80日龄时结缔组织突起更加发达并扩展,110日龄时卵巢腔已经完全形成[26]。但在点带石斑鱼中,11、39日龄为性腺未分化期,47、74日龄为分化期,144日龄为卵巢阶段[27]。此外,韩国学者Kim等[5]的研究表明,赤点石斑鱼在65日龄时结缔组织开始延伸形成突起,在70、80、90、100日龄时,结缔组织进一步向前生长并延伸,105日龄时卵巢腔已完全形成。而本研究中的赤点石斑鱼在120日龄时卵巢腔才完全形成,与Kim等[5]报道的105日龄有所差异,表明性腺分化可能受到栖息地和饲养条件如水温等环境因素的影响。有研究表明,水温对欧洲鲈[28]和金鱼Carassiusauratus[29]的性腺分化有重要影响。然而,本试验中55~80日龄期间两种石斑鱼性腺发育的情况,以及水温对其性腺分化影响的研究尚未开展,今后需进一步研究。
3.2 赤点石斑鱼和黑边石斑鱼脑垂体中FSHβ和LHβ细胞的抗体特异性
目前,运用免疫组织化学技术识别鱼类FSHβ和LHβ细胞的试验中,关键因素在于第一抗体能否较好地与抗原相结合,因为抗体与抗原间存在物种特异性反应。以往的研究表明,由日本学者Shimizu博士开发的兔抗底鳉FSHβ和LHβ抗体不仅被运用在检测底鳉脑垂体中的FSHβ和LHβ细胞[30],也被运用于真鲷Pagrusmajor[31]、小口黑鲈Micropterusdolomieu[31]和慈鲷Cichlasomadimerus[32]中,表明兔抗底鳉FSHβ和LHβ抗体能够较好地与多种鱼类的抗原相结合,尤其此抗体也适用于石斑鱼类如蜂巢石斑鱼E.merra[22]和点带石斑鱼[23]。因此,本试验中运用此抗体检测赤点石斑鱼和黑边石斑鱼脑垂体中的FSHβ和LHβ细胞,结果表明,兔抗底鳉FSHβ和LHβ抗体可有效地对两种石斑鱼脑垂体中的FSHβ和LHβ细胞进行识别并定位。
3.3 赤点石斑鱼和黑边石斑鱼脑垂体中FSHβ和LHβ细胞的分布及其角色
研究表明,硬骨鱼类中的FSHβ和LHβ细胞主要分布在脑垂体PPD区域[33]。本试验表明,赤点石斑鱼和黑边石斑鱼脑垂体结构分为NH、RPD、PPD和PI部分,与大多数硬骨鱼类的脑垂体结构一致[33],且在性腺发育各阶段,脑垂体中FSHβ和LHβ主要集中在PPD区域,少量出现在RPD或PI区域。在多数硬骨鱼如银汉鱼Odontesthesbonariensis[31]、底鳉[32]、慈鲷[32]、蜂巢石斑鱼[22]和点带石斑鱼[23]中,FSHβ和LHβ信号大量集中在PPD区域,少量在PI区域。因此,本试验中观察到的FSHβ和LHβ在脑垂体中的分布与上述硬骨鱼的分布大致相同。
本试验表明,赤点石斑鱼和黑边石斑鱼脑垂体中FSHβ和LHβ蛋白信号在55、80、120日龄时均被检测到,且赤点石斑鱼脑垂体中fshβ基因含量及黑边石斑鱼脑垂体中fshβ与lhβ含量在120日龄时均显著高于55、80日龄,这表明FSHβ和LHβ与两种石斑鱼的性腺分化密切相关。在虹鳟Oncorhynchusmykiss[35]、南方鲇Silurusmeridionalis[36]和赤点石斑鱼[37]性腺分化过程中,fshβ和lhβ基因均被检测到;在银汉鱼性腺分化过程中,FSHβ和LHβ蛋白信号也被检测到[31]。上述研究结果分别从PCR和IHC角度表明,FSHβ和LHβ与硬骨鱼的性腺分化有关。然而对点带石斑鱼[23]、尼罗罗非鱼Oreochromisniloticus[38]和黄鳝Monopterusalbus[39]的研究表明,FSHβ和LHβ与性腺分化无关。此外,在底鳉[40]和欧洲鲈[21]中,只有FSHβ对性腺分化和早期卵母细胞的发育具有重要作用,而LHβ在性腺分化过程中的角色尚不明确。上述不同研究结果表明,硬骨鱼类脑垂体中FSHβ和LHβ在性腺分化过程中的角色具有物种特异性。本研究中,FSHβ和LHβ信号在两种石斑鱼各阶段均被检测到,且性腺分化刚结束阶段fshβ和lhβ基因含量出现显著性差异,表明FSHβ和LHβ在两种石斑鱼性腺分化过程中起重要作用,其角色可能是促进个体早期发育和加速性细胞的增殖。
4 结论
1)赤点石斑鱼和黑边石斑鱼性腺发育在55日龄时为未分化阶段,80日龄时为分化阶段,120日龄时为卵巢阶段。
2)两种石斑鱼在55、80、120日龄时的脑垂体结构相似,分为神经垂体(NH)和腺垂体(AH),腺垂体进一步细分为前外侧部(RPD)、中外侧部(PPD)和中间部(PI)。
3)兔抗底鳉FSHβ和LHβ抗体可有效对两种石斑鱼脑垂体中的FSHβ和LHβ细胞进行识别并定位。在两石斑鱼性腺分化的过程中,脑垂体中的FSHβ和LHβ起重要作用,其角色可能是促进个体的早期发育和加速性细胞的增殖。因此,在未来石斑鱼的人工繁殖和苗种生产过程中,可以考虑使用注射外源FSHβ和LHβ激素促进两种石斑鱼的个体发育并缩短性腺分化的时间。

